Происхождение и функции аппарата Гольджи.
В настоящее время в литературе существует две модели, объясняющие происхождение АГ. Согласно одной из них, АГ – это автономная органелла, существующая независимо и эволюционно отдаленно от ЭПР. Другая точка зрения предполагает, что все компоненты АГ находятся в динамическом равновесии с ЭПР и способны формироваться de novo из цистерн гранулярного ЭПР. Изучение генезиса АГ во время митоза подтверждает автономность его образования. Такой процесс деления и распределения цистерн АГ был назван диктиокинезом (термин введен в 1910г. Perroncito). По сравнению с диктиокинезом процесс формирования АГ из ЭПР более медленный. Поэтому существуетвероятность того, что в клетке действуют оба этих механизма: автономное образование АГ происходит в дочерних клетках, после митоза, а в остальное время клеточного цикла пластинчатый комплекс способен образовываться из ЭПР. Формирование АГ из цистерн ЭПР подтверждается данными о сохранении белков межцистернального матрикса в отсутствие мембран внутри ЭПР при делении клетки.
Описанные выше модели формирования АГ отражают и эволюционное происхождение этого компартмента клетки. Вероятно, в процессе эволюции пластинчатый комплекс образовался либо как вырост ЭПР, либо как инвагинация плазматической мембраны. В клетках растений и низших эукариотов АГ существует в виде многочисленных диктиосом, распределенных по всему объему цитоплазмы. В клетках животных пластинчатый комплекс, напротив, имеет околоядерное, а часто и перицентриолярное, расположение.
|
|
|
Взаимодействие аппарата Гольджи с ЭПР и ПМ.
Теория мембранного потока.
Мембранный транспорт, или мембранный поток («membrane flow»), является необходимым для обмена веществ между различными клеточными органеллами. В настоящее время для описания этого процесса принята следующая модель:
1) Внутриклеточный транспорт является направленным; транспорт от ЭПР через АГ к лизосомам, эндосомам или клеточной поверхности называется антероградным; транспорт в обратном направлении - ретроградным.
2) Транспортный путь проходит через ряд отдельных компартментов, перенос вещества между которыми осуществляется преимущественно с помощью окаймленных мембранных пузырьков. В клетке существует несколько типов окаймляющих белков и, соответственно, несколько типов окаймленных пузырьков, курсирующих между определенными компартментами.
3) Не все органеллы способны к прямому обмену пузырьками, например, транспорт между эндоплазматическим ретикулумом и эндосомами, лизосомами и плазматической мембраной может быть осуществлен только через аппарат Гольджи.
|
|
|
4) Процесс, в результате которого нужные вещества направляются в соответствующие компартменты, называют сортингом ("sorting").
На данный момент существует несколько теорий организации АГ.
Теории организации транспорта между ЭПР, АГ и ПМ.
Ø Теория постоянных компартментов.
Теория постоянных компартментов, или теория везикулярного транспорта – утверждает, что существуют мембрано-связывающие носители (везикулы) между ЭПР и АГ, между компартментами АГ и между транс-сетью Гольджи и плазматической мембраной. В последнем случае на уровне ТСГ (транс-сплетения Гольджи) формируются «гипотетические микровезикулы» (до сих пор не обнаружены), которые перемещаются к ПМ и сливаются с ней, в результате чего происходит освобождение содержимого во внеклеточную среду. Для объяснения специфичности слияния микровезикул с другими компартментами мембранной системы была выдвинута SNAPE-гипотеза (soluble N-ethyl-maleimide-sensiive factor attachment protein hypothesis), согласно которой на каждой микровезикуле и принимающей ее мембране имеются специальные белковые молекулы-рецепторы (SNAPE-рецепторы), характеризующиеся высоким сродством друг к другу.
Ø Мутарационно-диффузная теория, или модель цистернального созревания.
|
|
|
В последнее время распространение получила другая модель – мутарационно-диффузная, или модель цистернального созревания(модель прогрессии цистерн). Согласно этой гипотезе происходит постепенное созревание и превращение элементов ЭПР в цис-компартмент АГ и дальнейший переход его в транс-часть АГ. Так сначала в переходном ЭПР (ЭПР, мембраны которого не содержат рибосом и имеют большую толщину) концентрируются новосекретированные транспортные белки. Формируется структура, получившая название экзосома. Она имеет вид агрегата, состоящего из ветвящихся тубул и везикул, покрытых белком COP II (coat protein). В процессе созревания экзосомы к ее мембране присоединяется динеин-содержащий белковый комплекс, в результате чего она перемещается по микротрубочкам по направлению к центросоме и рядом расположенному пластинчатому комплексу. При этом связь между экзосомой и цистерной ЭПР может не обрываться, что приводит к вытягиванию тонкой мембранной трубочки ЭПР. Эти наблюдения подтверждают взаимосвязь мембран ЭПР и АГ. Транслоцированная экзосома либо сливается с уже существующей цис-цистерной АГ, либо формируют новую цис-цистерну.
|
|
|
Дальнейшее продвижение по АГ может идти несколькими путями. Так, например, высокомолекулярные грузы могут транспортироваться за счет цистернальной прогрессии, а низкомолекулярные непосредственно попадать в COP I-везикулы. Другим потенциальным видом транспорта является тубулярная сеть между цистернами.
Транс-сеть АГ (ТСГ) определяет дальнейший путь синтезированных белков. Они могут встраиваться в плазматическую мембрану, входить в состав лизосом и секреторных везикул. В транс-компартменте АГ постоянно формируются микровезикулы двух типов: покрытые COP I и клатрином. При этом клатриновые микровезикулы и трубочки содержат много резидентных белков пластинчатого комплекса, в то время как в микровезикулах, покрытых COP I, большинство резидентных белков отсутствует. Таким образом, везикулярный компартмент АГ содержит покрытия, образованные белками трех типов: клатрин, СОР I и COP II.
Организация мембран ЭПР, АГ и ПМ сохраняется за счет динамического баланса антероградного и ретроградного транспортов. Так по направлению от АГ к ЭПР происходит рециклизация везикул. В ЭПР сигналом для начала процесса отделения резидентных белков данной органеллы от всех остальных транзитных белков служит наличие на С-концах резидентных белков KDEL сигнальной последовательности (Lys-Asp-Glu-Leu). Есть данные о том, что контекст тоже имеет значение. Оказалось, что «отлов» белков ЭПР происходит в аппарате Гольджи, где имеется рецептор для KDEL (так называемые KDEL-рецепторы). Затем белки в комплексе с рецептором возвращаются в ЭПР путем ретроградного транспорта.
По-видимому, в осуществлении этого процесса участвует несколько белков, помимо рецептора KDEL. На дрожжах были получены две группы мутантов с нарушенным механизмом удержания резидентных белков ЭПР: erd1 и erd2. Продукты этих генов локализованы соответственно в цис-Гольджи и в медиал-Гольджи. Мутация erd1 плейотропна: в дрожжах, дефектных по этому гену нарушены также такие процессы как N-гликозилирование и О-гликозилирование и транспорт белков в вакуоли.
Кроме того, в процессе рециклизации резидентных белков ЭПР принимает участие и COP I. Ретроградным способом по микротрубочкам транслоцируются и эндоцитозные пузырьки. Для поддержания постоянного объема в клетке происходит обратный транспорт мембран от плазматической мембраны путем эндоцитоза. В этом транспорте также принимают участие микротрубочки.
Модификации белков в АГ.
Первые этапы модификации.
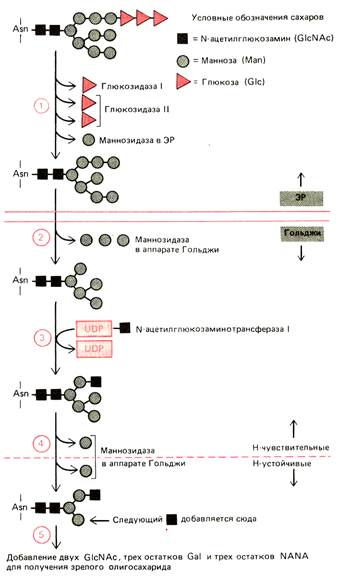 На рисунке указан процессинг олигосахаридов, протекающий в ЭПР и АГ. Сначала в ЭПР последовательно удаляется 3 остатка глюкозы (ферменты: глюкозидаза I и глюкозидаза II). Затем маннозидаза удаляет определенный остаток маннозы. В аппарате Гольджи маннозидаза I удаляет еще 3 остатка маннозы, а N-ацетилглюкозаминотрансфераза I добавляет остаток N-ацетилглюкозамина, не дающий маннозидазе II удалить 2 дополнительных остатка маннозы. В конце концов это приводит к образованию кора из 3 остатков маннозы. На этом этапе связь между остатками N-ацетилглюкозамина в коре становится устойчивой к атаке высокоспецифичной эндогликозидазы (Endo H).
На рисунке указан процессинг олигосахаридов, протекающий в ЭПР и АГ. Сначала в ЭПР последовательно удаляется 3 остатка глюкозы (ферменты: глюкозидаза I и глюкозидаза II). Затем маннозидаза удаляет определенный остаток маннозы. В аппарате Гольджи маннозидаза I удаляет еще 3 остатка маннозы, а N-ацетилглюкозаминотрансфераза I добавляет остаток N-ацетилглюкозамина, не дающий маннозидазе II удалить 2 дополнительных остатка маннозы. В конце концов это приводит к образованию кора из 3 остатков маннозы. На этом этапе связь между остатками N-ацетилглюкозамина в коре становится устойчивой к атаке высокоспецифичной эндогликозидазы (Endo H).
Следует отметить, что удаление остатков маннозы и присоединение N-ацетилглюкозамина происходит в промежуточном отделе аппарата Гольджи, а присоединение галактозы и сиаловой кислоты (NANA) – в транс-компартменте.
О-гликозилирование.
У некоторых белков сахара присоединяются к боковым цепям определенных остатков серина или треонина. Этот процесс называется О-гликозилированием. Катализируется гликозилтрансферазами. Наиболее сильно таким образом гликозилируются протеогликановые белки.
Дата добавления: 2018-09-22; просмотров: 1390; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
