Транспорт фосфолипидов из ЭПР в органеллы.
Занятие №9.
Вакуолярная система.
Транспорт белков. Сигнал сортировки белков.
Почти все белки образуются на рибосомах, расположенных в цитозоле. Белки, принадлежащие первой транспортной ветви, после завершения их синтеза выделяются в цитозоль. Некоторые из них содержат сигналы сортировки, направляющие их из цитозоля в митохондрии, ядро или пероксисомы, другие же - их большинство - не имеют специфических сигналов сортировки и остаются в цитозоле в качестве постоянных компонентов.
Второй путь транспорта используется для направления белков в эндоплазматический ретикулум для выведения белков из клетки, а также белков, направляемых в аппарат Гольджи, к плазматической мембране или в лизосомы. Все эти белки по мере их образования переносятся в эндоплазматический ретикулум при помощи сигналов сортировки, расположенных обычно на N-конце. Рибосомы, на которых собираются такие белки, остаются связанные с мембраной эндоплазматического ретикулума в течение недолгого времени после начала синтеза полипептидной цепи. Как только очередной участок полипептидной цепи синтезируется, он проникает через липидный бислой этой мембраны. Некоторые белки затем попадают в просвет эндоплазматического ретикулума, другие остаются частично заключенными в мембрану в качестве трансмембранных белков.
Полагают, что на белках существуют два вида сигналов сортировки, направляющие их, шаг за шагом, вдоль разветвляющихся путей. Для некоторых стадий сигналы сортировки представляют собой протяженный участок аминокислотной последовательности длиной 15-60 остатков (табл. 1). Когда эта стадия пройдена, такой сигнальный пептид отрезается. Сигналом сортировки для других стадий, вероятно, служит определенная трехмерная структура, образуемая атомами поверхности белка при свертывании его молекулы. Аминокислотные остатки, формирующие такие сигнальные участки, могут быть расположены очень далеко друг от друга в линейной последовательности белка.
|
|
|
Сигнальные пептиды направляют белки из цитозоля в эндоплазматический ретикулум, митохондрии, хлоропласты и ядро; они также отвечают за то, чтобы некоторые белки остались в эндоплазматическом ретикулуме. Сигнальные участки, видимо, играют важную роль при распознавании определенных лизосомных белков специальным ферментом в аппарате Гольджи.
Чтобы выяснить пункт назначения того или иного белка внутри клетки, необходимо определить тип его сигнального пептида (табл. 1). Белки, которые должны попасть в эндоплазматический ретикулум, обычно несут N-концевой сигнальный пептид. Его центральная часть образована 5-10 гидрофобными аминокислотными остатками. Большинство этих белков направляется из эндоплазматического ретикулума в аппарат Гольджи; те же, которые имеют на С-конце специфическую последовательность из четырех аминокислот, остаются в качестве постоянных компонентов. Многие белки, предназначенные для митохондрий, имеют сигнальные пептиды, в которых положительно заряженные аминокислотные остатки чередуются с гидрофобными. Среди белков, направляющихся в ядро, большинство имеет сигнальные пептиды, в которых положительно заряженные аминокислотные остатки чередуются с гидрофобными. Среди белков, направляющихся в ядро, большинство имеет сигнальные пептиды, образованные кластером положительно заряженных аминокислотных остатков. Наконец, некоторым белкам цитозоля присущи сигнальные пептиды, с которыми ковалентно связывается жирная кислота, направляющая эти белки к мембранам без проникновения в эндоплазматический ретикулум.
|
|
|
Табл. 1. Последовательности сигнальных пептидов.
| Функция сигнального пептида | Пример сигнального пептида |
| Импорт в ЭР | H3N-Met-Met-Ser-Phe-Val-Ser-Leu-Leu-Leu-Val Glu-Ile-Leu-Phe-Trp-Ala-Thr-Glu-Ala-Glu- Gln-Leu-Thr-Lys-Cys-Glu-Val-Phe-Gln |
| Оставление в просвете ЭР | -Lys-Asp-Glu-Leu-COO |
| Импорт в митохондрии | H3N-Met-Leu-Ser-Leu-Arg-Gln-Ser-Ile-Arg-Phe- Phe-Lys-Pro-Ala-Thr-Arg-Thr-Leu-Cys-Ser- Ser-Arg-Leu-Leu- |
| Импорт в ядро | -Pro-Pro-Lys-Lys-Lys-Arg-Lys-Val |
| Присоединение к мембране путем ковалентного связывания миристиновой кислоты с N-концом | H3N-Gly-Ser-Ser-Lys-Ser-Lys-Pro-Lys- |
|
|
|
H3N обозначает N-конец белка;_ COO обозначает карбоксильный конец.
2. Гранулярный эндоплазматический ретикулум.
В клетках млекопитающих импорт белков в эндоплазматический ретикулум (ЭПР) начинается еще до того, как полипептидная цепь полностью синтезирована, т. е. он происходит одновременно с трансляцией (котрансляционно).
Таким образом, в цитоплазме имеется две пространственно изолированные популяции рибосом. Одни из них (рибосомы, связанные с мембраной), расположены на обращенной к цитоплазме поверхности мембраны ЭПР и заняты синтезом белков, которые сразу же переносятся внутрь ЭПР. Другие (рибосомы свободные) не прикреплены ни к какой мембране и производят все остальные белки, кодируемые ядром. Связанные и свободные рибосомы идентичны по строению и функции. Они различаются только по белкам, которые синтезируются на них в каждый данный момент. Если рибосоме достается синтез белка с сигнальным пептидом для ЭПР, то такой сигнал направляет рибосому к мембране эндоплазматический ретикулум.
|
|
|
2.1. Контрансляционный транспорт.
Следует обратить внимание на функции SRP (signal-recognition particle):
— узнавание сигнальной последовательности (SS – signal sequence),
— остановка элонгации,
— промотирование транслокации.
SRP – 11S рибонуклеопротеид, состоящий из 7S РНК и 6 белков, которые называются по их массе: 9, 14, 68, 72, 54, 19 кДа. Некоторые из них входят в состав SRP в виде димеров, другие – в виде мономеров. Если удалить белок 54 кДА, то не происходит узнавание SS, то есть SRP инактивируется. 7S-РНК относится к малой плазматической РНК.
SRP плотно захватывает рибосому, присоединясь и к сигнальному пептиду (как только он появляется на большой субъединице рибосомы), и к рибосомному участку связывания аминоацил-тРНК. В результате трансляция останавливается, так как блокируется связывание следующей аминоацил-тРНК с рибосомой.
Пауза в трансляции длится до тех пор, пока захватившая рибосому частица не свяжется с SRP-рецептором, находящимся на цитоплазматической стороне гранулярного ЭПР. SRP-рецептор - это интегральный белок, состоящий из 2 частей: SR(α) и SR(β). SR(α) – поверхностный мембранный белок, с которым связывается SR(β) – интегральный белок мембраны ЭПР. При взаимодействии SRP-рецептора с SRP частица меняет свое положение и трансляция возобновляется. Иногда SRP-рецептор называют «причальным» белком.
Варианты взаимодействия:
1. 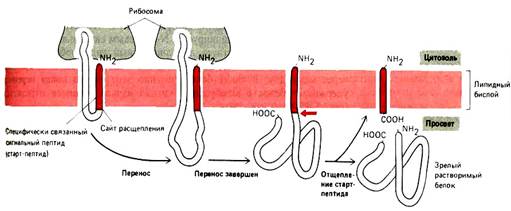 Полипептидная цепь (ППЦ) растет в полость канала. Гидрофобный сигнальный пептид (SS) служит сигналом начала переноса и остается погруженным в мембрану все то время, пока остальная часть молекулы белка протискивается через нее в виде большой петли. Когда через мембрану проходит С-конец ППЦ, белок остается связанным с мембраной только при помощи SS. Если SS подвергается действию сигнальной пептидазы, которая связана с мембраной ЭПР, то белок высвобождается в полость ЭПР.
Полипептидная цепь (ППЦ) растет в полость канала. Гидрофобный сигнальный пептид (SS) служит сигналом начала переноса и остается погруженным в мембрану все то время, пока остальная часть молекулы белка протискивается через нее в виде большой петли. Когда через мембрану проходит С-конец ППЦ, белок остается связанным с мембраной только при помощи SS. Если SS подвергается действию сигнальной пептидазы, которая связана с мембраной ЭПР, то белок высвобождается в полость ЭПР.
2.В синтезируемой ППЦ существует так называемая стоп-последовательность (STS – stop transport signal). STS состоит приблизительно из 20-25 аминокислот, преимущественно гидрофобных. Белок в области STS остается связанным в мембране, в результате С-конец обращен в цитоплазму, а N-конец и основная часть ППЦ – в люмен ЭПР. В результате, по окончании трансляции, образуется интегральный белок типа I.
3. 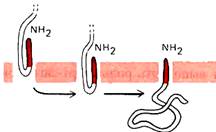 SS не обязательно должна отделиться от ППЦ. Само по себе присутствие сигнальной последовательности еще не достаточно для работы сигнальной пептидазы. SS не содержит участка для связывания с сигнальной пептидазой. В таких белках существует последовательность USP (uncleaved signal peptid; такая последовательность находится на N-конце белка. В результате такая SS закрепляется в мембране; при этом N-конец обращен в цитоплазму, а С-конец и основная часть ППЦ – в люмен ЭПР. В результате, по окончании трансляции, образуется интегральный белок типа II.
SS не обязательно должна отделиться от ППЦ. Само по себе присутствие сигнальной последовательности еще не достаточно для работы сигнальной пептидазы. SS не содержит участка для связывания с сигнальной пептидазой. В таких белках существует последовательность USP (uncleaved signal peptid; такая последовательность находится на N-конце белка. В результате такая SS закрепляется в мембране; при этом N-конец обращен в цитоплазму, а С-конец и основная часть ППЦ – в люмен ЭПР. В результате, по окончании трансляции, образуется интегральный белок типа II.
4. 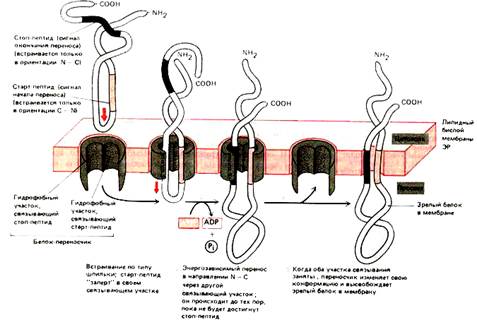 При образовании некоторых белков участвует как USP (то есть сигнальная последовательность не отрезается), так и STS. ППЦ имеет USP. По ходу роста ППЦ появляется STS. Белок выходит из канала, рибосома вынуждена сойти. В результате N- и С-концы направлены в цитоплазму, а основная часть цепи расположена в люмене ЭПР.
При образовании некоторых белков участвует как USP (то есть сигнальная последовательность не отрезается), так и STS. ППЦ имеет USP. По ходу роста ППЦ появляется STS. Белок выходит из канала, рибосома вынуждена сойти. В результате N- и С-концы направлены в цитоплазму, а основная часть цепи расположена в люмене ЭПР.
5. 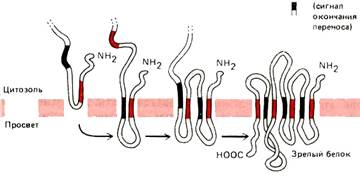 Образование политопных (то есть закрепленных в мембране несколько раз) белков. Процесс формирования ППЦ начинается как в п.4. Отличие состоит в том, что политопные белки имеют несколько STS. Сигнальная последовательность также не отрезается.
Образование политопных (то есть закрепленных в мембране несколько раз) белков. Процесс формирования ППЦ начинается как в п.4. Отличие состоит в том, что политопные белки имеют несколько STS. Сигнальная последовательность также не отрезается.
2.2. BiP/GRP78-белки.
Перенесенные в полость белки сворачиваются. В полости ЭПР содержится большое количество связывающего белка BiP (binding protein), который, по-видимому, узнает неправильно свернутые белки, связываясь с их наружными гидрофобными участками. В норме при сворачивании белок имеет гидрофобную сердцевину, но пока не произошло (или произошло неправильно) сворачивание белок обращает свои гидрофобные остатки наружу. BiP узнает неправильно свернутые белки, связываясь с их наружными гидрофобными участками. На карбоксильном конце молекулы BiP имеется сигнальный пептид из четырех аминокислот, благодаря которому белок остается в ЭПР. Существует гипотеза, согласно которой BiP способствует тому, что неправильно свернутые белки остаются в ЭПР (и, следовательно, не попадают в аппарат Гольджи). Возможно, также, что BiP является одним из катализаторов сворачивания белков. Показано, что этот белок связывает АТР и структурно родствен белкам теплового шока, которые участвуют в импорте белков.
2.3. Дисульфидизомераза.
В цитозоле содержится смесь восстанавливающих агентов, содержащих SH-группы; эти вещества предотвращают образование S-S-мостиков. В полости ЭПР таких восстанавливающих агентов мало, и поэтому S-S-мостики там образуются. При обилии белков этот процесс, по-видимому, идет неправильно. В полости ЭПР существует фермент, помогающий исправлять такие ошибки, - дисульфидизомераза. Этот фермент имеет тот же сигнал удержания в ЭПР, что и BiP. Механизм действия дисульфидизомеразы состоит в том, что разрезая S-S- связи, она дает белку возможность быстро поменять множество информаций, пока не будет достигнута конформация с наименьшей общей свободной энергией. На этом этапе вновь синтезированный белок сворачивается правильно. Правильная конформация может быть выбрана и случайно, но дисульфидизомераза значительно ускоряет процесс поиска.
2.4. Гликозилирование.
Большинство белков в ЭПР, прежде чем попасть в аппарат Гольджи и далее, становятся гликопротеинами, то есть к белкам присоединяются сахара.
N -гликозилирование. Почти тотчас после того, как ППЦ попала в просвет ЭПР, она гликозилируется. Сначала присоединяется всего лишь один олигосахарид, состоящий из 2 молекул N-ацтелгликозамина, 9 молекул маннозы и 3 молекул глюкозы. Этот олигосахарид всегда присоединяется к NH2-группе боковой цепи остатка аспарагина. Присоединение катализируется ферментом гликозилтрансферазой; этот фермент связан с мембраной ЭПР, и его активный центр обращен в полость ЭПР. Сигналами для N-гликозилирования служат 2 последовательности: Asn-X-Ser и Asn-X-Thr (где X- любая аминокислота, кроме пролина). Один такой олигосахарид удерживается в мембране ЭПР молекулой специального липида – долихола. Олигосахарид связан с долихолом высокоэнергетической фосфатной связью, обеспечивающей энергию активации для гликозилирования.
Все разнообразие N-связанных олигосахаридных структур возникает в результате модификаций молекулы исходного предшественника. Еще в ЭПР у большинства гликопротеинов отщепляется 3 остатка глюкозы и один остаток маннозы. Дальнейшая «доделка» олигосахарида продолжается в аппарате Гольджи.
Транспорт фосфолипидов из ЭПР в органеллы.
ПМ, мембрана АГ и мембрана лизосом - это части мембранной системы, связанной с ЭПР. Митохондрии и пероксисомы не принадлежат к этой системе и нуждаются в других механизмах для импорта белков и липидов мембран. Специальные водорастворимые белки - переносчики фосфолипидов обладают способностью переносить индивидуальные молекулы фосфолипидов от одной мембраны к другой. Предполагают, что таким образом переносится в митохондрии фосфатидилсерин, затем он декарбоксилируется, образуя фосфатидилэтаноламин; фосфатидилхолин, по всей вероятности, импортируется в виде интактной молекулы. Белки-переносчики распределяют фосфолипиды между органеллами случайным образом.
3. Гладкий ЭПР.
3.1. Цитохром р450.
На первой фазе биотрансформации (эффективный механизм инактивации и выведения чужеродных веществ; биотрансформация происходит главным образом в печени) менее реакционноспособные соединения подвергаются ферментативному гидроксилированию. Такая модификация делает возможной последующую конъюгацию с полярным веществом. Вообще гидроксилирующие ферменты являются монооксигеназами, включающими в качестве кофермента (это вспомогательные соединения, которые выполняют функцию промежуточных переносчиков атомов или функциональных групп) железосодержащий гем. Восстановленная форма гема связывает оксид углерода (СО) и приобретает характерное поглощение света при 450 нм. Поэтому такая группа ферментов носит название цитохромы Р450 (цитР450).
ЦитР450-зависимые монооксигеназы катализируют расщепление веществ разного типа с участием НАДФН и молекулярного кислорода (О2). При этом один атом кислорода присоединяется к субстрату, а второй освобождается в составе молекулы воды. В реакции принимает участие флавопротеин, выполняющий функцию переносчика восстановительного эквивалента с кофермента НАДФН + Н+ на собственно монооксигеназу, которая переносит электроны на молекулярный кислород.
В печени, а также в железах, продуцирующих стероидные гормоны, и в других органах встречаются разные формы фермента цитР450. Субстратная специфичность фермента печени невелика. Наиболее эффективно он катализирует окисление неполярных соединений с алифатическими или ароматическими кольцами. К ним относятся эндогенные субстраты организма, например стероидные гормоны, а также лекарственные вещества, инактивированные путем модификации. Превращение этилового спирта в печени также катализирует фермент цитР450 («микросомальная система окисления этанола»). Так как спирт и лекарственные вещества являются субстратами одной и той же ферментативной системы, их совместное воздействие на организм может быть опасным для жизни. Поэтому фермент цитР450 представляет особый интерес для фармакологии.
Из множества цитР450-зависимых реакций здесь приводится только несколько примеров. Гидроксилирование ароматического кольца играет центральную роль в метаболических превращениях медицинских препаратов и стероидов. При этом ангулярные метильные группы могут окисляться до гидроксиметильных. Эпоксидирование приводит к высокореакционноспособным и часто токсичным продуктам. Примером является биотрансформация бензпирена в эпоксид, обладающий мутагенным действием. ЦитР450-зависимая реакция дезаминирования приводит к отщеплению алкильных заместителей при гетероатомах (О, N или S) в виде альдегидов.
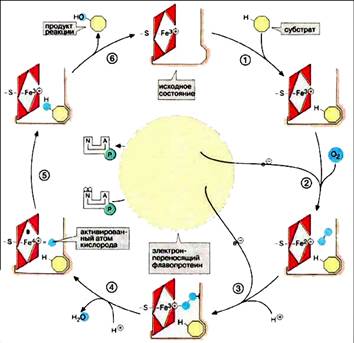 Ход каталитической реакции с участием цитР450 в принципе известен. Решающая роль группы гема состоит в том, что она переводит атомарный кислород в реакционно-способную форму, которая собственно и ответственна за все описанные выше реакции. В исходной стадии атом железа трехвалентен. Цитохром связывает субстрат рядом с группой гема (1). Это делает возможным восстановление трехвалентного железа до двухвалентной формы и последующее присоединение молекулы О2 (2). Далее следует перенос электронов (3) и окисление атома железа, который восстанавливает связанный кислород в пероксид. От промежуточного продукта отщепляется ион гидроксила (4) с образованием молекулы воды и реакционноспособной формы кислорода. В этом радикале железо формально четырехвалентно. Активированный атом кислорода атакует связь С-Н субстрата с образованием гидроксигруппы (5). После освобождения продукта реакции (6) фермент возвращается в исходное состояние.
Ход каталитической реакции с участием цитР450 в принципе известен. Решающая роль группы гема состоит в том, что она переводит атомарный кислород в реакционно-способную форму, которая собственно и ответственна за все описанные выше реакции. В исходной стадии атом железа трехвалентен. Цитохром связывает субстрат рядом с группой гема (1). Это делает возможным восстановление трехвалентного железа до двухвалентной формы и последующее присоединение молекулы О2 (2). Далее следует перенос электронов (3) и окисление атома железа, который восстанавливает связанный кислород в пероксид. От промежуточного продукта отщепляется ион гидроксила (4) с образованием молекулы воды и реакционноспособной формы кислорода. В этом радикале железо формально четырехвалентно. Активированный атом кислорода атакует связь С-Н субстрата с образованием гидроксигруппы (5). После освобождения продукта реакции (6) фермент возвращается в исходное состояние.
Биосинтез холестерина.
Биосинтез холестерина, кап и всех изопреноидов, начинается с ацетил-КоА. Углеродный скелет С27-стерина строится из С2-звеньев в длинной и сложной последовательности реакций. Биосинтез холестерина можно разделить на четыре этапа. На первом этапе из трех молекул ацетил-КоА образуется мевалонат (С6). На втором этапе мевалонат превращается в «активный изопрен», изопентенилдифосфат. На третьем этапе шесть молекул изопрена полимеризуются с образованием сквалена (С30). Наконец, сквален циклизуется с отщеплением трех атомов углерода и превращается в холестерин. На схеме представлены только наиболее важные промежуточные продукты биосинтеза.
1. Образование мевалоната. Превращение ацетил-КоА в ацетоацетил-КоА и затем в З-гидрокси-З-метилглутарил-КоА (3-ГМГ-КоА) соответствует пути биосинтеза кетоновых тел, однако этот процесс происходит не в митохондриях, а в эндоплазматическом ретикулуме (ЭР). 3-ГМГ-КоА восстанавливается с отщеплением кофермента А с участием 3-ГМГ-КоА-редуктазы, ключевого фермента биосинтеза холестерину (см. ниже). На этом важном этапе путем репрессии биосинтеза фермента (эффекторы: гидроксистерины), а также за счет взаимопревращения молекулы фермента (эффекторы: гормоны) осуществляется регуляция биосинтеза холестерина. Например, фосфорилированная редуктаза представляет собой неактивную форму фермента; инсулин и тироксин стимулируют фермент, глюкагон тормозит; холестерин, поступающий с пищей, также подавляет 3-ГМГ-КоА-редуктазу.
2. Образование изопентенилдифосфата. Мевалонат за счет декарбоксилирования с потреблением АТФ превращается в изопентенилдифосфат, который и является тем структурным элементом, из которого строятся все изопреноиды.
3. Образование сквалена. Изопентенилдифосфат подвергается изомеризации с образованием диметилаллилдифосфата. Обе С5-молекулы конденсируются в геранилдифосфат и в результате присоединения следующей молекулы изопентенилдифосфата образуют фарнезилдифосфат. При димеризации последнего по типу «голова к голове» образуется сквален. Фарнезилдифосфат является также исходным соединением для синтеза других полиизопреноидов, таких, как долихол и убихинон.
4. Образование холестерина. Сквален, линейный изопреноид, циклизуется с потреблением кислорода в ланостерин, С30-стерин, от которого на последующих стадиях, катализируемых цитохромом Р450, отщепляются три метильные группы, вследствие чего образуется конечный продукт — холестерин.
Описанный путь биосинтеза локализован в гладком ЭР. Синтез идет за счет энергии, освобождающейся при расщеплении производных кофермента А и энергетически богатых фосфатов. Восстановителем при образовании мевалоната и сквалена, а также на последних стадиях биосинтеза холестерина является НАДФН + Η+. Для этого пути характерно то, что промежуточные метаболиты можно подразделить на три группы: производные кофермента А, дифосфаты и высоко липофильные соединения (от сквалена до холестерина), связанные с переносчиками стеринов.
Дата добавления: 2018-09-22; просмотров: 425; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
