Белки: биологическая роль, принципы классификации. Привести конкретные примеры.
Оглавление
1.Аминокислоты: строение, принципы классификации (по положению аминогруппы, по химическому строению углеводородного радикала, количеству функциональных групп, этиологическая классификация). Привести конкретные примеры. 8
2.Кислотно-основные свойства аминокислот и белков. Изоэлектрическая точка белков. Белки как коллоидные системы: молекулярно-кинетические и оптические свойства. Принципы методов выделения и очистки белков: высаливание, хроматография, электрофорез, гельфильтрация, диализ. 10
3.Белки: биологическая роль, принципы классификации. Привести конкретные примеры. 12
5. Характеристика и особенности простых белков, их функции, примеры: гистоны, протамины, аутеллины, проламины, альбумины, глобулины. 12
коллаген, эластин, кератины. 12
6. Характеристика сложных белков: строение, представители, функции. Хромопротеиды, металлопротеиды, нуклеопротеиды, гликопротеиды, липопротеиды. Привести конкретные примеры. 12
4. Структурная организация белков: характеристики первичной, вторичной, третичной и четвертичной структур. 15
7. Витамины. Классификация. Понятие о гипо-, гипер-, авитаминозах как заболеваниях связанных с нарушением функции ферментативных систем. Причины гипо- и авитаминозов. 17
8. Провитамины (примеры). Антивитамины (примеры). Биологические эффекты и механизмы действия. 20
9. Витамин А: химическое и терапевтическое названия, особенности строения молекулы,природные источники, провитамины. Биологическая роль. Активная(-ые) форма(-ы) витамина: особенности строения, биологическая роль. Роль витамина в процессе светоощущения. Признаки гипер-, гипо- и авитаминоза А. 21
|
|
|
10. Витамин D: химическое и терапевтическое названия, особенности строения молекулы, природные источники, провитамины. Активная(-ые) форма(-ы) витамина: особенности строения, биологическая роль. Признаки гипо-, гипер- и авитаминоза витамина D. 23
11. Витамин К: химическое и терапевтическое названия, особенности строения молекулы, природные источники, биологическая роль, образуемые кофермент(-ы), применяемые в медицине и ветеринарии. Биологическое значение ферментативных реакций с участием этого (этих) коферментов (с примерами). Антивитамины витамина К и признаки гиповитаминоза. 25
12.Витамин Е: химическое и терапевтическое названия, особенности строения молекулы, природные источники, биологическая роль. Признак гиповитаминоза. 27
13. Витамин F: химическое и терапевтическое названия, строение (знать формулы), биологическая роль, природные источники. Написать схему синтеза арахидоновой кислоты в организме животных. Признаки гиповитаминоза витамина F. 28
|
|
|
14. Витамин  : химическое и терапевтическое названия, особенности строения молекулы, природные источники, биологическая роль. Кофермент (-ы) витамина: особенности строения, участие в метаболических реакциях организма (привести минимум 3 примера). Признаки гиповитаминоза витамина
: химическое и терапевтическое названия, особенности строения молекулы, природные источники, биологическая роль. Кофермент (-ы) витамина: особенности строения, участие в метаболических реакциях организма (привести минимум 3 примера). Признаки гиповитаминоза витамина  . 29
. 29
15. Витамин  : химическое и терапевтическое названия, особенности химического строения и свойства, природные источники, биологическая роль. Кофермент (-ы) витамина
: химическое и терапевтическое названия, особенности химического строения и свойства, природные источники, биологическая роль. Кофермент (-ы) витамина  : особенности строения, участие в метаболических реакциях организма (привести минимум 3 примера). Признаки гиповитаминоза витамина
: особенности строения, участие в метаболических реакциях организма (привести минимум 3 примера). Признаки гиповитаминоза витамина  . 30
. 30
16 Витамин РР (  ): химическое и терапевтическое название, особенности строения молекулы, природные источники, биологическая роль. Кофермент (-ы) витамина: особенности строения, участие в метаболических реакциях организма (привести минимум 3 примера). Признаки гиповитаминоза витамина
): химическое и терапевтическое название, особенности строения молекулы, природные источники, биологическая роль. Кофермент (-ы) витамина: особенности строения, участие в метаболических реакциях организма (привести минимум 3 примера). Признаки гиповитаминоза витамина  . 32
. 32
17. Витамин  (пантотеновая кислота): терапевтическое название, особенности строения молекулы, природные источники, биологическая роль. Коферментая (-ые) форма (-ы) витамина: особенности строения, участие в метаболических реакциях организма (привести минимум 3 примера). Признаки гиповитаминоза витамина
(пантотеновая кислота): терапевтическое название, особенности строения молекулы, природные источники, биологическая роль. Коферментая (-ые) форма (-ы) витамина: особенности строения, участие в метаболических реакциях организма (привести минимум 3 примера). Признаки гиповитаминоза витамина  . 34
. 34
|
|
|
18. Витамин  : химическое и терапевтическое названия, особенности строения молекулы, природные источники, биологическая роль. Кофермент (-ы) витамина: особенности строения, участие в метаболических реакциях организма (привести минимум 3 примера). Признаки гиповитаминоза витамина
: химическое и терапевтическое названия, особенности строения молекулы, природные источники, биологическая роль. Кофермент (-ы) витамина: особенности строения, участие в метаболических реакциях организма (привести минимум 3 примера). Признаки гиповитаминоза витамина  . Антивитамины. 35
. Антивитамины. 35
19. Витамин  : химическое и терапевтическое названия, особенности строения молекулы, природные источники, биологическая роль. Кофермент (-ы) витамина: особенности строения, участие в метаболических реакциях в организме (примеры). Признаки гиповитаминоза витамина
: химическое и терапевтическое названия, особенности строения молекулы, природные источники, биологическая роль. Кофермент (-ы) витамина: особенности строения, участие в метаболических реакциях в организме (примеры). Признаки гиповитаминоза витамина  . 36
. 36
20.Витамин  : химическое и терапевтическое названия, особенности строения молекулы, природные источники, биологическая роль. Кофермент (-ы) витамина: особенности строения, участие в метаболических реакция организма (примеры). Признаки гиповитаминоза витамина
: химическое и терапевтическое названия, особенности строения молекулы, природные источники, биологическая роль. Кофермент (-ы) витамина: особенности строения, участие в метаболических реакция организма (примеры). Признаки гиповитаминоза витамина  . 38
. 38
21. Витамин Н: химическое и терапевтическое названия, особенности строения молекул, природные источники, биологическая роль. Кофермент (-ы) витамина: особенности строения, участие в метаболических реакциях организма (привести минимум 3 примера). Признаки гиповитаминоза витамина Н. 40
22. Витамин С: химическое и терапевтическое названия, строение (уметь писать формулы) и свойства, природные источники, биологическая роль. Признаки авитаминоза. 41
|
|
|
23. Витамин Р: химическое и терапевтическое названия, особенности строения, природные источники, биологическая роль. Признаки авитаминоза. 43
24. Убихинон: буквенное обозначение, особенности строения молекулы, природные источники, биологическая роль. Кофермент (-ы): особенности строения, этапы синтеза в организме, предшественник (знать формулу), биологическая роль (примеры). Признаки недостаточности. 44
25.Липоевая кислота: буквенное обозначение, особенности строения молекулы, природные источники, биологическая роль. Участие в метаболических реакциях в организме (примеры). 44
26.Холин: буквенное обозначение, строение молекулы (уметь писать формулу), природные источники. Участие в метаболических реакциях в организме (примеры). Лецитин: химическое строение (уметь писать формулы), биологическая роль. 45
27. Инозитол: буквенное обозначение, строение молекулы (уметь писать формулу), природные источники. ФИ: химическое строение (уметь писать формулы) и биологическая роль в организме. 46
28. Парааминобензойная кислота: буквенное обозначение, строение молекулы, природные источники, биологическая роль. Сульфанилфмидные препараты. 47
29.Ферменты: строение, активный и аллостерический центры. Холофермент, апофермент, кофермент. Привести примеры. Особенности ферментативного катализа. 49
33.Понятие о кофакторах, коферментах и простетических группах. Связь коферментов с витаминами. Привести конкретные примеры метаболических реакций с участием коферментов и простеических групп. 49
30.Ферменты. Механизм действия ферментов. Особенности в сравнении с неорганическими катализаторами. Единицы измерения активности ферментов. 51
31. Общие свойства ферментов (термостабильность, влияние рН, специфичность действия). Привести примеры. 53
32. Современнавя классификация ферментов, характеристика каждого класса ферментов (конкретные примеры метаболических реакций). Шифр ферментов. 54
34.Проферменты: биологическая роль, образование активных ферментов (привести конкретные примеры). Изоферметы (привести конкретные примеры). Энзимодиагностика и энзимотерапия. 55
35.Способы внутриклеточной регуляции действия ферментов. Активация и ингибирование, индукция и репрессия ферментов. Привести конкретные примеры регуляции ферментативной активности, осуществляемой в организме. 57
36. Общая характеристика класса оксидоредуктаз. Коферменты и простеические группы оксидоредуктаз. Привести конкретные примеры метаболических реакций с участием дегидрогеназ и оксидаз. 62
37.Общая характеристика класса трансфераз. Коферметны трансфераз. Привести конкретные примеры метаболических реакций с участием трансфераз. Диагностическое значение определения аминотрансфераз в сыворотке крови. 64
38. Общая характеристика класса гидролаз (эстеразы, протеиназы, глюзидазы, аминазы, амидазы). Привести конкретные примеры метаболических реакций с участием гидролаз. Указать применение гидролаз в ветеринарной и медицинской практике. 66
39. Общая характеристика класса лиаз. Коферменты лиаз. Привести конкретные примеры метаболических реакций с участием лиаз (минимум 3). 67
40. Общая характеритика класса изомераз. Привести кокретные примеры метаболических реакций с участием изомераз (минимум 3). 69
41. Общая характеристика класса лигаз. Коферменты лигаз. Привести конкретные примеры метаболических реакций с участием лигаз (минимум 3). 70
42. Эндокринная система: локальная, диффузная. Привести конкретные примеры. Характеристика и принципы классификации гормонов. 72
43. Регуляция уровня гормонов в организме: характеристика, классификация. Особенности регуляции, осуществляемой под контролем ЦНС. Привести примеры. 73
44.Контроль эндокринной активности: виды, биологическая роль. Изменения биологической активности секретируемых в кровь гормонов. (в начале). 73
45. Типы механизмов действия гормонов. Каскадный механизм усиления и подавления сигнала в аденилатциклазной системе. 75
46. Типы механизма действия гормонов. Каскадный механизм усиления сигнала в инозитолфосфатной системе. Роль 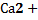 . 78
. 78
47.Типы механизмов действия гормонов. Распространение гормонального сигнала с участием каталитических рецепторов. Примеры гормонов. 80
49. Гормоны гипофиза. Классификация, химическая природа. Биологическая роль в организме. Особенности биосинтеза и биологическая роль йодтиронинов. 81
50. Пратгормон, кальцитонин и кальцитриол. Химическая природа гормонов, место синтеза в организме. Роль в регуляции кальций-фосфорного обмена. 84
48.Роль гормонов в регуляции обмена веществ. Привести конкретные примеры метаболических реакций, скорость протекания которых контролируется гормонами. 86
51. Инсулин. Химическая природа, место синтеза в организме,механизм действия гормона. Роль в регуляции углеводного и липидного обменов. Привести конкретные примеры влияния на регуляторные ферменты. 86
52. Глюкагон. Химическая природа, место синтеза в организме, механизм действия гормона. Роль в регуляции углеводного и липидного обменов. Привести конкретные примеры влияния на регуляторные ферменты. 88
53. Адреналин. Химическая природа, место синтеза в организме, механизм действия гормона. Биологическая роль. Роль в регуляции углеводного и липидного обменов. Привести конкретные примеры влияния на регуляторные ферменты. 88
54. Кортизол. Химическая природа, место синтеза в организме, механизм действия гормона. Биологическая роль в организме. Привести конкретные примеры влияния на регуляторные ферменты. 90
55. Альдостерон. Химическая природа, место синтеза в организме, механизм действия гормона. Биологическая роль в организме. Функционирование ренин-ангиотензиновой системы. 92
56. Понятие метаболизма. Метаболические пути: катаболические, анаболические, амфиболические. Основные положения. Экзергонические и энедергонические реакции. 94
57. Макроэрги. Биологическая роль. Строение АТФ (знать формулу) и центральная роль АТФ в метаболических процессах. Привести конкретные примеры метаболических реакций с участием АТФ. 94
58. Субстратное фосфорилирование: определение, биологическая роль в организме. Привести конкретные примеры реакций субстратного фосфорилирования в метаболических процессах в организма. 95
59. Понятие биологическое окисление и тканевое дыхание. Биологическая взаимосвязь, различие и метаболическая роль данных процессов в организме. Строение и биологическая роль ЦПЭ. 96
60. Хемиосмотическая гипотеза Митчелла. Окислительное фосфорилирование. Строение и принцип функционирования АТФ-синтазы. Энергетический баланс. 96
61.Хемиосмотическая гипотеза Митчелла (предыдущий). Дыхательный контроль. Коэффициент Р/О. Разобщители и ингибиторы ЦПЭ: влияние на работу ЦПЭ и энергетический баланс клетки (предыдущий). 99
62. ЦТК: реакции (знать), органная и внутриклеточная локализация процесса, биологическая роль в организме, регуляция. Связь с ЦПЭ. Энергетический баланс. 101
63.ОДП: суммарная реакция, ферменты и коферменты, участвующие в ОДП, органная и внутриклеточная локализация процесса, биологическая роль в организме, регуляция. Связь с ЦПЭ. Энергетический баланс. 104
64. Переваривание, всасывание и транспорт углеводов в организме. Биологическая роль инсулина. Значение внутриклеточного фосфорилирования глюкозы. Написать реакцию. 106
65. Анаэробное окисление глюкозы (знать реакции). Молочное и спиртовое брожение. 108
66.Анаэробное окисление глюкозы (знать реакции): органная и внутриклеточная локализация процесса, биологическая роль в организме. Энергетический баланс процесса. (все есть в предыдущих двух). 111
67.Синтез гликогена: органная и внутриклеточная локализация процесса, биологическая роль в организме, регуляция. 112
68. Распад гликогена: органная и внутриклеточная локализации процесса, биологическая роль в организме, регуляция. 114
69. Аэробный гликолиз (знать реакции): органная и внутриклеточная локализация процесса, биологическая роль в организме, регуляция. Энергетический баланс процесса. 115
70. Полное окисление глюкозы: огранная и внутриклеточная локализация процесса, биологическая роль в организме, регуляция. Энергетический баланс процесса. (тоже самое, что сверху+ ЦТК и дыхательная цепь). 117
71. Глюконеогенез (знать реакции): органная и внутриклеточная локализация процесса, биологическая роль в организме, регуляция. 117
72.«Субстравтные циклы» (знать реакции – реакции в предыдущем). Биологическая роль в организме. Регуляция, роль инсулина и глюкагона. 122
73. Пентозофосфатный путь расщепления глюкозы: органная и внутриклеточная локализация процесса, биологическая роль в организме, связь с гликолизом. 122
74. Переваривание, всасывание и транспорт липидов в организме: перечислить и охарактеризовать все этапы. Указать роль желчных кислот и ЛП. 124
75. Желчные кислоты: классификация, строение (знать формулы), место синтеза, предшественник (знать формулу), биологическая роль. 127
76. Особенности транспорта липидных компонентов в организме. Классификация и роль ЛП. Понятие «хилезность сыворотки»: возможные причины в норме и при патологии. 130
77. Гидролиз ТАГ в организме (уметь писать реакции): органная и внутриклеточная локализация процесса, биологическая роль в организме, регуляция. 131
78. Полное окисление глицерола (уметь писать реакции): органная и внутриклеточная локализация процесса, биологическая роль в организме. Энергетический баланс. 133
79.Биосинтез триацилглицеролов в организме (уметь писать реакции): органная и внутриклеточная локализация процесса, биологическая роль в организме. 134
80.β-окисление насыщенных жирных кислот (уметь писать реакции): органная и внутриклеточная локализация процесса, биологическая роль в организме. Связь с ЦПЭ. Энергетический баланс процесса. 134
81.β-окисление Ненасыщенных жирных кислот (уметь писать реакции): органная и внутриклеточная локализация процесса, биологическая роль в организме. Связь с ЦПЭ. Энергетический баланс процесса. 137
82. Биосинтез жирных кислот (уметь писать реакции): органная и внутриклеточная локализация процесса, коферменты, биологическая роль в организме. 138
83.Метаболизм кетоновых тел (уметь писать реакции): органная и внутриклеточная локализация процесса, биологическая роль в организме. Кетозы. 140
84. Биологическая роль холестерола в организме (знать формулу). Этапы синтеза холестерола (уметь писать реакции до обрзования мевалоновой кислоты) и транспорт холестерола в организме. 142
85.Биологическая роль ФЛ в организме (уметь писать формулы). Этапы биосинтеза ФЛ. 143
86. Полноценность белкового питания. Переваривание и всасывание белков. Проферменты. Пути активации протеиназ: биологическое значение. 145
87. Внутриклеточные превращения аминокислот. Трансаминирование аминокислот (уметь писать реакции): биологическая роль. Клиническое значение, определение активности трансаминаз. 148
88.Внутриклеточное превращение аминокислот. Дезаминирование аминокислот: биологическая роль, классификация. Прямое и непрямое окислительное дезаминирование (уметь писать реакции). 149
89.Распад гемоглобина. Распад нуклеиновых кислот в ЖКТ. Строение пуриновых и пиримидиновых нуклеотидов (знать формулы – есть дальше). Биологическая роль. 150
90.Взаимосвязь обменных процессов. Особенности регуляции метаболических путей. Привести конкретные примеры. 152
91.Биохимия крови. Основные биохимические компоненты, их роль. 154
92.Биохимия мочи, молока (Молока здесь нет, но там все ясно). Основные биохимические компоненты, их роль. 156
93.Внутриклеточные превращения аминокислот. Декарбоксилирования аминокислот: значение процесса. Роль биогенных аминов и их инактивации. 158
94.Общее и «местное» обезвреживание аммиака: биологическая роль, органная и внутриклеточная локализация. Орнитиновый цикл (уметь писать реакции): биологическая роль процесса. 159
95.Биосинтез гемоглобина. Виды гемоглобина. Биологическая роль. 161
96.Строение пиримидиновых нуклеотидов (знать формулы). Распад пиримидиновых нукеотидов. 163
97.Строение пуриновых нуклеотидов (знать формулы). Распад пуриновых нуклеотидов. 166
98.Синтез пуриновых и пиримидиновых азотистых оснований. Роль витамина  . 166
. 166
Вопросы к экзамену по дисциплине «Биологическая химия»
Аминокислоты: строение, принципы классификации (по положению аминогруппы, по химическому строению углеводородного радикала, количеству функциональных групп, этиологическая классификация). Привести конкретные примеры.
Все встречающиеся в природе аминокислоты обладают общим свойством – амфотерностью (от греч. amphoteros – двусторонний), т.е. каждая аминокислота содержит как минимум одну кислотную и одну основную группы. Общий тип строения α-аминокислот может быть представлен в следующем виде:

Как видно из общей формулы, аминокислоты будут отличаться друг от друга химической природой радикала R, представляющего группу атомов в молекуле аминокислоты, связанную с α-углеродным атомом и не участвующую в образовании пептидной связи при синтезе белка. Почти все α-амино- и α-карбоксильные группы участвуют в образовании пептидных связей белковой молекулы, теряя при этом свои специфические для свободных аминокислот кислотно-основные свойства. Поэтому все разнообразие особенностей структуры и функции белковых молекул связано с химической природой и физико-химическими свойствами радикаловаминокислот. Именно благодаря им белки наделены рядом уникальных функций, не свойственных другим биополимерам, и обладают химической индивидуальностью.
Классификация аминокислот разработана на основе химического строения радикалов, хотя были предложены и другие принципы. Различают ароматические и алифатические аминокислоты, а также аминокислоты, содержащие серу или гидроксильные группы. Часто классификация основана на природе заряда аминокислоты. Если радикал нейтральный (такие аминокислоты содержат только одну амино- и однукарбоксильную группы), то они называются нейтральными аминокислотами. Если аминокислота содержит избыток амино- или карбоксильных групп, то она называется соответственно основной или кислой аминокислотой.
Современная рациональная классификация аминокислот основана на полярности радикалов (R-групп), т.е. способности их к взаимодействию с водой при физиологических значениях рН (близких к рН 7,0). Различают 5 классов аминокислот, содержащих следующие радикалы: 1) неполярные (гидрофобные); 2) полярные (гидрофильные); 3) ароматические (большей частью неполярные); 4) отрицательно заряженные и 5) положительно заряженные. В представленной классификации аминокислот (табл. 1.3) приведены наименования, сокращенные английские и русские обозначения и однобуквенные символы аминокислот, принятые в отечественной и иностранной литературе, а также значения изоэлектрической точки (рI) и молекулярной массы (М). Отдельно даются структурные формулы всех 20 аминокислот белковой молекулы.

Полярные, незаряженные R-группы

Отрицательно заряженные R-группы

Положительно заряженные R-группы

Ароматические R-группы

Перечисленные аминокислоты присутствуют в разных количественных соотношениях и последовательностях в тысячах белков, хотя отдельные индивидуальные белки не содержат полного набора всех этих аминокислот. Помимо наличия в большинстве природных белков 20 аминокислот, в некоторых белках обнаружены производные аминокислот : оксипролин, оксилизин, дийодтирозин, фосфосерин и фосфотреонин (последние две аминокислоты представлены в главе 2):

Первые две аминокислоты содержатся в белке соединительной ткани – коллагене, а дийодтирозин является основой структуры гормонов щитовидной железы. В мышечном белке миозине обнаружен также ε-N-метиллизин; в состав протромбина (белок свертывания крови) входит γ-карбоксиглутаминовая кислота, а в глутатионпероксидазе открыт селеноцистеин, в котором ОН-группа серина заменена на селен (Se):

Помимо указанных, ряд α-аминокислот выполняет важные функции в обмене веществ, хотя и не входит в состав белков, в частности орнитин, цитруллин, гомосерин, гомоцистеин, цистеинсульфиновая кислота, диоксифенилаланин и др.
Кислотно-основные свойства аминокислот и белков. Изоэлектрическая точка белков. Белки как коллоидные системы: молекулярно-кинетические и оптические свойства. Принципы методов выделения и очистки белков: высаливание, хроматография, электрофорез, гельфильтрация, диализ.
Белки, как и аминокислоты, амфотерны благодаря наличию свободных NH2- и СООН-групп. Для них характерны все свойства кислот и оснований. В зависимости от реакции среды и соотношения кислых и основных аминокислот белки в растворе несут или отрицательный, или положительный заряд, перемещаясь к аноду (+) или катоду (-). Это свойство используется при очистке белков методом электрофореза.
Изоэлектрическая точка (pI) — кислотность среды (pH), при которой определённая молекула или поверхность не несёт электрического заряда. Многие биологические молекулы, такие как аминокислоты и белки, являются по своей природе амфотерными, так как содержат и кислотные, и осно́вные функциональные группы. Общий заряд белка определяется боковыми группами аминокислот, которые могут быть положительно- или отрицательно-заряженными, нейтральными или полярными. Общий заряд белка при pH ниже изоэлектрической точки является положительным. Наоборот, при pH выше изоэлектрической точки общий заряд белка — отрицательный. В самой изоэлектрической точке сумма положительных зарядов на белковой молекуле равна сумме отрицательных зарядов, поэтому будучи помещена в электрическое поле такая молекула не двигается.
Как коллоидные системы
Наиболее характерными физико-химическими свойствами белков являются высокая вязкость растворов, незначительная диффузия, способность к набуханию в больших пределах, оптическая активность, подвижность в электрическом поле, низкое осмотическое давление и высокое онкотическое давление, способность к поглощению УФ-лучей при 280 нм (это свойство, обусловленное наличием в белкахароматических аминокислот, используется для количественного определения белков). Белки обладают явно выраженными гидрофильными свойствами. С коллоидным состоянием белков связан ряд характерных свойств, в частности явление светорассеяния, лежащее в основе количественного определения белков методом нефелометрии. Этот эффект используется, кроме того, в современных методах микроскопии биологических объектов.
методы выделения белков
A. Высаливание
Растворимость белков сильно зависит от концентрации солей (от ионной силы). В дистиллированной воде белки чаще всего растворяются плохо, однако их растворимость возрастает по мере увеличения ионной силы. При этом все большее количество гидратированных неорганических ионов (светло-синие кружочки) связывается с поверхностью белка и тем самым уменьшается степень его агрегации (засаливание). При высокой ионной силе молекулы белков лишаются гидратирующих оболочек, что приводит к агрегации и выпадению белка в осадок (высаливание). Используя различие в растворимости, можно с помощью обычных солей, например (NН4)2SО4, разделить (фракционировать) смесь белков.
Б. Диализ
Для отделения низкомолекулярных примесей или замены состава среды используют диализ. Метод основан на том, что молекулы белка из-за своих размеров не могут проходить через полупроницаемые мембраны (пергамент), в то время как низкомолекулярные вещества равномерно распределяются между объемом, ограниченным мембраной, и окружающим раствором. После многократной замены внешнего раствора состав среды в диализном мешочке (концентрация солей, величина pH и др.) будет тот же, что и в окружающем растворе.
B. Гель-фильтрация
Гель-проникающая хроматография (гель-фильтрация) позволяет разделять белки по величине и форме молекул. Разделение проводят в хроматографических колонках, заполненных сферическими частицами набухшего геля (размером 10-500 мкм) из полимерных материалов (1а). Частицы геля проницаемы благодаря внутренним каналам, которые характеризуются определенным средним диаметром. Смесь белков (1б) вносят в колонку с гелем и элюируют буферным раствором. Белковые молекулы, не способные проникать в гранулы геля (помечены красным цветом), будут перемещаться с высокой скоростью. Средние (зеленого цвета) и небольшие белки (синего цвета) будут в той или иной степени удерживаться гранулами геля (1в). На выходе колонки элюат собирают в виде отдельных фракций (2). Объем выхода того или иного белка зависит в основном от его молекулярной массы (3).
Г. Электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия
В настоящее время электрофорез в полиакриламидном геле (ПААГ) в присутствии додецилсульфата натрия (ДСН) [ДСН-ПААГ-электрофорез (SDS-PAGE)] является общепринятым методом определения гомогенности белковых препаратов. Метод основан на свойстве заряженных частиц (молекул) перемещаться под действием электрического поля. Обычно скорость миграции зависит от трех параметров анализируемых белков: величины молекул, формы молекул и суммарного заряда. Поэтому предварительно белки денатурируют с тем, чтобы скорость миграции зависела только от молекулярной массы. Для этого анализируемую смесь обрабатывают додецилсульфатом натрия [ДСН (SDS)] (C12H25OSO3Na), который представляет собой детергент с сильно выраженными амфифильными свойствами . Под действием ДСН олигомерные белки диссоциируют на субъединицы и денатурируют. Развернутые полипептидные цепи связывают ДСН (примерно 0,4 г/г белка) и приобретают отрицательный заряд. Для полной денатурации в среду добавляют тиолы, которые расщепляют дисульфидные мостики. Электрофорез проводят в тонком слое полиакриламида . После завершения электрофореза, зоны белков выявляют c помощью красителя, и контрольного препарата с известной мол. массой.
Белки: биологическая роль, принципы классификации. Привести конкретные примеры.
Дата добавления: 2018-08-06; просмотров: 787; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
