Общая характеристика и химические свойства германия, олова и свинца.
Оксиды и гидроксиды олова и свинца: их взаимодействие с кислотами и щелочами, окислительно-восстановительные свойства.
Сульфиды олова и свинца: получение, кислотно-основные и окислительно-восстановительные свойства. Отношение к действию (NH4)2S и (NH4)2S2.
Германий является рассеянным элементом,его содержание в земной коре составляет 7,0х10^-4 мас.% . Металлический Ge получают восстановлением GeO2 водородом,углём ли магнием:
GeO2 + 2H2= Ge + 2H2O (при 800 градусах Цельсия)
GeO2 + 2C= Ge + 2CO ( при 1100 градусах Цельсия)
Олово и свинец- редкие металлы, их содержание в земной коре 8,0х10^-3 и 1,6х10^-3 мас.% соответственно. В природе очень редко встречаются в свободном состоянии и в основном присутствуют в полиметаллических рудах в виде минералов: касситерита SnO2, станина SnS2xCu2SxFeS, свинцового блеска PbS, церрусита PbCO3 и др. Т.к. содержание металлов в рудах очень низкое (около 1%), то их обогащают или подвергают окислительному обжигу. Концетрат олова, содержащий SnO2, сплавляют с Na2O2 и получают станнат натрия, который действием кислот переводят в оловянную кислоту. После прокаливания оловянной кислоты получившийся диоксид олова восстанавливают углём:
SnO2 + 2C= Sn + 2CO
Чёрное олово очищают электрохимическим рафинированием в дифосфатных р-рах.
Прокаливание концентратов свинца ведут в присутствии диоксида кремния:
2PbS + 3O2= 2PbO + 2SO2;
PbS + 2O2= PbSO4;
2PbSO4 + 2SiO2= 2PbSiO3 + 2SO2+ O2.
Огарок, содержащий PbO и PbSiO3, смешивают с CaO и коксом и нагревают до 1400 градусов C, при этом образуется чёрный свинец:
|
|
|
PbO+C=Pb + CO
PbSiO3+ CaO+ CO= Pb +CaSiO3 + CO2.
Чёрный свинец подвергают электролитическому рафинированию в р-ре H2[SiF6].
Все металлы IVA-подгруппы- белые, блестящие в-ва(кроме альфа-Sn) с плотностью выше 5 г/см^3. Олово и свинец- мягкие, низкоплавкие и хорошо проводящие электрический ток металлы.
Германий, имея кристаллическую решётку как у алмаза, обладает необычайно высокой для металлов твёрдостью(6,3 по шкале Мооса), высокой температурой плавления(958 градусов С) и проявляет полупроводниковые св-а.
Олово существует в виде 3 аллотропных модификаций – серого олова(альфа-Sn), белого олова(бета-Sn) и гамма-Sn. Белое олово устойчиво при температурах выше 13,2 гр.С, имеет тетрагональную структуру, невысокую твёрдость и высокую пластичность. Серое олово- серы порошок без металлического блеска устойчивый при температурах нже 13,2 гр.С. Эта модификация имеет кристаллическую структуру подобную алмазу и является полупроводником, как кремний германий. Серое олово переходит в белое только при переплавке металла и, наоборот, при низких температурах белое олово превращается в серое( процесс называется «оловянной чумой»). При температуре выше 161 гр.С из белого олва образуется гамма-Sn. Эта модификация внешне похожа на белое олово,, но отличается кристаллической структурой,а, следовательно, и механическими свойствами(менее пластичная и более хрупкая).
|
|
|
Свинец имеет голубовато-серый цвет и блестит, однако на воздухе быстро тускнеет. Это самый мягкий среди тяжёлых металлов- он оставляет след на бумаге и режется ножом. Теплопроводность и электро проводность свинца невелики. При 7,5 К он становится сверхпроводником. Металический свинец хорошо поглощает альфа-,бета- и жёсткое электромагнитное излучение.
При комнатной температуре все 3 металла устойчивы к кислороду(свинец покрывается тонкой оксидной плёнкой и теряет блеск). При нагревании они окисляются кислородом (образуя GeO2, SnO2 и PbO), галогенами (GeHal4, SnHal4, PbHal2) и серой (GeS или GeS2, SnS или SnS2, PbS). Водород, углерод и азот на германий,олово и свинец не действуют.
Стандартные окислительно –восстановительные потенциалы переходов Э^2+ 2е+Э^0 у олово и свинца немного отрицательнее потенциала водорода, а у германия- больше потенциала водорода., поэтому свинец и олово могут растворяться в таких кислотах как HCl и разбавленной H2SO4,а германий-нет.
Pb+4HCl(конц)=H2[PbCl4]+H2.
|
|
|
Sn+3HCl(конц)=H[SnCl3]+ H2
В присутствии окислителей(Cl2,Br2,H2O2, NaClO,O2) все три металла реагируют с кислотами и растворами щелочей:
Ge+4HCl(конц)+2H2O2=GeCl4+4H2O (с примесью H2[GeCl6);
Sn+6HCl(конц)+2H2O2=H2[SnCl6] +4H2O;
Pb+4HCl(конц)+H2O2=H2[PbCl4}+2H2O;
Ge+2NaOH+2H2O2=Na2[Ge(OH)6];
Sn+2NaOH+2H2O2=Na2[Sn(OH)6];
Pb+2NaOH+H2O2=Na2[Pb(OH)4]
И с концентрированными азотной и серной к-тами:
Ge+4HNO3(конц)=H2GeO3+4NO2+H2O;
Sn+4HNO3(конц)=бета-H2SnO3+4NO2+H2O;
Pb+4HNO3(конц)=Pb(NO3)2+ 2NO2+2H2O (при нагревании);
Ge+2H2SO4(конц)=H2GeO3 +2SO2+H2O;
Sn+4H2SO4(конц)=[SN(SO4)2(H2O)2]+SO2+2H2O;
Pb+3H2SO4(конц)=H2[Pb(SO4)2}+SO2+2H2O,
Но лучше всего растворяются в царской водке:
3Ge+12HCl(конц)+4HNO3(конц)=3GeCl4+4NO+8H2O ( с примесью H2[GeCl6];
3Sn+18HCl(конц)+4HNO3(конц)=3H2[SnCl6]+4NO+8H2O;
3Pb+12HCl(конц)+2HNO3(конц)=3H3[PbCl4]+2NO+4H2O.
В указанных реакциях германий и олово образуют соединения в степени оксиления +4,а свинец в степени окисления +2.
Следует отметить,что в отличии от германия,олово и свинец взаимодействуют с водным раствором щёлочи и в отсутствии окислителей:
Sn+2NaOH+2H2O=Na2[Sn(OH4)]+H2 (в инертной атмосфере);
Pb+2NaOH+2H2O=Na2[Pb(OH)4]+H2.
На холоду в разбавленной азотной к-те олово подобно свинцу окисляется до с.о.+2:
4Sn+10HNO3=4Sn(NO3)2+NH4NO3+3H2O (t=0 гр.C)
В присутствии кислорода свинец и лово реагируют даже с органическими кислотами:
2Pb+4CH3COOH+O2=2Pb(CH3COO)2+2H2O.
Все 3 элемента образуют характерные для них оксиды состава МО и МО2. Для олова и свинца существуют ряд смешанных оксидов,включающих одновременно атомы М^+2 и M^+4(например, Pb3O4, Pb2O3,Sn3O4). Все оксиды имеют амфотерный характер, однако у GeO2 преобладают кислотные свойства, а у PbO-основные свойства. PbO2, Pb2O3, Pb3O4 являются сильными окислителями, а GeO и SnO проявляют сильные восстановительные свойства.
|
|
|
Диоксиды германия и олова получают окислением кислородом простых веществ:
Ge+O2=GeO2;
Sn+O2=SnO2
или обезвоживанием гидроксидов:
H2GeO3=GeO2+H2O;
H2SnO3=SnO2+H2O.
Диоксид свинца PbO2 термически неустойчив, поэтому не может быть получен реакцией окисления свинца кислородом, которая является экзотермической. Его получают анодным окислением металлического свинца в сернокислых растворах или окислением растворимых солей свинца (II) сильными окислителями:
Pb(CH3COO)2+NaClO+H2O=PbO2+2CH3COOH+NaCl
Все диоксиды восстанавливаются углеродом до металла:
МО2+2С=М+2СО (при нагревании)
Диоксид олова – белый аморфный порошок или бесцветные кристаллы. Это твёрдое(7 единиц по Моосу),плотное(6,95 г/см^3) и тугоплавкое(tпл=1625 гр.C) в-во,очень устойчивое в обычных условиях.
С водой, разбавленными кислотами и щелочами диоксид олова реагирует с трудом. При нагревании аморфный диоксид переходит в кристаллическую модификацию. Аморфная модификация растворима в концентрированной соляной кислоте:
SnO2+6HCl(конц)=H2[SnCl6}+2H2O
Обе модификации легко реагируют с расплавами щелочей:
SnO2+2NaOH=Na2SnO3+H2O
Диоксид олова применяют в производстве стекла,керамики,эмалей,электропроводящих плёнок для газовых сенсоров.
Диоксид свинца-коричневато-чёрное кристаллическое в-во. В воде, разбавленных кислотах и щелочах не растворяется. Очень сильный окислитель, диоксид свинца реагирует с конц.кислотами:
PbO2+6HCl(конц)=H2[PbCl4}+Cl2+2H2O (при t>0)
2PbO2+4H2SO4(конц)=2H2[Pb(SO4)2]+O2+2H2O
PbO2+2NaOH+2H2O=Na2[Pb(OH)6] (устойчив только в сильно-щелочной среде)
PbO2+4HCl(конц)=PbCl4+2H2O (при t<0)
PbO2+4CH3COOH=Pb(CH3COO)2+2H2O
PbO2 используется в химии как сильный окислитель,а в промышленности- в качестве активного в-ва положительного электрода в свинцовых аккумуляторах.
Монооксид олова существует в нескольких кристаллических модификациях- сине-чёрной, красно-коричневой и желтовато-зелёной. Получение:
SnO2+CO=SnO+CO2
SnC2O4=SnO+CO+ CO2 (слабое нагревание безводной соли. Самый удобный способ получения).
В отличии от монооксида свинца при сльном нагревании подвергается реакции диспропорционирования:
2SnO=SnO2+Sn
Монооксид свинца существует в виде красной модификации(глет) с тетрагональными кристаллами и в виде жёлтой модификации( массикот) с ромбическими кристаллами.. Получение:
2Pb+O2-2PbO;
2PbO2=2PbO+O2; (термич.разложение)
Pb(NO3)2= PbO+2NO2+1/2O2; (термич.разлож)
PbCO3=PbO+CO2. (термич.разлож)
У PbO преобладают основные св-а; он реагирует с кислотами и с концентрированными растворами щелочей:
PbO+2HNO3=Pb(NO3)2+H2O;
PbO+2KOH+H2O=K2[Pb(OH)4]
Сплавлением монооксида со щелочами или оксидами других металлов можно получить плюмбиты
PbO+CaO=CaPbO2
При нагревании с кислородом(400-500гр.С) монооксид свинца превращается в свинцовый сурик:
6PbO+O2=2Pb3O4
А водная суспензия PbO окисляется хлором и бромом до PbO2:
PbO+Cl2+H2O=PbO2+2HCl
Свинцовый сурик Pb3O4-оксид, в котором свнец имеет степени окисления +2,+4 Это твёрдое вещество красного цвета.
Pb3O4+8CH3COOH=Pb(CH3COO)4+2Pb(CH3COO)2+4H2O
Pb3O4+4HNO3=PbO2+2Pb(NO3)2+2H2O
3PbO2=Pb3O4+O2
Гидроксиды германия,олова и свинца имеют амфотерный характер.
Гидроксид олова(II) можно получить только в неводных растворителях обменной реакцией из оловоорганических соединений:
2(H3C)SnOH+SnCl2=Sn(OH)2+2(H3C)SnCl
Sn(OH)2+NaOH=Na[Sn(OH)3]
Sn(OH)2+3HCl=H[SnCl3]+2H2O
Гидроксид свинца(II)- белое в-во,плохо растворимое в воде и аммиаке.
Pb(OH)2+2HNO3=Pb(NO3)2+2H2O
Pb(OH)2+2KOH=K2[Pb(OH)4] (при pH больше или равно 13)
Pb(OH)2+4HCl=H2[PbCl4]+2H2O
Pb(CH3COO)2+2NH3xH2O=Pb(OH)2+2CH3COONH4
Моносульфиды – малорастворимые соли,их получают пропусканием сероводорода через слегка подкисленные растворы солей Ge(II), Sn(II), Pb(II):
GeCl2+H2S=2HCl+GeS
SnCl2+H2S=2HCl+SnS
Pb(NO3)2+H2S=2HNO3+PbS
Моносульфиды прояляют основные свойства,но регируют только с концентрированными кислотами:
SnS+3HCl=H[SnCl3]+H2S
В отличии от PbS сульфиды олово(II) и германия(II) растворимы в растворах полисульфидов.
SnS+(NH4)2S2=(NH4)2SnS3
3PbS+8HNO3=2NO+3Pb(NO3)2+3S+4H2O
Дисульфиды GeS2 и SnS2. Получение:
K2GeO3+2H2S+2HCl=2KCl+3H2O+GeS2
H2[SnCl6]+2H2S=6HCl+SnS2
Дисульфиды германия и олова обладают кислотными свойствами и хорошо растворимы в щелочах,концентрированном аммиаке,сульфиде и полисульфде аммония:
GeS2+K2S=K2GeS3
2GeS2+6NH4OH=2(NH4)2GeS3+(NH4)2GeO3+3H2O
3SnS2+6NaOH=2Na2SnS3+Na2[Sn(OH)6]
8. Общая характеристика и химические свойства азота.
Оксиды азота: получение, строение молекул, окислительно-восстановительные свойства.
Аммиак и гидразин: получение, химическая связь и строение молекул, кислотно–основные и окислительно-восстановительные свойства.
Реакции термического разложения солей аммония: нитриты, нитрата, бихромата, сульфата, хлорида.
Гидроксиламин, азотистоводородная кислота и ее соли: химическая связь и строение молекул, получение и свойства.
Взаимодействие металлов с азотной кислотой.
Царская водка и её окислительные свойства на примере реакций с золотом, платиной, сульфидом ртути.
Реакции термического разложения нитратов различных металлов.
Азот элемент 2 периода 5 группы и имеет порядковый номер 7, атомная масса 14.Азот занимает большую часть земной атмосферы. В природе круговорот азота, без этого не смогут произрастать растения. Используется в удобрениях. Валентность=3 а если присутствует донорно-акцепторный механизм, то валентность=4. Степень окисления от -3 до +5.
Получают азот ректификацией жидкого воздуха, либо так:
NH4NO2=N2+2H2O (t)
NH4Cl+KNO2=N2+KCl+2H2O (t)
4NH3+3O2=2N2+6H2O (t)
При комнатной температуре химически пассивен, реагирует только с литием. При повышенных t с Ме образуя нитриды. Так же реагирует с бором, образуя нитрид бора и карбидом кальция, образуя цианамид кальция
6Li+N2=2Li3N
N2+3Mg=Mg3N2
nB+n/2 N2=(BN)n (t)
CaC2+N2= CaCN2+C (t)
Важнейшая реакция: N2+3H2=2NH3 (400-500 t, 300-500 p, kat-Fe)
Ни один оксид азота не может быть получен синтезом элементов, а только косвенно.
N2O: веселящий газ. При нормальной температуре это бесцветный негорючий газ с приятным сладковатым запахом и привкусом.
Молекула N2O линейная, малополярная, её строение описывается при помощи двух резонансных структур. Связь между атомами азота равна 0,113 нм, она сравнима с длиной тройной связи.

Получение: Оксид азота (I) получают термическим разложением нитрата аммония при температуре около 200 °С:
NH4NO3 = N2O + 2H2O,
нагревание нужно проводить очень осторожно, перегрев и использование больших количеств нитрата может привести к взрыву.
Химические свойства: Оксид азота (I) не взаимодействует с водой. Несолеобразующий оксид. Проявляет окислительные свойства, в нем, как и в кислороде, вспыхивает тлеющая лучина и ярко горит сера.
При нагревании выше 600 °С разлагается со взрывом:
2N2O = 2N2 + O2.
Взаимодействует с водородом:
N2O + H2 = N2 + H2O.
При поджигании смеси оксида азота (I) и аммиака происходит взрыв:
3N2O + 2NH3 = 4N2 + 3H2O.
При взаимодействии с сильными окислителями проявляет восстановительные свойства:
5N2O + 2KMnO4 + 3H2SO4 = 10NO + 2MnSO4 + K2SO4 + 3H2O.
NO: несолеобразующий оксид азота. В нормальных условиях он представляет собой бесцветный газ, плохо растворимый в воде. Сжижается с трудом ; в жидком и твёрдом виде имеет голубой цвет.
Молекула NO малополярная, линейная, длина связи составляет 0,115 нм, её строение описывается двумя резонансными структурами, обе формы имеют один неспаренный электрон, поэтому молекула является радикалом, но при обычных условиях не склонна к димеризации.

Получение:
В лаборатории получают действием на медь разбавленной азотной кислоты:
3Cu + 8HNO3 = 2NO + 3Cu(NO3)2 + 4H2O.
В промышленности получают каталитическим окислением аммиака на платино-родиевом катализаторе при 700 °С:
4NH3 + 5O2 = 4NO + 6H2O.
В атмосфере образуется из простых веществ в грозовых разрядах:
N2 + O2 = 2NO.
Химические свойства: Оксид азота (II) не взаимодействует с водой. Несолеобразующий оксид. Проявляет восстановительные свойства.
Он легко окисляется кислородом:
2NO + O2 = 2NO2.
Взаимодействует с перманганатом калия в кислой среде:
5NO + 3KMnO4 + 2H2SO4 = 2MnSO4 + 3KNO3 + Mn(NO3)2 + 2H2O.
С хорошими восстановителями проявляет окислительные свойства, и восстанавливается до азота:
Реагирует с сернистым газом:
2NO + 2SO2 = 2SO3 + N2.
При использовании родиевого катализатора окисляет угарный газ в углекислый:
2NO + 2CO = 2CO2 + N2,
такие катализаторы устанавливаются в выхлопных трубах автомобилей.
Не реагирует с кислотами, при взаимодействии с расплавленной щелочью диспропорционирует:
6NO + 4KOH = N2 + 4KNO2 + 2H2O.
N2O3: ;жидкость синего цвета (при н. у.), бесцветный газ (при стандартных условиях), в твёрдом виде — синеватого цвета. Устойчив только при температурах ниже −4 °C. Без примесей NO2 и NO существует только в твёрдом виде.
Молекула N2O3 плоская и состоит из фрагментов ON – NO2 c непрочной связью N – N. У атома азота имеется неподеленная пара электронов. Твердый оксид азота (III) – ионное соединение.

Получение:
1. Образуется при охлаждении до -36 °С смеси оксидов азота (II) и (IV):
NO + NO2 = N2O3.
2. При взаимодействии 50 %-ной азотной кислоты с оксидом мышьяка (III) при низкой температуре:
2HNO3 + As2O3 + 2H2O = 2H2AsO4 + N2O3.
3. При обезвоживании азотистой кислоты:
NaNO2 + H2SO4 = NaHSO4 + HNO2;
2HNO2 = N2O3 + H2O.
Химические свойства: Оксид азота (III) – типичный кислотный оксид, взаимодействует с водой с образованием азотистой кислоты:
N2O3 + H2O = 2HNO2.
При взаимодействии со щелочами образуются соли азотной кислоты – нитриты:
N2O3 + 2NaOH = 2NaNO2 + H2O.
NO2: газ, красно-бурого цвета, с характерным острым запахом или желтоватая жидкость.
Молекула NO2 имеет угловую форму, предполагается, что атом азота находится в состоянии sp2-гибридизации, длина связи N – O равна 0,119 нм, что соответствует полуторной связи.
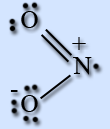
NO2
На атоме азота имеется неспаренный электрон, поэтому он легко димеризуется с образованием димера N2O4. Молекула N2O4 плоская и состоит из фрагментов 2ON – NO2 c непрочной связью N – N.

N2O4
Получение
В лаборатории образуется при взаимодействии меди с горячей концентрированной азотной кислотой:
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O;
при термическом разложении высушенных нитратов тяжелых металлов:
2Pb(NO3)2 = 2PbO + 4NO2 + O2.
В промышленности окисление оксида азота (II) кислородом:
2NO + O2 = 2NO2,
реакция является обратимой.
Химические свойства
Оксид азота, и мономер, и димер, хорошо растворим в воде, и взаимодействует с ней:
2NO2 + H2O = HNO3 + HNO2,
при этом происходит диспропорционирование на азотную и азотистую кислоты.
При температуре выше 0 °С реакция протекает по другому:
3NO2 + H2O = 2HNO3 + NO.
Если через воду пропускать смесь оксида азота (IV) и воздуха, то образуется только азотная кислота:
4NO2 + 2H2O + О2 = 4HNO3.
Диоксид азота – сильный окислитель, в его атмосфере горят углерод и сера:
С + 2NO2 = CO2 + 2NO;
S + 2NO2 = SO2 + 2NO.
N2O5 — бесцветные, очень летучие кристаллы. Крайне неустойчив.
Оксид азота (V) – ангидрид азотной кислоты, построен из ионов NO2+ и NO3-, в газовой фазе и растворе состоит из молекул N2O5.

Получение
1. Образуется при пропускании азотной кислоты через колонку с оксидом фосфора (V):
2HNO3 + P2O5 = N2O5 + 2HPO3,
реакция протекает при -10 °С.
2. Получается при окислении оксида азота (IV) озоном:
2NO2 + O3 = N2O5 + O2.
Химические свойства
Разложение:
2N2O5 = 4NO2 + O2.
При растворении в воде образует азотную кислоту:
N2O5 + H2O = 2HNO3.
Является сильным окислителем:
N2O5 + I2 = I2O5 + N2.
Аммиа́к — NH3, нитрид водорода, при нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта).
Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине. Три неспаренных p-электрона атома азотаучаствуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать донорно-акцепторную связь с ионом водорода, образуя ион аммония NH4+. Благодаря тому, что не связывающее двухэлектронное облако строго ориентировано в пространстве, молекула аммиака обладает высокой полярностью, что приводит к его хорошей растворимости в воде.
Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота:
N2 + 3H2 ↔ 2NH3
Это так называемый процесс Габера
Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония:
NH4Cl + NaOH = NH3↑ + NaCl + H2O.
NH4NO3 + NaOH = NH3↑ + NaNO3 + H2O.
1. Реакции присоединения:
а) С водой: (реакция обратимая»)
NH3 + H2O = NH3*H2O
или NH3 + H2O = NH4OH
б) С кислотами:
NH3 + HCl = NH4Cl
NH3 + H2SO4 = NH4HSO4
2 NH3 + H2SO4 = (NH4)2SO4
в) С кислыми солями аммония (превращает в средние)
NH3 + NH4H2PO4 = (NH4)2HPO4
NH3 + NH4HSO4 = (NH4)2SO4
2. С кислородом:
4NH3 + 3О2 = 2N2 + 6H2O
4NH3 + 5О2 = 4NO + 6H2O
3. C хлором:
NH3 + 3Cl2 = 2N2 ↑ + 6HCl
4. С оксидом меди (II):
3CuO + 2 NH3 = 3Cu + N2 ↑ + 3H2O
5. C металлами:
2NH3 + 2Al = 2AlN +3H2
6. С углекислым газом
2 NH3 + CO2 = H2O + CO(NH2)2
7. Реакция разложения:
2 NH3 = N2 + 3H2
Гидрази́н (диамид) H2N—NH2 — бесцветная, сильно гигроскопическая жидкость с неприятным запахом. Ядовитый.
Гидразин получают окислением аммиака NH3 или мочевины CO(NH2)2 гипохлоритом натрия NaClO:
NH3 + NaClO 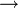 NH2Cl + NaOH
NH2Cl + NaOH
NH2Cl + NH3 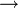 N2H4 · HCl,
N2H4 · HCl,
реакция проводится при температуре 160 °C и давлении 2,5−3,0 МПа.
Синтез гидразина окислением мочевины гипохлоритом по механизму аналогичен синтезу аминов из амидов по Гофману:
H2NCONH2 + NaOCl + 2 NaOH 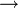 N2H4 + H2O + NaCl + Na2CO3,
N2H4 + H2O + NaCl + Na2CO3,
реакция проводится при температуре ~100 °C и атмосферном давлении.
В целом гидразин характеризуется восстановительными свойствами:
N2H4+O2=N2+2H2O (t)
| -3 |
Только очень сильные восстановители способны восстановить его до N
N2H4+Mg+4HCl=MgCl2+2NH4Cl
ТЕРМИЧЕСКОЕ РАЗЛОЖЕНИЕ СОЛЕЙ АММОНИЯ:
NH4NO3=N2O+2H2O (250°)
2NH4NO3=2N2+O2+2H2O (400°)
NH4NO2=N2+2H2O (t)
(NH4)2Cr2O7=N2+Cr2O3+4H2O (t)
NH4Cl=NH3+HCl (t)
(NH4)2SO4=2NH3+H2SO4 (t)
Гидроксиламин (NH2OH) –кристаллическое ядовитое вещество, проявляющее преимущественно восстановительные свойства.
Получение: электрохимиичекски врсстанавливают раствор азотной кислоты, на катоде суммарно происходит реакция: HNO3+ 6H++6е= NH2OH+2H2O
Свойства:
NH2OH+2KMnO4+9H2SO4=5N2+2MnSO4+K2SO4+18H2O
2NH2OH+I2+2KOH=N2+2KI+4H2O
Промежуточная степень окисления атома азота объясняет диспропорционирование этого соединения при нагревании и способность восстанавливаться до иона NH4+
3NH2OH=N2+NH3+3H2O(t)
4KI+2NH2OH+3H2SO4=2I2+(NH4)2SO4+K2SO4+2H2O
NH2OH+HCl=[NH3OH]Cl
Азотистый водород (в растворе-азотистоводородная кислота) может быть получена следующим образом:
N2H4+HNO2=HN3+H2O
Соль этой кислоты-азид натрия-получают так:
2NaNH2+N2O=NaN3+H2O (200°)
Как окислитель HN3 в растворе имее черты сходства с азоткой, например:
Cu+3HN3=Cu(N3)2+N2+NH3
Азиды щелочные и щелочноземельных металлов плавятся не разлагаясь и хорошо растворимы в воде, азиды тяжелых металлов при нагревании и даже от удара взрываются.
Дата добавления: 2018-08-06; просмотров: 786; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
