Потери в весе при высушивании
NATRII CHLORIDUM
НАТРИЯ ХЛОРИД
Natrium chloratum
NaCl М=58,44
Свойства
Описание
Белые кубические кристаллы или белый кристаллический порошок без запаха, соленого вкуса.
Растворимость
Растворим в 3 ч. воды, мало растворим в спирте.
Подлинность
• Na+
• 0,1 г препарата растворяют в 5 мл воды, подкисляют разведенной уксусной кислотой, затем прибавляют 0,5 мл раствора цинк-уранил-ацетата. Образуется желтый кристаллический осадок.
NaCl + Zn(UO2)3 (CН3COO)8 + СН3СООН + 9Н20=Na[Zn(U02)3(CH3C00)9] • 9Н20↓+ НСl
2. Крупинка препарата, внесенная в бесцветное пламя, окрашивает его в желтый цвет.
• Сl-
0,1 г препарата растворяют в 5 мл воды, прибавляют 0,5 мл разведенной азотной кислоты и 0,5 мл раствора нитрата серебра. Образуется белый творожистый осадок, нерастворимый в разведенной азотной кислоте и растворимый в растворе аммиака.
HNO3
NaCl + AgN03 = AgCl ↓+ NaN03
AgCl ↓+ 2NH4OH -> [Ag(NH3)2]Cl + 2Н20
хлорид диаммин серебра
[Ag(NH3)2]Cl + 2HNO3 = AgCl ↓+ 2NH4N03
ИСПЫТАНИЯ НА ЧИСТОТУ
Прозрачность и цветность раствора
10 г препарата растворяют в 100 мл свсжепрокипяченной и охлаж-
денной воды. Полученный раствор должен быть бесцветным и прозрачным.
Кислотность или щелочность
К 50 мл того же раствора прибавляют 5 капель раствора бромтимоло-
вого синего и разливают на две части. К 25 мл прибавляют 1 каплю 0,02
моль/л раствора едкого натра; должно появиться голубое окрашивание. К
другим 25 мл прибавляют 1 каплю 0,02 моль/л раствора соляной кислоты;
должно появиться желтое окрашивание.
Интервал перехода цвета индикатора: pH = 6,0 — 7,6
Изменение цвета индикатора:
щелочная среда нейтральная среда кислая среда
синий зеленый желтый
КАЛЬЦИЙ
4аммиака и 1 мл раствора оксалата аммония, перемешивают и через 10 минут сравнивают с эталоном, к которому прибавлено такое же количество реактивов.
 COONH4 СОО
COONH4 СОО
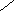 Са2* + ! = | Ca ↓+ 2NH4+
Са2* + ! = | Ca ↓+ 2NH4+
COONH4 COO
бел.
Муть, появившаяся в испытуемом растворе, не должна превышать эталон.
МАГНИЙ
5 мл того же раствора не должны давать мути от прибавления 0,5 мл раствора аммиака и раствора гидрофосфата натрия.
NH4CI
Mg2‘ + Na2HPO4 + NН4ОН = MgNH4PO4 ↓+ H20 + 2Na‘
БАРИЙ
10 мл того же раствора не должны давать помутнения с разведенной серной кислотой при наблюдении в течение 2-х часов.
ЖЕЛЕЗО
10 мл того же раствора не должны содержать железа более, чем 1 мл эталонного раствора, разведенный водой до 10 мл (не более 0,0003% в препарате).
К 10 мл испытуемого раствора прибавляют 2 мл раствора сульфоса- лициловой кислоты и 1 мл раствора аммиака и через 5 мин сравнивают с эталоном, к которому прибавлено такое же количество реактивов.
Растворы солей Fe2+ и Fe3* в зависимости от концентрации образуют с раствором сульфосалициловой кислоты в аммиачной среде коричнево-красные растворы феррилсульфосалицилатных комплексов.
ТЯЖЕЛЫЕ МЕТАЛЛЫ
10 мл того же раствора должны выдерживать испытание на тяжелые металлы (не более 0,0005 % в препарате).
К 10 мл испытуемого раствора прибавляют 1 мл разведенной уксусной кислоты, 2 капли раствора сульфида натрия, перемешивают и через 1 мин сравнивают с эталоном, состоящим из 1 мл эталонного раствора, 9 мл воды и такого же количества прибавленных реактивов.
СН3СООН
Pb2+ + Na2S = PbS ↓ + 2Na2+
черный
Наблюдение окраски проводят по оси пробирок диаметром 1,5 см, помещенных на белой поверхности. В испытуемом растворе не должно появиться черное или бурое окрашивание. В сравниваемых растворах допускается лишь слабая опалесценция от серы, выделяющейся из сульфида натрия.
СУЛЬФАТЫ
Раствор 2 г препарата в 10 мл воды должен выдерживать испытание на сульфаты (не более 0,005 % в препарате).
К 10 мл испытуемого раствора прибавляют 0,5 мл разведенной хлористоводородной кислоты и 1 мл раствора хлорида бария, перемешивают и через 10 минут сравнивают с эталоном, состоящим из 10 мл эталонного раствора и такого же количества реактивов, какое прибавлено к испытуемому раствору. Муть, появившаяся в испытуемом растворе, не должна превышать эталон.
SO42- + BaCl2 = BaSO4 ↓+ 2Cl-
КАЛИЙ
Раствор 0,5 г препарата и 5 мл воды не должен давать мути от прибавления раствора виннокаменной кислоты.
СООН COOK
СНОН СНОН
I + к+ -> I ↓ + н+
СНОН СНОН
СООН COOH
H2C4H4O6 + K+ = KHC4H4O6 ↓+ H+
СОЛИ АММОНИЯ
Раствор 0,5 г препарата в 10 мл воды должен выдерживать испытание на соли аммония (не более 0,004 % в препарате).
К 10 мл испытуемого раствора прибавляют 3 капли реактива Несслера, перемешивают и через 5 минут сравнивают с эталоном, к которому прибавлено такое же количество реактива.
2K2[HgJ4] + ЗКОН + NH3 -> [ОHg2 NH2]J ↓+ 7KJ + 2H20 ,
желто-бурый
Соли аммония в зависимости от концентрации образуют с реактивом Несслера желто-бурый осадок или желтое окрашивание. Окраска, появившаяся в испытуемом растворе, не должна превышать эталон.
МЫШЬЯК
1 г препарата должен выдерживать испытание на мышьяк (не более 0,00005 % в препарате).
Потери в весе при высушивании
Около 1 гпрепарата (точная навеска) сушат при 110 °С до постоянного веса. Потеря в весе не должна превышать 0,5 %.
Количественное определение
Аргентометрия. Метод осаждения по Мору
Около 1 г препарата (точная навеска) растворяют в воде в мерной колбе емк. 50 мл и доводят объем раствора водой до метки. 5 мл полученного раствора разбавляют водой до 40 мл и титруют 0,1 моль/л раствором нитрата серебра до оранжево-желтого окрашивания. Индикатор — хромат калия.
1 мл 0,1 моль/л раствора нитрата серебра соответствует 0,005844 г NaCl, которого в пересчете на сухое вещество должно быть не менее 99,5 %.
NaCl + AgN03 —> AgCl ↓+ NaN03
0,1 моль/л
2AgN03 + K,CrO, -> Ag2Cr04 ↓+ 2KN03
лишняя желтооранж.
капля
Формула расчета: % = V*K*T*100%
a
ЗАНЯТИЕ 2
АНАЛИЗ РАСТВОРА НАТРИЯ БРОМИДА 2 % — 100 МЛ, ИЗГОТОВЛЕННОГО В АПТЕКЕ ПО ИНДИВИДУАЛЬНОМУ РЕЦЕПТУ
Задачи
1. Освоить внутриаптечный контроль жидкой лекарственной формы, изготовленной в аптеке по индивидуальному рецепту.
2. Научиться делать обзор возможных методов химического анализа и выбирать наиболее экономически выгодный.
3. Совершенствовать навыки титриметрического количественного определения однокомпонентных растворов.
4. Научиться рассчитывать отклонения, сравнивать с допустимой нормой, делать заключение и оформлять результаты анализа.
5. Научиться рассчитывать навеску, минимальный объем титранта или интервал объема титранта, при котором лекарственная форма будет удовлетворять требованиям приказа М3 РФ № 751
Вопросы для самоподготовки
1. Назовите виды внутриаитечного контроля, обязательные по приказу М3 РФ №751 для данной лекарственной формы. Какие виды контроля проводятся выборочно с целью проверки работы фармацевта? Составьте общий алгоритм всех видов контроля данной лекарственной формы.
2. Назовите специфические показатели качества, проверяемые в жидких лекарственных формах.
3. Приведите обзор методов качественного анализа лекарственной формы. Выберите наиболее убедительную реакцию для качественного экспресс-анализа.
4. Приведите обзор возможных методов количественного определения лекарственной формы. Дайте оценку методам. Выберите наиболее экономически выгодный метод количественного экспресс-анализа.
5. Как рассчитать навеску и минимальный объем титранта? Интервал объема титранта, при котором он удовлетворяет требованиям приказа М3 РФ № 751? Титр? Содержание натрия бромида при титриметрическом и рефрактометрическом определениях? Отклонения и сравнение с допустимой нормой?
6. Как произвести оценку качества проверенной лекарственной формы?
Назовите документ, где делаются отметки о произведенной проверке.
Материальное обеспечение
Реактивы и растворители:
• кислота азотная;
• кислота хлористоводородная;
• раствор белильной (хлорной) извести или раствор хлорамина;
• хлороформ;
• кислота уксусная.
Титрованные растворы и индикаторы:
• 0,1 моль/л раствор нитрата серебра;
• раствор хромата калия
• раствор бромфенолового синего.
Посуда, приборы, оборудование:
• титровальная установка;
• мерная пипетка 1 мл;
• сахарный стаканчик или колба для титрования;
• часовое стекло;
• пробирки;
• вата.
Дата добавления: 2018-08-06; просмотров: 947; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
