Методи і засоби для аналізу складу рідин
Загальні відомості
В ході хіміко-технологічних процесів змінюється хімічний склад речовин, що перероблюються, а також їх властивості.
При контролі і автоматизації данних процесів аналізують, головним чином, рідкі і газоподібні речовини. Різноманітність аналізованих компонентів і сумішей, що знаходяться в умовах різного тиску і температур, визначають собою велику кількість вимірювальних засобів.
В загальному випадку під аналізом складу речовин розуміють визначення їх елементарного, функціонального або молекулярного складу. Часто, також необхідно визначити їх фазовий склад.
Прилади для визначення складу речовин називаються аналізаторами. Аналізатори, призначені для визначення лише одного компонента в суміші, називаються концентратомірами.
Електропровідність розчинів. Основним розчинником хімічних речовин є вода. Молекула води 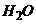 , може бути подана у вигляді двох різнополярних іонів:
, може бути подана у вигляді двох різнополярних іонів: 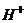 і
і 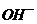 . Зв'язок між цими іонами сильний, тому в дистильованій воді кількість вільних носіїв заряду обмежена, тобто дисоціація (
. Зв'язок між цими іонами сильний, тому в дистильованій воді кількість вільних носіїв заряду обмежена, тобто дисоціація ( 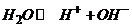 ) проходить слабко. Оскільки вода є речовиною з високою діелектричною проникністю, то вона активно розщеплює молекули кислот, основ і солей на позитивні та негативні іони, іншими словами ці речовини активно дисоціюють у воді, утворюючи розчини.
) проходить слабко. Оскільки вода є речовиною з високою діелектричною проникністю, то вона активно розщеплює молекули кислот, основ і солей на позитивні та негативні іони, іншими словами ці речовини активно дисоціюють у воді, утворюючи розчини.
Речовини, які розчиняються у воді (або в іншому розчиннику) з утворенням позитивних і негативних іонів, називають електролітами. Розчини кислот, солей і основ у воді або інших розчинниках є електропровідними і називаються провідниками другого роду.
|
|
|
Дисоціація може відбуватися і без участі розчинника, наприклад, при розплаві кристалів солей. В електрохімічному відношенні таке середовище поводить себе як розчин, і також є провідником другого роду.
Під дією електричного поля, яке утворюється при прикладенні до електродів напруги, позитивні іони (водню або металу) рухатимуться до катода, а негативні (гідроксильні групи або кислотні залишки) - до анода. Електропровідність розчинів залежить від їх концентрації.
Розрізняють відсоткову, масову, молярну і нормальну (еквівалентну) концентрації. Перша виражає відсотковий вміст розчиненої речовини в масі розчину. Масовою концентрацією називають відношення маси розчиненої речовини до об'єму розчину (г/л). Молярна концентрація 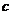 визначається кількістю молів розчиненої речовини в одиниці об'єму розчину (
визначається кількістю молів розчиненої речовини в одиниці об'єму розчину ( 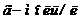 , або
, або 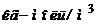 ). Якщо концентрація дорівнює 1
). Якщо концентрація дорівнює 1 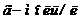 , то розчин називають молярним. Таку концентрацію позначають 1 М. Нормальну концентрацію виражають в грам-еквівалентах розчиненої речовини в 1 л розчину (1 г-екв/л).
, то розчин називають молярним. Таку концентрацію позначають 1 М. Нормальну концентрацію виражають в грам-еквівалентах розчиненої речовини в 1 л розчину (1 г-екв/л).
|
|
|
Розчин, що має концентрацію 1 г-екв/л, називають нормальним (1 н.). Інші значення концентрації виражаються як кратні молярній або нормальній, наприклад, 0,1 М; 0,01 М або 0,1 н.; 0,01 н.
Питома електропровідність 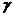 розчину залежить від його концентрації і пропорційна хімічній активності розчину
розчину залежить від його концентрації і пропорційна хімічній активності розчину
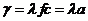 , (7.1)
, (7.1)
де 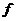 - коефіцієнт активності;
- коефіцієнт активності; 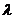 - еквівалентна електропровідність;
- еквівалентна електропровідність;  - хімічна активність розчину;
- хімічна активність розчину; 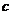 - молярна концентрація.
- молярна концентрація.
Коефіцієнт активності 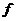 дорівнює одиниці, якщо концентрації розчинів дуже слабкі і зменшується в міру підвищення концентрації. Отже, питома електропровідність є деякою функцією концентрації розчину.
дорівнює одиниці, якщо концентрації розчинів дуже слабкі і зменшується в міру підвищення концентрації. Отже, питома електропровідність є деякою функцією концентрації розчину.
Рухливість іонів залежить від температури розчину. Звідси електропровідність розчину також залежить від температури. Якщо концентрації невеликі (до 0,05 н.), то ця залежність описується виразом
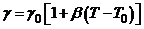 , (7.2)
, (7.2)
де 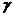 ,
, 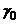 - електропровідності розчину при температурах відповідно
- електропровідності розчину при температурах відповідно 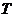 і
і 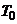 ;
; 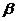 - температурний коефіцієнт електропровідності (
- температурний коефіцієнт електропровідності ( 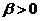 ).
).
При нормальній для хімічних процесів температурі (+18  ) приблизні значення
) приблизні значення 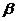 дорівнюють: 0,016 1/К для кислот; 0,019 1/К для основ і 0,024 1/К для солей. З підвищенням температури понад 40...50
дорівнюють: 0,016 1/К для кислот; 0,019 1/К для основ і 0,024 1/К для солей. З підвищенням температури понад 40...50  температурна залежність електропровідності стає нелінійною, а значення
температурна залежність електропровідності стає нелінійною, а значення 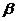 зменшується.
зменшується.
|
|
|
Електродні та граничні потенціали. Під час занурення металевого електрода в розчин, матеріал останнього почне розчинятися. Позитивно заряджені іони металу переходитимуть у розчин, а на електроді утвориться надлишок електронів, у зв’язку з чим данний електрод заряджатиметься негативно відносно розчину. Потенціал електрода щодо розчину в який він поміщений, називають електродним потенціалом.
Встановити безпосередньо значення електродного потенціалу неможливо, оскільки для його вимірювання необхідний інший електрод, розміщення якого в розчині призводить до виникнення його власного електродного потенціалу. Таким чином може бути виміряна різниця двох електродних потенціалів. Приймаючи один з потенціалів за базовий, можна оцінити відносне значення другого потенціалу. За базовий приймають потенціал так званого водневого електрода відносно розчину з нормальною активністю водневих іонів.
В якості водневого електрода (рис.7.1) використовують платиновий електрод, на поверхню якого адсорбують газоподібний водень.
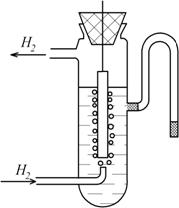
Рис.7.1. Будова водневого електрода
Значення електродних потенціалів різних речовин відносно водневого електрода визначаються загалом властивостями самої речовини і залежать від концентрації та температури розчину (рівняння Нернста)
|
|
|
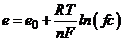 , (7.3)
, (7.3)
де 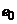 - нормальний потенціал електрода (електродний потенціал при
- нормальний потенціал електрода (електродний потенціал при 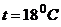 і нормальній концентрації розчину);
і нормальній концентрації розчину); 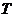 - абсолютна температура розчину,
- абсолютна температура розчину, 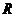 - універсальна газова стала;
- універсальна газова стала; 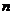 - валентність іонів;
- валентність іонів; 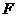 - стала Фарадея.
- стала Фарадея.
Враховуючи числові значення сталих 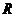 і
і 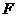 і переходячи до десяткових логарифмів, вираз для електродного потенціалу при
і переходячи до десяткових логарифмів, вираз для електродного потенціалу при 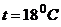 можна записати у вигляді
можна записати у вигляді
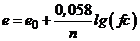 . (7.4)
. (7.4)
Значення нормальних електродних потенціалів знаходяться в межах від -3 до +3 В.
Електрохімічний перетворювач може складатись з двох електродів, вміщених у різні розчини (рис. 7.2). Кожна окрема комірка такого складового гальванічного елемента називається напівелементом. У загальному випадку ЕРС, що виникає між двома напівелементами дорівнюватиме
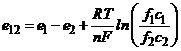 . (7.5)
. (7.5)
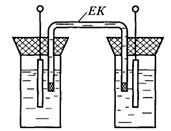
Рис. 7.2. Гальванічне коло з двох напівелементів
Якщо напівелементи відрізняються тільки концентрацією однойменних іонів, то ЕРС такого гальванічного елемента (оскільки 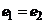 ) залежить тільки від співвідношення активностей розчину
) залежить тільки від співвідношення активностей розчину
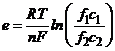 . (7.6)
. (7.6)
На межі двох розчинів внаслідок різної активності іонів (різної швидкості дифузії) також виникає деяка різниця потенціалів. Це граничний або дифузійний потенціал, значення якого може досягти десятків мілівольт. Для зменшення дифузійної рзниці потенціалів два напівелементи з’єднуються у гальванічне коло за допомогою електроітичного ключа ЕК (рис. 7.2) – трубки, заповненої концентрованим розчином з близькими за значенням рухливостями аніонів і катіонів, наприклад, 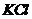 . Кінці електролітичного ключа закриваються напівпроникними корками.
. Кінці електролітичного ключа закриваються напівпроникними корками.
– Гальванічні перетворювачі pH-метрів
Принцип дії гальванічних перетворювачів рН-метрів грунтується на залежності електродних потенціалів від активності водневих іонів, за якою можна визначити, наприклад, концентрацію водних розчинів.
На практиці активність водневих іонів характеризують водневим показником рН, який визначається як від'ємний логарифм активності іонів водню:
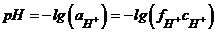 . (7.7)
. (7.7)
Показник рН для водних розчинів при нормальній температурі змінюється від 0 (для сильно концентрованих водних розчинів кислот) до 14 одиниць (для концентрованих водних розчинів лугів). Для чистої води рН=7.
Прилад, призначений для вимірювання рН, називають рН-метром. Найточніший метод вимірювань рН грунтується на визначенні електродних потенціалів різних електродів, розміщених у досліджуваному розчині. Гальванічні перетворювачі рН-метрів складаються з двох напівелементів: скляного вимірювального, електродний потенціал якого є функцією  досліджуваного розчину та допоміжного, електродний потенціал якого відомий і не залежить від властивостей досліджуваного розчину.
досліджуваного розчину та допоміжного, електродний потенціал якого відомий і не залежить від властивостей досліджуваного розчину.
Скляний вимірювальний напівелемент (рис. 7.3, а) - це тонкостінна (0,05...0,1 мм) колба 1, нижня сферична частина 2 якої виготовлена із спеціального мембранного скла і заповнена розчином із відомим значенням 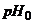 . Всередині колби розміщений хлорсрібний допоміжний електрод 3 (платиновий стержень, покритий шаром хлористого срібла).
. Всередині колби розміщений хлорсрібний допоміжний електрод 3 (платиновий стержень, покритий шаром хлористого срібла).
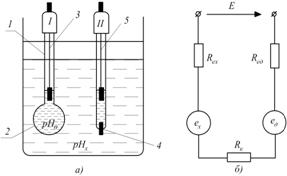
Рис. 7.3. Будова гальванічного перетворювача рН-метра та еквівалентна електрична схема
При зануренні такого скляного напівелемента в досліджуваний розчин на зовнішній стінці колби на межі скло – досліджуваний розчин виникає електродний потенціал 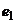 , значення якого є функцією
, значення якого є функцією  . Це пояснюється процесами іонного обміну. Лужні іони скла (натрій чи літій) переходять у розчин, а їх місця займають рухливіші іони водню із розчину. Внаслідок цього поверхневії шар скла буде насиченим водневими іонами, а скляний електрод набуде властивостей водневого електрода. Водночас на внутрішній стінці колби виникає електродний потенціал
. Це пояснюється процесами іонного обміну. Лужні іони скла (натрій чи літій) переходять у розчин, а їх місця займають рухливіші іони водню із розчину. Внаслідок цього поверхневії шар скла буде насиченим водневими іонами, а скляний електрод набуде властивостей водневого електрода. Водночас на внутрішній стінці колби виникає електродний потенціал 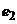 , значення якого зумовлене властивостями буферного розчину, не залежить від
, значення якого зумовлене властивостями буферного розчину, не залежить від  і є незмінним при незмінній температурі. Ще один електродний потенціал
і є незмінним при незмінній температурі. Ще один електродний потенціал 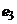 , незалежний від
, незалежний від  , виникає на хлорсрібному електроді. Результуючий електродний потенціал
, виникає на хлорсрібному електроді. Результуючий електродний потенціал 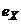 вимірювального напівелемента дорівнюватиме алгебраїчній сумі трьох вищезгаданих електродних потенціалів і міститиме складову
вимірювального напівелемента дорівнюватиме алгебраїчній сумі трьох вищезгаданих електродних потенціалів і міститиме складову 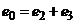 , незалежну від
, незалежну від  , та складову
, та складову 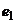 , що є функцією вимірюваної величини
, що є функцією вимірюваної величини  :
:
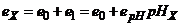 , (7.8)
, (7.8)
де 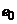 - електродний потенціал вимірювального напівелемента при
- електродний потенціал вимірювального напівелемента при 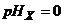 ;
; 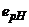 - коефіцієнт, значення якого зумовлене параметрами вимірювального напівелемента (питома ЕРС електрода, мВ/рН).
- коефіцієнт, значення якого зумовлене параметрами вимірювального напівелемента (питома ЕРС електрода, мВ/рН).
Шар скла між обома поверхнями колби є, по суті, провідником з великим електричним опором від 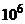 до
до 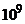 Ом, який з'єднує електрично два джерела ЕРС, а саме
Ом, який з'єднує електрично два джерела ЕРС, а саме 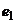 та
та 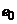 (рис. 7.3, б).
(рис. 7.3, б).
За допоміжний може бути використаний розглянутий вище водневий напівелемент. Але його практичне застосування обмежене через необхідність безперервного насичення воднем. Тому на практиці використовують звичайно так звані хлорсрібні чи інші напівелементи.
Допоміжний хлорсрібний напівелемент (електрод) - це товстостінний скляний корпус, всередині якого знаходиться срібний електрод, поміщений в 3,5 н. розчин KCl, що містить кристал хлористого срібла. Від досліджуваного розчину внутрішня частина електрода ізольована гумовими мембранами, в просторі між якими знаходиться також 3,5 н. розчин KCl. Дифузійний потенціал на поверхні розділювальної мембрани досягає до 10 мВ. Загальний опір електрода не перевищує 20 кОм.
Допоміжний напівелемент може бути розміщений в досліджуваному розчині чи за його межами, але в обох випадках з'єднаний з досліджуваним розчином за допомогою відповідно розділювальної мембрани чи електролітичного ключа. На рис.7.3, а допоміжний напівелемент II поміщений в досліджуваний розчин і електрично з'єднаний з ним за допомогою електролітичного ключа 4. Еквівалентна електрична схема такого гальванічного перетворювача наведена на рис.7.3, б. Тут 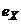 і
і 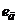 - відповідно електродні потенціали вимірювального та допоміжного напівелементів,
- відповідно електродні потенціали вимірювального та допоміжного напівелементів, 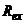 та
та 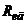 – відповідно повні опори вимірювального та допоміжного електродів;
– відповідно повні опори вимірювального та допоміжного електродів; 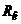 - опір електролітичного ключа.
- опір електролітичного ключа.
Вихідною величиною такого гальванічного перетворювача буде різниця електродних потенціалів
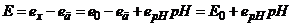 . (7.9)
. (7.9)
Основними складовими похибками рН-метрів є температурна похибка, а також дифузійні потенціали. Для зменшення температурної похибки застосовують електричні кола температурної корекції, а для зменшення дифузійних потенціалів - з'єднання напівелементів через електролітичний ключ.
Запитання для самоконтролю
1. Електропровідність розчинів.
2. Електродні та граничні потенціали.
3. Що представляє собою водневий електрод?
4. Яка будова електрохімічного перетворювача?
5. Гальванічні перетворювачі.
6. Вимірювання рН.
7.2. Методи аналізу розчинів
- Кондуктометричний метод аналізу
Метод вимірювання електричної провідності розчинів електролітів (кондуктометрія) широко застосовують в лабораторній і виробничій практиці для хімічного аналізу і автоматичного контролю низки технологічних параметрів.
При розчиненні, електроліти дисоціюють на іони.
Степінь дисоціації  визначається відношенням числа молекул
визначається відношенням числа молекул 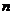 , що розпались на іони до загального числа молекул
, що розпались на іони до загального числа молекул 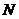 (іонізованих
(іонізованих 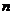 і не іонізованих
і не іонізованих 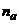 )
)
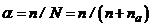 . (7.10)
. (7.10)
Якщо 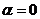 , то речовина не є електролітом. Якщо
, то речовина не є електролітом. Якщо 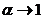 , то речовина є сильним електролітом. Для слабких електролітів
, то речовина є сильним електролітом. Для слабких електролітів 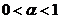 .
.
Здатність речовини проводити електричний струм характеризується питомою електричною провідністю 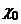
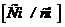 яка визначається як
яка визначається як
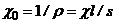 , (7.11)
, (7.11)
де 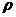 - питомий електричний опір (
- питомий електричний опір ( 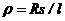 );
); 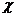 - електрична провідність речовини (
- електрична провідність речовини ( 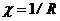 , де
, де 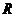 - електричний опір даної речовини);
- електричний опір даної речовини); 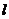 і
і 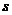 - відповідно дожина і площа поперечного перерізу провідника.
- відповідно дожина і площа поперечного перерізу провідника.
Для вимірювання провідності використовують електролітичну вимірювальну комірку (рис. 7.4), яка представляє собою посудину заповнену аналізованим розчином і в якій знаходиться мінімум два електроди.
Відношення 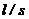 ,
, 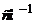 називається постійною комірки
називається постійною комірки  (
( 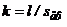 ).
).
В кондуктометрії часто оперують поняттям еквівалентної електричної провідності 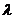 , яка зв’язана з питомою електричною провідністю
, яка зв’язана з питомою електричною провідністю 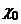
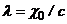 або
або 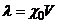 , (7.12)
, (7.12)
де 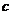 - концентрація електроліту, (моль/мл);
- концентрація електроліту, (моль/мл); 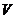 - об’єм електроліта (мл).
- об’єм електроліта (мл).
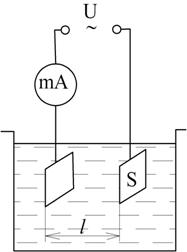
Рис. 7.4. Схема двоелектродної електролітичної комірки
Наявність функціональної залежності 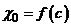 обумовлює широке застосування методу кондуктометрії для визначення концентрації електролітів.
обумовлює широке застосування методу кондуктометрії для визначення концентрації електролітів.
В практиці вимірювання електричної провідності застосовують в основному кондуктометричні прилади таких типів: контактні з дво- і чотириелектродними комірками; безконтактні низькочастотні з вимірювальною коміркою у вигляді «рідинного витка» та безконтактні високочастотні з вимірювальними комірками ємнісного та індуктивного типів.
- Контактні кондуктометричні прилади
Вимірювальна схема двоелектродної кондуктометричної комірки (рис.7.5) містить:  ,
, 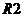 ,
, 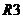 - постійні манганінові резистори та
- постійні манганінові резистори та  – змінний компенсуючий резистор. Опір розчину кондукто-метричної комірки позначено
– змінний компенсуючий резистор. Опір розчину кондукто-метричної комірки позначено  .
.
При зміні концентрації контрольованого розчину змінюється опір  і в діагоналі
і в діагоналі  мосту виникає різниця потенціалів. Сигнал розбалансу, пропорційний концентрації, підсилюється електронним підсилювачем ЕП і надходить до реверсивного двигуна РД, який переміщує повзунок змінного резистора
мосту виникає різниця потенціалів. Сигнал розбалансу, пропорційний концентрації, підсилюється електронним підсилювачем ЕП і надходить до реверсивного двигуна РД, який переміщує повзунок змінного резистора  та зв’язану з ним стрілку показчика величини концентрації.
та зв’язану з ним стрілку показчика величини концентрації.
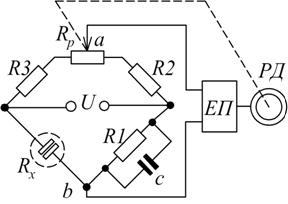
Рис. 7.5. Вимірювальна схема двоелектродної електролітичної комірки
Для компенсації температурної похибки застосовують автоматичні температурні компенсатори з використанням терморезистивного перетворювача 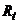 (рис.7.6).
(рис.7.6).
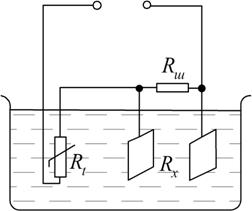
Рис. 7.6. Схема кондуктометричної комірки з терморезистивним перетворювачем
Для температурної компенсації необхідно забезпечити рівність температурних коефіцієнтів опору контрольованого розчину  і терморезистора
і терморезистора 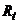 . Для цього паралельно
. Для цього паралельно  вмикають резистор
вмикають резистор 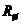 – шунт з низьким температурним коефіцієнтом опору. У зв’язку з цим температурний коефіцієнт опору паралельного кола
– шунт з низьким температурним коефіцієнтом опору. У зв’язку з цим температурний коефіцієнт опору паралельного кола 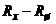 зменшується порівняно з температурним коефіцієнтом розчину і наближається до температурного коефіцієнта
зменшується порівняно з температурним коефіцієнтом розчину і наближається до температурного коефіцієнта 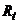 , але з протилежним знаком. Звідси, температурна компенсація зумовлена тим, що зі зміною температури, зміна опору
, але з протилежним знаком. Звідси, температурна компенсація зумовлена тим, що зі зміною температури, зміна опору 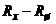 компенсується опором
компенсується опором 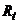 .
.
На рис. 7.7 наведено схему кондуктометра з чотириелектродною вимірювальною коміркою.
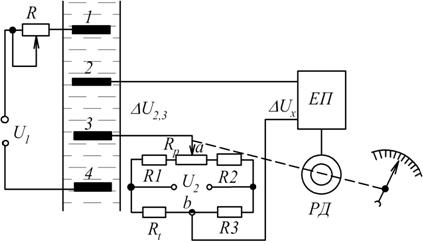
Рис. 7.7. Схема кондуктометра з чотириелектродною вимірювальною коміркою
На даній схемі струм у розчині протікає між двома зовнішніми електродами 1 і 4, які увімкнені до джерела живлення напругою 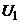 . Завдяки великому опору резистора
. Завдяки великому опору резистора 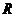 , сила струму
, сила струму  в колі комірки є постійною і не залежить від зміни опору розчину. Два внутрішні електроди 2 і 3 виконують функції потенцометричних і призначені для вимірювання спаду напруги
в колі комірки є постійною і не залежить від зміни опору розчину. Два внутрішні електроди 2 і 3 виконують функції потенцометричних і призначені для вимірювання спаду напруги 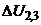 в розчині
в розчині
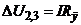 , (7.13)
, (7.13)
де 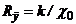 - опір розчину між електродами 2 і 3;
- опір розчину між електродами 2 і 3;  - конструктивна константа чотириелектродної вимірної комірки.
- конструктивна константа чотириелектродної вимірної комірки.
Отже
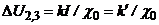 , (7.14)
, (7.14)
де 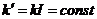 .
.
Отже різниця потенціалів між електродами 2 і 3 однозначно визначається концентрацією контрольованого розчину.
Вимірювана величина 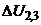 порівнюється з різницею потенціалів
порівнюється з різницею потенціалів 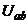 на вершинах
на вершинах  і
і  вимірювального мосту. Якщо
вимірювального мосту. Якщо 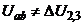 , то на вхід підсилювача ЕП надходить сигнал розбалансу
, то на вхід підсилювача ЕП надходить сигнал розбалансу 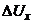 (
( 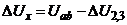 ), який після підсилення надходить до реверсивного двигуна РД. Останній зумовлює одночасне переміщення повзунка змінного резистора
), який після підсилення надходить до реверсивного двигуна РД. Останній зумовлює одночасне переміщення повзунка змінного резистора  і повертання стрілки відносно шкали, яка показує величину концентрації. Коли
і повертання стрілки відносно шкали, яка показує величину концентрації. Коли 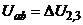 , то струм в колі електродів 2 і 3 буде відсутнім
, то струм в колі електродів 2 і 3 буде відсутнім 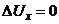 і стрілка зупиниться.
і стрілка зупиниться.
Автоматичну компенсацію температури здійснюють за допомогою терморезистора 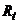 , який увімкнено в одне з плечей вимірювального мосту.
, який увімкнено в одне з плечей вимірювального мосту.
При зміні температури розчину, змінюється 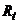 , в результаті чого
, в результаті чого 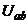 також змінюється. Приріст
також змінюється. Приріст 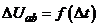 при зміні
при зміні 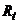 повинен дорівнювати
повинен дорівнювати 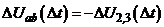 . Ця рівність досягається підбором опорів
. Ця рівність досягається підбором опорів 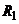 ,
, 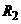 і
і 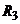 вимірювального мосту і напругою
вимірювального мосту і напругою  .
.
- Безконтактні низькочастотні кондуктометри
Особливістю таких приладів є відсутність гальванічного контакту електродів вимірювальної комірки з аналізованим середовищем (рис.7.8).
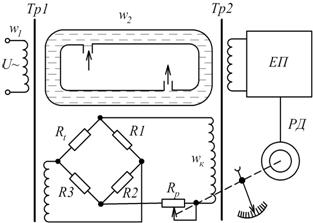
Рис. 7.8. Принципова схема низькочастотного кондуктометра з рідинним контуром зв’язку
На схемі, трубка виконана з діелектрика утворює замкнений виток, який заповнено контрольованим розчином електроліту. Зовні, на трубку намотано обмотки двох трансформаторів – збуджуючого 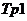 і вимірювального
і вимірювального 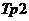 . Первинна обмотка
. Первинна обмотка 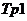 під’єднана до джерела змінного струму, напругою
під’єднана до джерела змінного струму, напругою  . Замкнений виток з електролітом виконує функцію вторинної обмотки трансформатора
. Замкнений виток з електролітом виконує функцію вторинної обмотки трансформатора 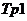 . В результаті електромагнітної взаємодії в рідинному витку наводиться ЕРС
. В результаті електромагнітної взаємодії в рідинному витку наводиться ЕРС 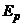
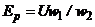 , (7.15)
, (7.15)
де  - кількість витків первинної обмотки трансформатора
- кількість витків первинної обмотки трансформатора 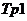 ;
; 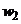 - рідинний виток (
- рідинний виток ( 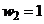 );
);  - напруга живлення первинної обмотки трансформатора
- напруга живлення первинної обмотки трансформатора 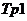 .
.
Сила струму 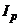 , який протікає в рідині під дією ЕРС дорівнює
, який протікає в рідині під дією ЕРС дорівнює
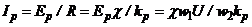 , (7.16)
, (7.16)
де 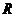 - опір рідинного витка;
- опір рідинного витка; 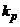 - константа низькочастотної комірки.
- константа низькочастотної комірки.
У виразі (7.16) усі величини крім 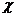 є постійними, тому
є постійними, тому 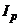 пропорційний концентрації розчину.
пропорційний концентрації розчину.
Струм 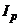 вимірюється трансформатором
вимірюється трансформатором 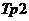 , у якого рідинний виток є первинною обмоткою. ЕРС
, у якого рідинний виток є первинною обмоткою. ЕРС 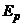 у вторинній обмотці пропорційна концентрації.
у вторинній обмотці пропорційна концентрації.
Умова компенсації запишеться 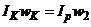 . Оскільки
. Оскільки 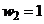 , то
, то 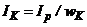 . Положення движка реохорда і стрілки приладу пропорційне концентрації контрольованого розчину. Для компенсації температурної похибки призначений терморезистор
. Положення движка реохорда і стрілки приладу пропорційне концентрації контрольованого розчину. Для компенсації температурної похибки призначений терморезистор 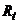 , який увімкнений в мостову коректуючу ланку
, який увімкнений в мостову коректуючу ланку 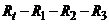 і знаходиться в контрольованому середовищі.
і знаходиться в контрольованому середовищі.
Безконтактні низькочастотні кондуктометри частотою до 1000 Гц застосовуються для вимірювання концентрації як сильних електролітів ( 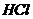 ,
, 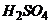 ,
, 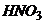 , луги), так і слабких.
, луги), так і слабких.
Широко також застосовуються безконтактні високочастотні кондуктометри.
- Потенціометричний метод аналізу
Метод потенціометричного вимірювання концентрації іонів в розчині грунтується на вимірюванні різниці електричних потенціалів двох спеціальних електродів, які поміщені в досліджуваний розчин гальванічної комірки. Причому один електрод – допоміжний, в процесі вимірювання має постійний потенціал, а потенціал іншого залежить від концентрації іонів.
Сигнал гальванічної комірки (різниця потенціалів), як зазначалось, зв’язяний з величиною рН лінійно, а сама ця величина є мірою активної концентрації рідини.
За принципом дії рН-метри на основі потенціометричного вимірювання концентрації іонів можна розділити на три основні групи: прилади з безпосереднім відліком, прилади з астатичною компенсацією, прилади зі статичною компенсацією.
Найпростіша принципова схема рН-метра з безпосереднім відліком наведена на рис. 7.9.
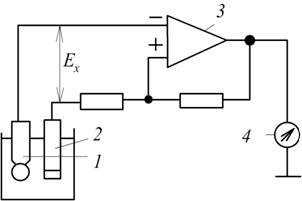
Рис. 7.9. Принципова схема рН-метра з безпосереднім відліком:
1, 2 – відповідно скляний і допоміжний електроди; 3 – операційний підсилювач; 4 – вимірювальний прилад або цифроаналоговий перетворювач
ЕРС 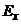 вимірювальної комірки, яка залежить від концентрації с розчину і знімається з електродів 1 і 2, подається на вхід операційного підсилювача 3 постійного струму, охопленого від’ємним зворотнім зв’язком. На виході підсилювача знаходиться вимірювальний прилад 4, який і показує величину концентрації.
вимірювальної комірки, яка залежить від концентрації с розчину і знімається з електродів 1 і 2, подається на вхід операційного підсилювача 3 постійного струму, охопленого від’ємним зворотнім зв’язком. На виході підсилювача знаходиться вимірювальний прилад 4, який і показує величину концентрації.
Прилади з безпосереднім відліком досить прості. За точністю вони поступаються приладам компенсаційного типу.
Найпростіший рН-метр компенсаційного типу наведено на рис. 7.10.
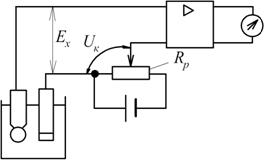
Рис. 7.10. Принципова схема рН-метра з ручною компенсацією
вимірюваної ЕРС
В цьому приладі застосовують метод астатичної компенсації, коли послідовно з ЕРС електродної системи увімкнено рівну їй по величині і протилежну за знаком напругу компенсації 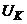 , яка знімається з компенсуючого резистора
, яка знімається з компенсуючого резистора  або лабораторного потенціометра. Змінюючи за допомогою переміщення движка реохорда напругу
або лабораторного потенціометра. Змінюючи за допомогою переміщення движка реохорда напругу 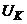 , досягають того, щоб вихідний сигнал підсилювача був таким же, як і при нульовому сигналі на вході. При цьому
, досягають того, щоб вихідний сигнал підсилювача був таким же, як і при нульовому сигналі на вході. При цьому 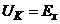 . Шкала
. Шкала  проградуйована в одиницях рН.
проградуйована в одиницях рН.
Прилад, схема якого наведена на рис. 7.11, а відрізняється від аналогічного рН-метра, що працює за методом «ручної компенсації» тим, що движок реохорда будучи механічно зв’язаним з показчиком шкали, приводиться у рух реверсивним двигуном.
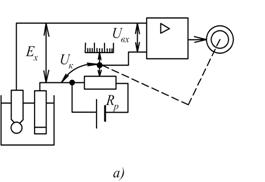
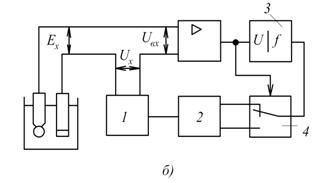
Рис. 7.11. Схема рН-метрів з автоматичною компенсацією вимірюваної ЕРС
В момент компенсації, коли 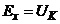 , напруга на вході
, напруга на вході 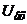 підсилювача дорівнює нулю і реверсивний двигун, а значить і показчик зупиняються.
підсилювача дорівнює нулю і реверсивний двигун, а значить і показчик зупиняються.
Недоліком таких приладів є складність кінематичної схеми для привода движка реохорда.
Цей недолік відсутній у схемі рН-метра показаного на рис.7.11,б.
Тут компенсаційна напруга створюється цифро-аналоговим перетворювачем (ЦАП) 1, керованим реверсивним лічильником 2. Якщо вхідна напруга підсилювача 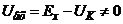 , то підсилена напруга перетворюється в серію імпульсів частотою
, то підсилена напруга перетворюється в серію імпульсів частотою 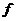 (в перетворювачі 3), які через перемикач 4 надходять, залежно від полярності вихідної напруги підсилювача, до сумуючого або віднімаючого входу реверсивного лічильника 2. В момент компенсації, коли
(в перетворювачі 3), які через перемикач 4 надходять, залежно від полярності вихідної напруги підсилювача, до сумуючого або віднімаючого входу реверсивного лічильника 2. В момент компенсації, коли 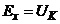 напруга на виході підсилювача дорівнює нулю, імпульси на реверсивний лічильник 2 не надходять, а на виході ЦАП встановлюється постійна напруга
напруга на виході підсилювача дорівнює нулю, імпульси на реверсивний лічильник 2 не надходять, а на виході ЦАП встановлюється постійна напруга 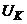 .
.
Поряд з приладами з астатичною компенсацією (повна компенсація ЕРС), застосовують рН-метри зі статичною (неповною компенсацією) вимірювальної комірки.
Принципова схема такого рН-метра наведена на рис.7.12.
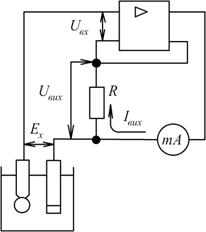
Рис. 7.12. Схема рН-метра зі статичною компенсацією
Тут вимірювана ЕРС 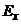 порівнюється з напругою
порівнюється з напругою  , яка утворюється від протікання вихідного струму
, яка утворюється від протікання вихідного струму 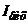 підсилювача по резистору
підсилювача по резистору 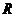 . На вхід підсилювача надходить різниця напруг
. На вхід підсилювача надходить різниця напруг
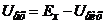 . (7.17)
. (7.17)
Якщо повний коефіцієнт підсилення 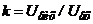 , то вираз (7.17) приводиться до виду
, то вираз (7.17) приводиться до виду 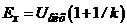 . При великому
. При великому 
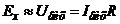 . (7.18)
. (7.18)
Отже сила струму, що протікає через останній каскад підсилювача пропорційна вхідному сигналу від вимірювальної комірки. Вимірявши 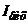 , легко знайти
, легко знайти 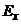 , тобто рН розчину.
, тобто рН розчину.
- Полярографічний метод
Полярографічний метод було розроблено в 1922 році чешським вченим Я.Габровським. Назву метод отримав у відповідності з кривими сила струму – напруга, які також називаються полярограмами.
Найпростіша схема полярографа (рис.7.13) складається з вимірювальної комірки, яка містить в собі електролізер 1, два електроди і аналізований розчин, посудину 2 з ртуттю, з якої вона гнучкою трубкою подається у вимірювальний електрод комірки, прилад для вимірювання сили струму 3, реостат 4, джерело напруги 5 і прилад 6 для вимірювання напруги.
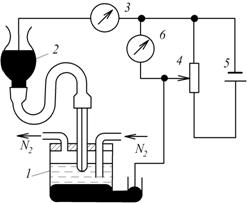
Рис. 7.13. Схема класичного полярографа
Джерело напруги забезпечує зміну потенціалу вимірювального електроду в межах від +1 до -4 В.
Полярограма однокомпонентного розчину (рис.7.14) складається з трьох характерних ділянок: І – залишкова сила струму, ІІ – хвиля і ІІІ – гранична сила струму.
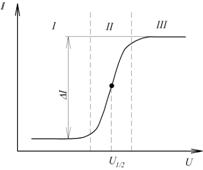
Рис. 7.14. Полярограма однокомпонентного розчину
Різниця граничної і залишкової сили струму 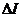 , іншими словами висота хвилі пропорційна концентрації розчину, а напруга, яка відповідає середній точці хвилі
, іншими словами висота хвилі пропорційна концентрації розчину, а напруга, яка відповідає середній точці хвилі 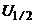 полярограми характеризує природу речовини. Цю напругу називають напругою півхвилі. Отже полярограма містить повну інформацію про якість і кількість речовини в розчині. Якщо в розчині є кілька речовин, то полярограма має вигляд, показаний на рис. 7.15.
полярограми характеризує природу речовини. Цю напругу називають напругою півхвилі. Отже полярограма містить повну інформацію про якість і кількість речовини в розчині. Якщо в розчині є кілька речовин, то полярограма має вигляд, показаний на рис. 7.15.
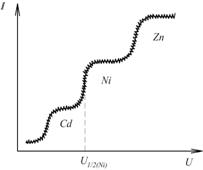
Рис. 7.15. Полярограма трикомпонентного розчину
Напруги півхвиль різних речовин наведено у відповідних довідниках. Порівняння цих даних з експериментально отриманими дозволяє встановити природу аналізованої речовини.
Основними характеристиками полярографа є межа визначення і роздільна здатність.
Під межею визначення в полярографії розуміють мінімальну концентрацію, яку прилад дозволяє визначити з заданою точністю.
Під роздільною здатністю розуміють відношення концентрацій супутнього (заважаючого) і аналізованого компонентів.
Полярографи класифікують за зміною напруги на комірці в часі: класичні, змінного струму, імпульсні, високочастотні, осцилографічні.
- Класичні полярографи
З допомогою полярографа, показаного на рис.7.13, можна отримати полярограму класичного типу (рис.7.14). В класичній полярографії на комірку накладається повільно змінна поляризуюча напруга.
Розглянемо явища, що проходять на ртутно-крапельному електроді.
Нехай до ртутного дна прикладено плюс джерела напруги, а до ртутної краплі – мінус. Розчином є електроліт, який містить в собі іони аналізованої речовини (рис.7.16).
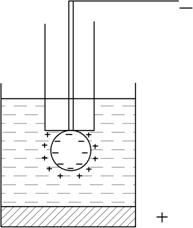
Рис. 7.16. Полярографічна комірка
В цьому випадку позитивно заряджені іони розчину підійдуть до негативно зарядженої поверхні краплі і утворять прошарок позитивно заряджених іонів навколо краплі. Цей подвійний електричний шар представляє собою своєрідний конденсатор, одною обкладкою якого служить заряджена поверхня електрода, а другою – шар іонів, які знаходяться в приелектродній області. Ртутно-крапельний електрод можна розглядати як конденсатор зі змінною поверхнею. Тому, коли на комірку накладають змінну напругу, по ній тече ємнісний струм 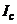 , який залежить від змінного складу розчину.
, який залежить від змінного складу розчину.
Наявність залишкової сили труму пояснюється протіканням через комірку ємнісного струму. Коли лінійно зростаюча напруга дорівнюватиме напрузі, при якій аналізована речовина починає відновлюватись на поверхні краплі, тоді через комірку протікатиме струм, який зв’язаний з електрохімічною реакцією на поверхні ртуті. В результаті розряду іонів аналізованої речовини, їх концентрація поблизу поверхні краплі зменшується. Остання поповнюється за рахунок дифузії іонів із розчину.
При напрузі 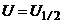 середнє значення струму
середнє значення струму 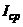 дорівнюватиме половині граничного струму
дорівнюватиме половині граничного струму  (
( 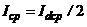 ).
).
Напруга півхвилі не залежить від концентрації аналізованої речовини, а визначається, в основному, природою досліджуваної речовини.
- Полярографи змінного струму
Полярографам змінного струму притаманним є низка переваг, зокрема зручність для дослідження кінетики електрохімічних процесів та можливість застосування в якості аналізаторів неперервної дії.
В полярографах змінного струму на комірки діє сумарна напруга від двох джерел: джерела постійної поляризуючої напруги 1 і джерела змінної напруги 2 (рис. 7.17).
Нехай в даному випадку застосовано звичайну полярографічну комірку (рис. 7.13), в якій неполяризованим електродом служить «ртутне дно», а поляризованим – «ртутно-крапельний електрод». Нехай в комірці знаходиться розчин з однією аналізованою речовиною. При дії сумарної напруги через комірку протікатиме результуючий струм 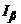 , який дорівнюватиме
, який дорівнюватиме
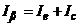 , (7.19)
, (7.19)
де  - електролітична складова, яка зумовлена реакцією відновлення іонів аналізованої речовини;
- електролітична складова, яка зумовлена реакцією відновлення іонів аналізованої речовини; 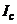 - ємнісна складова, яка зумовлена ємністю подвійного електричного шару.
- ємнісна складова, яка зумовлена ємністю подвійного електричного шару.
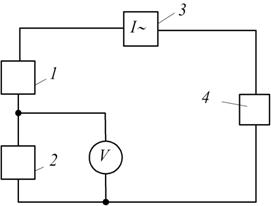
Рис. 7.17. Принципова схема полярографа змінного струму:
1 і 2 – відповідно генератор постійної і змінної напруги; 3 – вимірювач змінної складової сили струму; 4 – комірка
Силу електричного струму  можна представити у вигляді суми постійної
можна представити у вигляді суми постійної 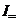 та змінної
та змінної 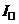 складових
складових
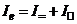 . (7.20)
. (7.20)
В якості корисної (інформативної) складової в полярографах змінного струму використовують змінну складову ( 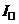 ), а постійна складова (
), а постійна складова ( 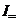 ) є завадою. В якості змінної напруги використовують: синусоїдну, прямокутну і трапецевидну.
) є завадою. В якості змінної напруги використовують: синусоїдну, прямокутну і трапецевидну.
Амплітуда змінного струму  залежить від поляризуючої напруги
залежить від поляризуючої напруги  на комірку (
на комірку ( 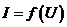 ). Залежність амплітуди змінного електролітичного струму від постійної напруги на комірці називається полярограмою змінного струму.
). Залежність амплітуди змінного електролітичного струму від постійної напруги на комірці називається полярограмою змінного струму.
Для цього випадку при 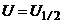 полярограма має максимум (рис.7.18, а).
полярограма має максимум (рис.7.18, а).
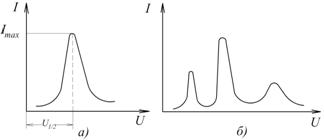
Рис. 7.18. Полярограми змінного струму для однокомпонентного (а) і багатокомпонентного (б) розчинів
Якщо розчин є багатокомпонентним, то полярограма матиме кілька максимумів (рис. 7.18,б). Ордината максимуму пропорційна концентрації, а відповідна цьому максимуму напруга характеризує природу речовини.
На рис.7.19 наведено еквівалентну електричну схему комірки: 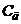 - ємність подвійного шару;
- ємність подвійного шару;  - сума послідовно увімкнених опорів розчину, капіляра, генератора та інших елементів вимірювального кола;
- сума послідовно увімкнених опорів розчину, капіляра, генератора та інших елементів вимірювального кола; 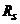 - активна і
- активна і 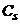 - реактивна складові комплексного опору комірки за змінним струмом.
- реактивна складові комплексного опору комірки за змінним струмом.
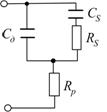
Рис. 7.19. Еквівалентна електрична схема комірки
при накладанні на неї змінної напруги
На даний час полярографічний метод аналізу є одним з найбільш чутливих і точних методів. Він дозволяє проводити як кількісний, так і якісний аналіз розчинів.
При автоматичному контролі технологічних процесів полярографія змінного струму, є однією з найбільш зручних.
- Кулонометричний метод
Кулонометричний метод оснований на вимірюванні кількості електрики чи струму під час електролізу досліджуваної речовини. Фізико-хімічною основою кулонометрії є закон Фарадея:
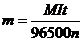 , (7.23)
, (7.23)
де 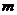 - маса виділеної речовини під час її електролізу, г;
- маса виділеної речовини під час її електролізу, г; 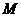 - мольна маса даної речовини;
- мольна маса даної речовини;  - сила струму, А;
- сила струму, А;  - час електролізу, с;
- час електролізу, с; 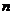 - кількість електронів, які беруть участь в окисленні чи відновленні одного моля речовини.
- кількість електронів, які беруть участь в окисленні чи відновленні одного моля речовини.
Звідси випливає, що концентрація досліджуваної речовини визначається або за значенням усталеного струму електролізу при заданому сталому потенціалі, або при сталому заданому струмі часом виділення речовини.
Кулонометричний метод застосовують для вимірювань концентрації певного компонента (водню, кисню, двоокису вуглецю, вуглеводнів, хлору, фтору тощо) в рідкому і газовому середовищі, а також для вимірювань вологості газів.
Запитання для самоконтролю
1. Кондуктометричний метод аналізу.
2. Принципова схема кондуктометра з чотириелектродною вимірювальною коміркою.
3. Принципова схема низькочастотного кондуктометра з рідинним контуром зв’язку.
4. Потенціометричний метод аналізу.
5. Принципові схеми рН-метрів з безпосереднім відліком та ручною компенсацією вимірюваної ЕРС.
6. Схеми рН-метрів з автоматичною компенсацією вимірюваної ЕРС.
7. Схема рН-метра зі статичною компенсацією.
8. Полярографічний метод. Схема класичного полярографа.
9. Полярограф змінного струму.
10. Полярограма, як інформація про природу і концентрацію розчину.
Заключення
Контроль будь-якого технологічного процесу грунтується на вимірюванні його основних параметрів або характеристик. В цьому аспекті розглянуто і описано методи і технічні засоби вимірювання різних неелектричних величин як не електричними так і електричними способами, таких як температура, геометричні розміри (лінійні та кутові, товщина шару покриття деталей, відстань між об’єктами), тиск, кількість та витрата, рівень рідких і сипучих матеріалів, а також хімічний склад розчинів.
Виходячи із можливості електричного вимірювання неелектричних величин, автори посібника вважали за доцільне представити основні відомості про вимірювання, вимірювальні перетворювачі неелектричних величин у електричні та передачу вимірювальної інформації на відстань для подальшого збору, аналізу та використання в системах автоматизації.
Література
| 1. | Виглеб Г. Датчики: устройство и применение /Пер. с нем.– М.: Мир, 1989.– 196 с. |
| 2. | Головко Д.Б., Рего К.Г., Скрипник Ю.О. Основи метрології та вимірювань. – К.: Либідь, 2001. – 248 с. |
| 3. | Готра З.Ю., Ильницкий Л.Я., Полищук Е.С. и др. Датчики: Справочник /Под ред. З.Ю. Готры и О.И. Чайковского.– Львов: Каменяр, 1995.– 312 с. |
| 4. | Евтихеев Н.Н., Купершмидт Я.А. и др. Измерение электрических и неэлектрических величин.– М.: Энергоиздат, 1990.– 352 с. |
| 5. | Ким К.К., Анисимова Г.Н., В.Ю. Барборович и др. Метрология, стандартизация, сертификация и электроизмерительная техника: Учебное пособие /Под ред. К.К. Кима.– СПб.: Питер, 2006.– 368 с. |
| 6. | Кремлевский П.П. Расходомеры и счетчики количества: Справочник.– Л.: Машиностроение, 1989.– 701 с. |
| 7. | Кулаков М.В. Технологические измерения и приборы для химических производств.– М.: Машиностроение, 1983.– 424 с. |
| 8. | Левшина Е.С., Новицкий П.В. Электрические измерения физических величин. Измерительные преобразователи.– Л.: Энергоатомиздат, 1983.– 320 с. |
| 9. | Никольский Б.П., Матерова Е.А. Ионоселективные электроды.– Л.: Химия, 1980.– 240 с. |
| 10. | Парк Дж., Маккей С. Сбор данных в системах контроля и управления. Практическое руководство /Пер. с англ.– М.: ООО "Группа ИДТ", 2006.– 504 с. |
| 11. | Парк Дж., Маккей С., Райт Э. Передача данных в системах контроля и управления. Практическое руководство /Пер. с англ.– М.: ООО "Группа ИДТ", 2007.– 480 с. |
| 12. | Полищук Е.С. Измерительные преобразователи.– К.: Вища школа, 1981.– 296 с. |
| 13. | Поліщук Є.С. Методи та засоби вимірювань неелектричних величин. – Львів. – 2000. – 360 с. |
| 14. | Поліщук Є.С., Дорожовець М.М., Яцук В.О. та ін.. Метрологія та вимірювальна техніка (за ред. Є. Поліщука). – Львів: Бескид БІТ, 2003. – 544 с. |
| 15. | Спектор С.А. Электрические измерения физических величин. Методы измерений.– Л.: Энергоатомиздат, 1987.– 320 с. |
| 16. | Турчин А.М. Электрические измерения неелектрических величин. –М. Л.: Энергия.- 1966 – 690 с. |
| 17. | Фарзане Н.Г., Илясов Л.В., Азим-заде А.Ю. Технологические измерения и приборы. –М.: Высшая школа, 1989.– 456 с. |
| 18. | Харазов В.Г. Интегрированные системы управления технологическими процессами.– СПб: Профессия, 2009.– 592 с. |
| 19. | Электрические измерения электрических и неэлектрических величин /Под ред. Е.С. Полищука.– К.: Вища школа, 1984.– 360 с. |
Навчальне видання
Кованько Володимир Володимирович
Древецький Володимир Володимирович
Христюк Андрій Олексійович
Загальнотехнічні вимірювання
І прилади
Навчальний посібник
Друкується в авторській редакції
Підписано до друку

Дата добавления: 2018-06-27; просмотров: 959; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
