Клеточные рецепторы, используемые пикорнавирусами
| Род | Вирус | Клеточный рецептор |
| Aphthovirus | Foot-and-mouth disease virus | Integrin (strains A12), heparin sulfate (strain O1) |
| Cardiovirus | Encephalomyocarditis virus | VCAM-1 |
| Enterovirus | Coxsackievirus B1-6 Poliovirus 1-3 Major rhinovirus group Minor rhinovirus group | CAR, DAF (CD55) CD155 (Pvr) ICAM-1 VLDL-R |
| Hepatovirus | Hepatitis A virus | HAVcr-1 |
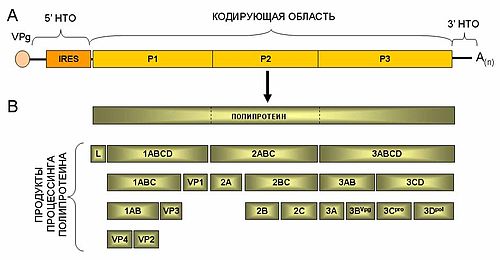
Геном пикорнавируса

Ø Регион P1 кодирует структурные полипептиды;
Ø Регионы Р2 и Р3 кодируют неструктурные белки, связанные с репликацией.
Ø L является дополнительным N-терминальным лидерным белком и в некоторых родах представляют собой как папаин-цистеин протеиназу (роды aphthovirus, erbovirus) или выполняют другие функции.
Общая схема строения геномной РНК (A) и процессинга полипротеина пикорнавирусов (B).
ü VPg-затравка для репликации;
ü 5’-НТО – трансляция с IRES, сайт посадки фактором для вирусной репликации;
ü L-лидерный белок (отсутствует у энтеровирусов, пареховирусов и гепатовирусов);
ü Неструктурные белки (NS) – процессинг полипротеина, выключение трансляции хозяйских белков, репликация РНК, перестройка клеточной мембраны;
ü 3’-НТО – сайт посадки факторов для вирусной репликации, стабильность РНК;
ü Поли-А – поддержание стабильности РНК, сайт связывания PABP, уридилирование VPg.
IRES пикорнавирусов
ü IRES (Internalribosomeentrysite) – внутреннийсайтпосадкирибосомы
ü Общие особенности: выраженная вторичная структура РНК, несколько AUG-кодонов, пиримидин-богатый участок;
ü IRES есть не только у пикорнавирусов, но и у флавивирусов, герпесвирусов, а также в клеточных мРНК (FGF, PDGF, VEGF, p53, bcl-2, eIFG, c-myc).
|
|
|

Общие сведения про IRES:
Согласно сканирующей модели инициации трансляции, рибосомальная субъединица может присоединяться исключительно к 5'-концу мРНК. Более 20 лет назад были проведены эксперименты, показывающие, на примере замкнутой в кольцо бетаглобиновой мРНК, что эукариотические рибосомы не способны связываться с 5'-дистальными (внутренними) участками мРНК. Однако в природе существует большое количество активно транслирующихся мРНК, структура 5'-НТО которых исключает возможность инициации трансляции по механизму сканирования. К ним относятся РНК пикорнавирусов – например EMCV или вируса полиомиелита (полиовируса). 5'-НТО РНК этих вирусов чрезвычайно структурированы, а также содержат большое количество AUG-кодонов и терминирующих триплетов в разных рамках считывания и нуклеотидных контекстах, что полностью исключает возможность инициации трансляции на последнем AUG такой 5'-НТО. В 1988 году двумя группами было показано, что инициация трансляции РНК пикорнавирусов происходит по альтернативному механизму внутренней инициации трансляции. В этих работах впервые было продемонстрировано, что эукариотическая рибосома способна осуществлять инициацию трансляции за счет присоединения к некоторому внутреннему участку мРНК – области внутренней посадки рибосом или IRES ( Internal Ribosome Entry Site).
|
|
|
IRES пикорнавирусов
Анализ первичной и вторичной структур 5'-НТО РНК пикорнавирусов позволил разделить их на две группы. К первой относятся энтеровирусы и риновирусы, ко второй – кардио- и афтовирусы. Типичным представителем первой группы можно считать вирус полиомиелита, второй – EMCV, FMDV и вирус энцефаломиелита грызунов Тейлера TMEV (Theiler’s murine encephalomyelitis virus). Хотя внутри этих групп гомология 5'-НТО (IRES элементов) не превышает 50%, но тем не менее последовательности обладают практически идентичной вторичной структурой. Причем мутации, разрушающие основные элементы этой структуры, приводят к инактивации IRES. Картирование IRES обеих групп показало, что все они содержат на 3'-конце AUG кодон, а в 25 нуклеотидах перед ним находится протяженный полипиримидиновый тракт (рис. 5А,Б). Этот AUG используется в качестве стартового в случае IRES EMCV, TMEV и FMDV (рис. 5Б). В первой группе инициация трансляции на 3'-концевом AUG IRES происходит с очень небольшой вероятностью. Основной стартовый кодон находится на некотором расстоянии после IRES – в случае полиовируса это 160 нуклеотидов (рис. 5А). Предположительно, инициаторный комплекс достигает этого AUG, сканируя РНК. Таким образом, можно полагать, что IRES пикорнавирусов первого типа используют своеобразную комбинацию внутренней посадки рибосомы и сканирования.
|
|
|
При помощи упоминавшегося выше метода «тоу-принт» удалось выяснить, что для посадки 43S прединициаторного комплекса на IRES EMCV и образования 48S комплекса нужны те же факторы, что и для кэп-зависимой инициации трансляции, за исключением eIF4E, PABP, а также большая части eIF4G.

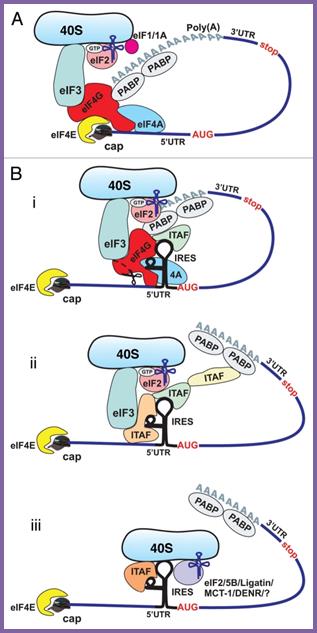

Оказалось, что для этой посадки достаточно участия eIF4А и центральной части белка eIF4G. При использовании мутантного варианта eIF4А, образующего прочный неактивный комплекс с eIF4G и блокирущего таким образом обмен связанного 4А и свободного 4А, инициации на IRES EMCV не происходит.
ЕIF2, eIF3, eIF4А, eIF4В и eIF4G могут обеспечить сборку 48S комплекса на IRES EMCV, но при этом сборка с равной вероятностью будет происходить как на природном стартовом кодоне AUG834,так и на AUG826, на котором в норме инициации трансляции не происходит. Добавление же в реакционную смесь eIF1 приводило к узнаванию именно AUG834 – «правильного» стартового кодона. Более того, eIF1 вызывал дестабилизацию комплекса на AUG826, если он уже был сформирован в отсутствие этого фактора.
|
|
|
Дальнейшие исследования показали, что центральная часть eIF4G способна специфически связываться с определенным районом IRES EMCV и это связывание необходимо для инициации трансляции.
Рентгеноструктурный анализ центрального домена eIF4G показал, что области, с которыми связываются eIF4А и элементы вторичной структуры IRES EMCV расположены рядом и даже пересекаются, что объясняет кооперативность работы факторов 4G и 4A при сборке 48S инициаторного комплекса на IRES EMCV.
Таким образом, приведенные выше данные позволили предложить модель внутренней инициации трансляции, обеспечиваемой IRES пикорнавирусов второго типа. Согласно этой модели, определенный район IRES EMCV взаимодействует с факторами 4G и 4А, которые, в свою очередь, обеспечивают связывание с 43S прединициаторным комплексом – эту же функцию они выполняют и при кэп-зависимой инициации. Далее при помощи eIF1 инициаторный комплекс устанавливается на «правильном» стартовом кодоне, и происходит сборка 80S рибосомы.
К сожалению, описанные выше опыты нельзя провести с IRES полиовируса или риновируса, поскольку эти IRES крайне неэффективно работают в бесклеточной системе. Однако активность IRES резко стимулируется при добавлении к лизату ретикулоцитов кролика «солевого смыва с рибосом» – суммы белков, отделяемых от рибосом в высокосолевом растворе. Следовательно, в инициации трансляции на этих IRES участвуют некоторые клеточные белковые факторы, отсутствующие в лизате ретикулоцитов кролика–так называемые ITAF (IRES trans acting factor). Ряд ITAF был идентифицирован при помощи сшивания ультрафиолетом IRES и различных белковых фракций:
– пиримидин-тракт связывающий белок PTB (Pyrimidine-tract binding protein;
– ITAF45;
– аутоантиген La;
– unr, unrip; – поли-С-связывающий белок – 2 (PCBP-2).
Некоторые из этих белков действительно резко стимулировали трансляцию, направляемую IRES полиовируса in vitro. Однако их роль в механизме внутренней инициации трансляции до конца еще не выяснена. Возможно, что некоторые из этих белков, связываясь с IRES, стабилизируют его пространственную структуру.

IRES I: Enterovirus
IRES II: Aphthovirus, Cardiovirus, Erbovirus, Parechovirus, Kobuvirus
IRES III: Hepatovirus
(?)IRES IV: Avihepatovirus, Sapelovirus, Senecavirus, Tremovirus
HCV-like IRES: Teschovirus (смрис. 5В)
| Cell proteins | Virus RNA binding |
| La autoantigen | PV, HRV, CVB, EMCV, FMDV |
| PCBP2 | PV, HRV, CVB, FMDV, HAV |
| Unr | PV, HRV |
| PTB | PV, HRV, CVB, EMCV, FMDV |
| TAF-45 | FMDV |
| elF-4A | EMCV |
| elF-4B | EMCV, PV, FMDV |
| elF-4E | EMCV |
| elF-4G | EMCV, FMDV |
| elF-2 | EMCV, PV |
ü IRES пикорнавирусов различаются по взаимодействию с хозяйскими факторами;
ü Для HAV требуется наличие интактного elF-4F;
ü IRES II типа не требуют наличия La-фактора
Процессинг полипротеина
ü В расщеплении VP0 на VP4 и VP2 задействован неизвестный вирусный или хозяйский фактор. У Кобувирусов и Парэховирусов VP0 остается нерасщепленным.
ü L есть у АФТО-, Кардио-, Эрбо-, Кобу-, Сенека- и Тесчовирусов, но только у Афтовирусов и Эрбовирусов он обладает протеолитической активностью.
ü 2А Гепато-, Парэхо- и Тремовирусов не обладает протеолитической активностью.
ü Афто-, Авигепато-, Кардио-, Эрбо-, Сенека- и Тесчовирусы используют стратегию рибосомального пропуска (ribosomalskipping).
Рибосомальный пропуск

Рибосомальный «пропуск» это альтернативный механизм трансляции, в котором специфический вирусный белок мешает рибосоме от ковалентного связывания нового вставленного участка (см. 4), и дает возможность дальнейшей трансляции (см. 5). Это приводит к очевидному котрансплантационному расщеплению белка (см. 6).
Этот процесс вызывается «2А-like»/CHYSEL-последовательностью (cis-actinghydrolaseelement): Asp-Val/ Ile-Glu-X-Asn-Pro-Gly↓Pro (↓ - означает расщепление в этом месте).
Рибосомальный «пропуск» наблюдается только +ssRNA и dsRNA вирусов, чьи хозяева животные, растения или насекомые.
Репликация пикорнавирусов
Репликация происходит в цитоплазме.
- Прикрепление вируса к рецепторам клетки-хозяина служит посредником эндоцитоза вируса (у разных видов разный эндоцитоз; все 3 эндоцитоза характерны для Picornaviridea).
- Капсид подвергается конформационным изменениям и высвобождает VP4, который способствует открыванию поры в «хозяйской» эндосомальной мембране и вирусная геномная РНК проникает в цитоплазму клетки-хозяина.
- Vpg отделяется от вирусной РНК, которая затем транслируется в процессинг полипротеина.
- У энтеро-, рино- и афтовирусов отключение клеточной кэп-зависимой трансляции осуществляется через расщепление факторов инициации трансляции вирусными протеазами.
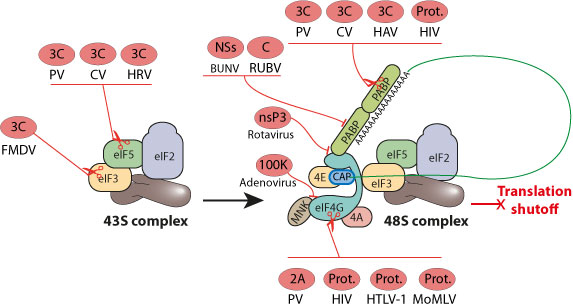
Этот глобальное ингибирование синтеза клеточных белков служит для обеспечения максимальной экспрессии вирусного генома и чтобы избежать иммунного ответа.
Все вирусы, вызывающие «закрытие» трансляции, продолжают трансляцию наименьшей части их mRNA’s, использую неканоническую трансляцию: IRES, рибосомальное «шунтирование», инициацию через Vpg.
- Репликация происходит в вирусных фабриках, сделанных из мембранных везикул, вырезанных из ER (эндопл. ретикулум). Дц РНК синтезируется из геномной (+) ssРНК.
- Геномная дцРНК транскрибируется/реплицируется, тем самым обеспечивая вирусными mRNA/новые ssRNA (+).
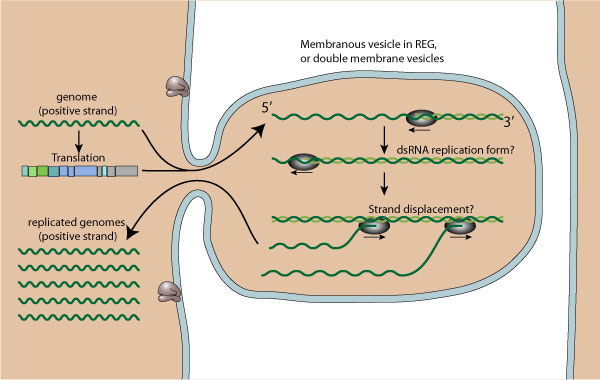
- Новая геномная РНК, как полагают, упаковывается в предварительно-собранные прокапсиды.

- Клеточный лизис и высвобождение вируса.
- Созревание провируса от неизвестной «хозяйской» протеазы.

ü VPg используется как затравка для синтеза новой РНК-цепи на комплементарной матрице.
ü Соотношение (+)(-) цепей пикорнавирусных РНК в клетке – 50/1.
ü Помимо IRES пикорнавирусы содержат на 5’-НТР элементы вторичной структуры, играющие роль в репликации РНК-геномов. Например, («клеверный лист») у Энтеровирусов или stem-loopА у Афто- и Кардиовирусов, на которые садятся клеточный белок PCBP2 и 3CD.
ü На поли-А садится PABP, и он, в свою очередь, связывается с комплексом PCBP2/3CD.
ü 3D и 2C обладают хеликазной активностью, способствуя расплетанию шпилек и элонгации цепи при репликации.
Дата добавления: 2018-06-01; просмотров: 1119; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
