Лабораторная работа Определение растворенного кислорода в воде
Наличие в воде растворенного кислорода является обязательным условием для существования большинства организмов, населяющих водоемы. Только очень немногие гидробионты, относящиеся преимущественно к бактериям и простейшим, обладают способностью к нормальной жизнедеятельности в отсутствие кислорода. В связи с этим при рыбоводных и гидробиологических исследованиях большое внимание уделяется изучению кислородного режима водоемов. Содержание растворенного в воде кислорода зависит от двух групп процессов, проходящих в водоеме: процессов, обогащающих воду кислородом и процессов, уменьшающих его содержание в воде. Кислород образуется в водоеме в результате фотосинтеза водных растений, интенсивность которого зависит от ряда факторов и, в первую очередь, от температуры и освещения. Фотосинтез происходит на сравнительно небольших глубинах, главным образом в поверхностных слоях воды, хорошо освещенных и прогретых, и является мощным источником растворенного в воде кислорода. Нередки случаи, когда в результате фотосинтеза в водоемах наблюдается значительное перенасыщение воды кислородом.
Вторым источником обогащения воды кислородом является атмосфера, кислород которой может поглощаться поверхностными слоями воды. Скорость распространения газов в воде почти в 6 тысяч раз меньше, чем в воздухе, поэтому в стоячих водоемах этот процесс идет крайне медленно. При сильном течении, ветре, разбрызгивании процесс насыщения воды кислородом значительно ускоряется.
|
|
|
Одновременно с обогащением воды кислородом идет потребление его на различные окислительные процессы: дыхание организмов, брожение и гниение различных органических веществ, находящихся в воде и почве водоемов, а также окисление неорганических соединений (марганца, железа) и соединений азота. Значительное количество растворенного в воде кислорода потребляется органическими веществами иловых отложении. Так, по данным наблюдений, проведенных на Рыбинском водохранилище, среднесуточное потребление кислорода илами составляет 380 мг/м2, а всего с мая по октябрь иловыми отложениями в этом водохранилище было потреблено 250 000 т кислорода.
На процессы дыхания водных организмов (планктона, макрофитов, бентоса, рыб) также расходуется значительное количество кислорода. С повышением температуры интенсивность дыхания водных организмов увеличивается, возрастет и потребление кислорода (табл. 1).
Таблица 1. Поглощение кислорода зоопланктоном (по Щербакову)
| Организмы | Поглощение О2 за 24 ч (в мг) на 1000 особей при температуре, °С | ||||
| 2 | 5 | 10 | 20 | 25 | |
| Циклопы (Cyclops strenus) | 1,80 | 2,47 | 3,61 | 6,97 | 10,23 |
| Дафнии(Daphnia longispina) | 1,31 | 1,40 | 2,60 | 5,36 | 6,57 |
Потребность в кислороде у отдельных видов рыб различна. Такие рыбы, как карась и линь, способны существовать при малом его содержании в воде, а у форели, кумжи и других лососевых рыб потребность в кислороде чрезвычайно велика (табл.2).
|
|
|
Таблица 2. Характеристика дыхания некоторых видов рыб (по Винбергу, Линштедту)
| Рыба | Масса, г | Потребление кислорода на 1 кг массы рыбы при 20 оС, мг/ч |
| Карп Карп Карп Карась Осетр Форель радужная | 25 250 500–700 – 12,5 202 | 413,3 177,3 120 80,1 336 524,8 |
Содержание кислорода в воде может сильно меняться в зависимости от соотношения интенсивности двух противоположно протекающих процессов: продуцирующих кислород и потребляющих его. В результате изменения температуры воды, освещенности и влияния других факторов в водоемах наблюдаются периодические сезонные и суточные колебания в содержании кислорода. Степень насыщения воды кислородом определяется его парциальным давлением в атмосфере. В зависимости от парциального давления кислорода имеет место процесс инвазии кислорода (поступления) или эвазии (выделения).
Инвазия кислорода из атмосферы происходит только через поверхность воды, и зона фотосинтеза располагается в верхнем слое, поэтому последний, как правило, более насыщен кислородом, чем нижележащие слои. В природных условиях равновесие между растворенным в воде кислородом и кислородом атмосферы достигается перемешиванием воды в результате волнения, течения, вертикальных токов воды и т. д. В озерах эвтрофного типа во время зимней и летней стагнации может наблюдаться дефицит кислорода в придонном слое, хотя поверхностные слои воды бывают хорошо насыщены кислородом.
|
|
|
Устойчивость водных организмов, в том числе и рыб, к дефициту кислорода зависит от видовой принадлежности, их состояния и от условий внешней среды (температуры, рН, концентрации СО2 и т. д.). Пороговая концентрация кислорода сильно изменяется с возрастом животных. Так, восьмидневные личинки плотвы гибнут в воде с содержанием кислорода ниже 3,45 мг/л, в возрасте 49 дней они выносят падение его концентрации до 1 мг/л, а взрослые особи даже до 0,6мг/л. Из внешних факторов на пороговую концентрацию кислорода в наибольшей степени влияет температура воды. С увеличением температуры повышается обмен, усиливается потребление кислорода, одновременно падает устойчивость к низким его концентрациям. Например, у карпа пороговая концентрация кислорода при температуре 1°С составляет 0,6 мг/л, а при 30° повышается до 1,2 мг/л. От насыщения воды кислородом зависит жизнедеятельность рыб. При падении его содержания ниже определенных границ ухудшаются условия питания рыб, снижается их рост. Так, у щуки потребление пищи при падении содержания кислорода от 7,2 до 2,6 мг/л снижается почти в 2 раза. Рост молоди Oncorhynchus kisutch (по данным тех же авторов) ясно снижается при падении содержания кислорода с 8,3 до 5 мг/л. При недостатке кислорода в воде снижается устойчивость рыб ко многим неблагоприятным факторам внешней среды, в том числе к ядам промышленных и бытовых сточных вод.
|
|
|
Содержание кислорода в воде выражают обычно в миллиграммах на литр или в миллилитрах на литр. Эта абсолютная форма выражения содержания кислорода не всегда характеризует состояние водоема при данных условиях, поэтому используют такой показатель, как относительное содержание кислорода в процентах к его равновесной концентрации, т. е. кнормальному содержанию кислорода при данных условиях. Для вычисления относительного содержания кислорода пользуются табл. 4, в которой приведено нормальное его содержание при различных температурах и нормальном атмосферном давлении.
Метод Винклера. Одним из самых старых методов, получивших широкое распространение в гидрохимической практике, является йодометрический метод Винклера, основанный на способности иона марганца Mn2+ реагировать в щелочной среде с кислородом, растворенным в воде. В ходе реакции растворенный кислород связывается и образуются водные оксиды марганца высшей валентности. В кислой среде марганец переходит в двухвалентные соединения, окисляя при этом эквивалентное связанному кислороду количество ионов иода. Выделившийся иод оттитровывают раствором гипосульфита. По его количеству, пошедшему на титрование, вычисляют содержание кислорода. Этим методом можно определить содержание растворенного кислорода с точностью ±0,05 мг/л.
Весь процесс определения кислорода основан на проведении следующих трех последовательно идущих реакций: фиксация кислорода в щелочной среде:
2МnС12 + 4NaOH = 2Mn(OH)2 + 4NaCl ; 2Мn(ОН)2 + О + Н2O = 2Мn(ОН)3
Происходит связывание растворенного кислорода с образованием гидроксида марганца (II). Осадок Мn(ОН)3 может иметь цвет от почти белого до буровато-коричневого различной интенсивности, что зависит от количества зафиксированного кислорода. выделение иода в кислой среде: 2Мn(ОН)3 + 2KI + 3H2SO4 = K2SO4 + 2MnSO4 + 6H2O + I2 .
После добавления кислоты осадок растворяется, и раствор в зависимости от количества выделившегося иода окрашивается в коричневый цвет различной интенсивности. Иодометрическое определение гипосульфитом (тиосульфатом): I2 + 2Na2S2O3 = 2NaI + Na2S4O6.
Выделившийся иод титруют раствором гипосульфита, по израсходованному количеству которого на титрование пробы рассчитывают содержание кислорода.
оборудование и реактивы.Кислородные склянки или мерные колбы с притертыми пробками емкостью 100 – 200 мл; аналитические весы; посуда емкостью на 2 литра; пипетки на 1, 10, 15, 50 мл; бюретка на 25 мл, термостат; раствор MnCl2×4H2O (210 г соли в 200 мл воды); щелочной раствор иодистого калия (15 г KI растворяют в 20 мл дистиллированной воды, 50 г NaOH в 50 мл воды); раствор серной кислоты (1:1); раствор крахмала, 0,5 %-ный (0,5 г крахмала в 100 мл воды); 0,02н. раствор Na2S2O3 (5 г соли в 1л воды).
Выполнение анализа. Точное определение количества кислорода в воде возможно при соблюдении определенных правил в процессе отбора проб воды. Пробу воды берут обязательно при помощи батометра или других приспособлений, позволяющих брать ее без перемешивания с воздухом. Из батометра воду переносят в специальные кислородные склянки (пикнометры) с притертыми пробками. При заполнении склянки водой дают возможность слиться верхнему слою воды, соприкасающемуся с воздухом. Непосредственно после пробоотбора воду помещают в мерную колбу на 200 или 250 мл (почти доверху, значительно выше метки). Затем в колбу вводят пипетками по 2мл (избыток) растворов NaOH + KI и MnCl2. Пипетку погружают каждый раз до половины склянки и по мере выливания раствора поднимают вверх. Колбу доливают исследуемой водой до самого верха и закрывают корковой пробкой так, чтобы внутри не оказалось пузырька воздуха. Несколько раз колбу переворачивают, так как перемешивание растворов с водой возможно только за счёт разницы их плотностей. Происходит реакция фиксации кислорода в воде: O2 + 4MnCl2 + 8NaOH + 2H2O→ 4 Mn(OH)3 + 8NaCl.
В результате образуются коричневые хлопья гидроксида трёхвалентного марганца. В действительности же образуются светлые хлопья гидроксида двухвалентного марганца, так как добавляется избыток реагентов: MnCl2 + 2NaOH → Mn(OH)2 + 2NaCl.
Образовавшемуся осадку дают отстояться не менее 10 мин, но не более суток. Затем сливают верхний слой раствора до метки и добавляют 4 мл (избыток) раствора H2SO4 (1:1) или концентрированной ортофосфорной кислоты (Н3РО4). Кислоту вводят осторожно, чтобы осадок не поднялся вверх. колбу закрывают пробкой, и содержимое вновь тщательно перемешивают. Происходит следующая реакция: 2Mn(OH)3 + 3H2SO4 + 2КI → K2SO4 + 2MnSO4 + 6H2O +I2.
Используя метод окислительно-восстановительного титрования, можно определить количество выделившегося иода. Для этого из мерной колбы отбирают пипеткой 50 мл раствора и переносят его в коническую колбу объемом 200 – 250 мл. Раствор титруют раствором тиосульфата натрия с молярной концентрацией эквивалента 0,01моль/л до светло-желтой окраски. Содержимое колбы во время титрования необходимо тщательно перемешивать. После того как цвет раствора станет слабо-желтым, прибавляют 1 мл свежеприготовленного раствора крахмала и окрасившийся в синий цвет раствор дотитровывают, точно улавливая момент полного обесцвечивания раствора. Если в исследуемой воде кислорода мало и цвет жидкости после растворения осадка кислотой оказался бледно-желтым, а не бурым, крахмал добавляют с самого начала титрования.
Вычисление. После проведения анализа рассчитывается сначала молярная концентрация эквивалента I2 в моль/л, а затем и содержание О2 в исследуемой воде (в мг/л и мл/л). Для этого необходимо установить зависимость между количеством выделившегося иода и исходным содержанием кислорода в воде. Учитывают все количество гипосульфита (тиосульфата натрия), пошедшее на титрование.
Содержание кислорода в воде рассчитывают по формуле
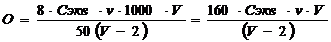 ,
,
где Cэкв – молярная концентрация эквивалента раствора тиосульфата натрия, моль/л; v – объем раствора тиосульфата натрия, пошедший на титрование, мл; V – объем склянки, в которую отбиралась проба, мл; 1000 – коэффициент перевода г в мг; 2 – объем пробы, вылившийся при фиксации растворенного кислорода, мл; 50 – объем оттитрованной пробы воды, мл; 8 – молярная масса эквивалента кислорода, г/моль.
Кроме того, можно пользоваться следующей формулой:
O2= ПК ∙0,08 ∙1000/(О–о),
где П – количество 0,01 моль/л раствора тиосульфата натрия, пошедшее на титрование пробы, мл; К– поправка на нормальность тиосульфата натрия; 0,08 – коэффициент при расчете количества кислорода; О – объем пробы, мл; о – объем прибавленных реактивов, мл; 1000 – множитель.
Пример расчета.При общем объеме раствора тиосульфата, израсходованного на титрование, равном 9,4 мл, концентрации раствора тиосульфата 0,01 моль/л и объеме кислородной склянки 102,5 мл содержание растворенного кислорода рассчитывается следующим образом:
О = 9,4∙0,01∙8∙1000 /(102,5–2,5) =7, 52 мг/л.
Оценка состояния кислородного режима определяется по шкале (табл.3).
Таблица 3. Шкала оценки кислородного режима
| Качество воды | Содержание кислорода в воде, мг/л | |
| летом | зимой | |
| Очень чистая | > 9 | > 13–14 |
| Чистая | 8–9 | 11–13 |
| Умеренно грязная | 6–8 | 9–11 |
| Загрязненная | 4–6 | 4–9 |
| Грязная | 2–4 | 0,5–4 |
| Очень грязная | 0–2 | 0–0,5 |
Для определения степени насыщения воды кислородом по табл. 4 можно определить величину концентрации насыщенного раствора кислорода в воде (Он, мг/л), исходя из температуры воды, зафиксированной в момент отбора пробы.
Таблица 4. Зависимость равновесной концентрации кислорода в воде от температуры
(атмосферное давление – 760 мм рт. ст.)
| t °С | Равновесная концентрация растворенного кислорода (в мг/л) при изменении температуры на десятые доли °С (ОH) | |||||||||
| 00 | 0,1 | 0,2 | 0,3 | 0,4 | 0,5 | 0,6 | 0,7 | 0,8 | 0,9 | |
| 0 | 14,65 | 14,61 | 14,53 | 14,49 | 14,49 | 14,45 | 14,41 | 14,37 | 14,33 | 14,29 |
| 1 | 14,25 | 14,21 | 14,13 | 14,09 | 14,09 | 14,05 | 14,02 | 13,98 | 13,94 | 13,90 |
| 2 | 13,86 | 13,82 | 13,75 | 13,71 | 13,71 | 13,68 | 13,64 | 13,60 | 13,56 | 13,53 |
| 3 | 13,49 | 13,46 | 13,38 | 13,35 | 13,35 | 13,31 | 13,28 | 13,24 | 13,20 | 13,17 |
| 4 | 13,13 | 13,10 | 13,03 | 13,00 | 13,00 | 12,96 | 12,93 | 12,89 | 12,86 | 12,82 |
| 5 | 12,79 | 12,76 | 12,69 | 12,66 | 12,66 | 12,52 | 12,59 | 12,56 | 12,53 | 12,49 |
| 6 | 12,46 | 12,43 | 12,36 | 12,33 | 12,33 | 12,30 | 12,27 | 12,24 | 12,21 | 12,18 |
| 7 | 12,14 | 12,11 | 12,05 | 12,02 | 12,02 | 11,99 | 11,96 | 11,93 | 11,90 | 11,87 |
| 8 | 11,84 | 11,81 | 11,75 | 11,72 | 11,72 | 11,70 | 11,67 | 11,64 | 11,61 | 11,58 |
| 9 | 11,55 | 11,52 | 11,47 | 11,44 | 11,44 | 11,41 | 11,38 | 11,35 | 11,33 | 11,30 |
| 10 | 11,27 | 11,24 | 11,19 | 11,16 | 11,16 | 11,14 | 11,11 | 11,08 | 11,06 | 11,03 |
| 11 | 11,00 | 10,98 | 10,93 | 10,90 | 10,90 | 10,87 | 10,85 | 11,02 | 10,80 | 10,77 |
| 12 | 10,75 | 10,72 | 10,67 | 10,65 | 10,65 | 10,62 | 10,60 | 10,57 | 10,55 | 10,52 |
| 13 | 10,50 | 10,48 | 10,43 | 10,40 | 10,40 | 10,38 | 10,36 | 10,33 | 10,31 | 10,28 |
| 14 | 10,26 | 10,24 | 10,19 | 10,17 | 10,17 | 10,15 | 10,12 | 10,10 | 10,08 | 10,06 |
| 15 | 10,03 | 10,01 | 9,97 | 9,95 | 9,95 | 9,92 | 9,90 | 9,88 | 9,86 | 9,84 |
| 16 | 9,82 | 9,79 | 9,75 | 9,73 | 9,73 | 9,71 | 9,69 | 9,67 | 9,65 | 9,63 |
| 17 | 9,61 | 9,58 | 9,54 | 9,52 | 9,52 | 9,50 | 9,48 | 9,46 | 9,44 | 9,42 |
| 18 | 9,40 | 9,38 | 9,34 | 9,32 | 9,32 | 9,30 | 9,29 | 9,27 | 9,25 | 9,23 |
| 19 | 9,21 | 9,19 | 9,15 | 9,13 | 9,13 | 9,12 | 9,10 | 9,08 | 9,06 | 9,04 |
| 20 | 9,02 | 9,00 | 8,97 | 8,95 | 8,95 | 8,93 | 8,91 | 9,00 | 8,88 | 8,86 |
| 21 | 8,84 | 8,82 | 8,79 | 8,77 | 8,77 | 8,75 | 8,74 | 8,72 | 8,70 | 8,68 |
| 22 | 8,67 | 8,65 | 8,62 | 8,60 | 8,60 | 8,58 | 8,56 | 8,55 | 8,53 | 8,52 |
| 23 | 8,50 | 8,48 | 8,45 | 8,43 | 8,43 | 8,42 | 8,40 | 8,38 | 8,37 | 8,35 |
| 24 | 8,33 | 8,32 | 8,29 | 8,27 | 8,27 | 8,25 | 8,24 | 8,22 | 8,21 | 8,19 |
| 25 | 8,18 | 8,16 | 8,13 | 8,11 | 8,11 | 8,11 | 8,08 | 8,07 | 8,05 | 8,04 |
| 26 | 8,02 | 8,01 | 7,98 | 7,96 | 7,96 | 7,95 | 7,93 | 7,92 | 7,90 | 7,89 |
| 27 | 7,87 | 7,86 | 7,83 | 7,81 | 7,81 | 7,80 | 7,78 | 7,77 | 7,75 | 7,74 |
| 28 | 7,72 | 7,71 | 7,68 | 7,66 | 7,66 | 7,65 | 7,64 | 7,62 | 7,61 | 7,59 |
| 29 | 7,58 | 7,56 | 7,54 | 7,52 | 7,52 | 7,51 | 7,49 | 7,48 | 7,47 | 7,45 |
| 30 | 7,44 | 7,42 | 7,40 | 7,38 | 7,38 | 7,37 | 7,35 | 7,34 | 7,32 | 7,31 |
Далее можно рассчитать степень насыщения воды кислородом (R) в процентах с учетом фактической величины атмосферного давления по формуле

где 100 – коэффициент пересчета единиц измерения из мг/л в %; 760 – нормальное атмосферное давление, мм рт.ст.; ОH – величина концентрации насыщенного раствора кислорода для условий отбора, определенная по табл. 4; Р – фактическая величина атмосферного давления в момент отбора пробы.
Примечание. При отсутствии данных об атмосферном давлении в момент отбора допускается его принимать равным нормальному, т. е. 760 мм рт.ст.
Пример расчета. При значениях Оpк = 7,52 мг/л, Сн = 9,82 мг/л, Р = 735 мм рт. ст. и температуре воды в момент отбора 16°С степень насыщения составляет:
R = 7, 52∙100∙760/( 9,82∙735) = 79,2 %.
При выполнении измерений концентрации РК в воде контроль точности необходимо проводить по поверенному (образцовому) оксиметру.
Дата добавления: 2018-06-01; просмотров: 2340; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
