Химическое равновесие. Константа равновесия. Сдвиг равновесия. Принцип Ле-Шателье.
Химическое равновесие – это такое состояние системы, при котором скорости прямой и обратной реакций равны.
Для обратимой реакции mA + nB⇄ pC + qD 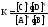 Константа химического равновесия зависит от природы реагирующих веществ и от температуры.
Константа химического равновесия зависит от природы реагирующих веществ и от температуры.
Изменение внешних условий (концентрации, температуры, давления) вызывает смещение химического равновесия в системе и переход ее в новое равновесное состояние.
Направление смещения химического равновесия определяется принципом ЛеШателье: если на систему, находящуюся в состоянии химического равновесия, производить какое-либо внешнее воздействие (изменять концентрацию, температуру, давление), то в этой системе самопроизвольно возникают процессы, стремящиеся ослабить произведенное воздействие.
Повышение концентрации одного из исходных реагентов сдвигает равновесие вправо (усиливается прямая реакция); повышение концентрации продуктов реакция смещает равновесие влево (усиливается обратная реакция).
Если реакция протекает с увеличением числа молекул газа (т.е. в правой части уравнения реакции суммарное число молекул газов больше, чем число молекул газообразных веществ в левой части), то повышение давления препятствует реакции, а уменьшение давления – благоприятствует реакции.
При повышении температуры равновесие смещается в сторону эндотермической реакции, а при понижении – в направлении экзотермической реакции.
|
|
|
Катализатор изменяет в одинаковое число раз как скорость прямой, так и обратной реакции. Поэтому катализатор не вызывает сдвиг равновесия, а лишь сокращает или увеличивает время, необходимое для достижения равновесия
Растворы.
Растворимость.
Под растворимостью понимают концентрацию растворенного вещества в насыщенном растворе.
Растворимость выражают в тех же единицах, что и концентрацию. Часто используют коэффициент растворимости s, равный массе растворенного вещества (г) в насыщенном растворе, содержащем 100 г растворителя.
Насыщенным называют раствор, который находится в равновесии с избытком растворяемого вещества (DGр-ния=0). Насыщенный раствор имеет максимально возможную в данных условиях концентрацию.
Растворимость зависит:
- от природы растворенного вещества и растворителя;
- от температуры;
- от давления;
- от присутствия третьих компонентов.
Влияние природы компонентов на растворимость определяется принципом: подобное растворяется в подобном. Полярные растворители, например, вода, хорошо растворяют вещества с ионной связью (неорганические соли, кислоты и основания). Хорошей растворимостью в воде обладают полярные органические соединения, образующие с молекулами растворителя водородные связи (спирты, карбоновые кислоты, амины). Неполярные растворители, например, углеводороды, растворяют неполярные и малополярные соединения (жиры).
|
|
|
Влияние температуры на растворимость зависит от теплового эффекта растворения и определяется принципом ЛеШателье. Повышению растворимости газов способствует понижение температуры, так как растворение газов – процесс экзотермический. Растворимость большинства твердых веществ и жидкостей - процесс эндотермический и возрастает при повышении температуры.
Влияние давления существенно только в том случае, если при растворении происходит значительное изменение объема системы, что наблюдается при растворении газов в жидкостях. Растворимость газов растет с увеличением давления, так как сопровождается уменьшением объема системы.
Закон Генри:
Дата добавления: 2018-06-27; просмотров: 376; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
