Вопрос №13 Периодичность изменения свойств элементов:
А) радиус атомов и ионов
Радиусы электронейтральных атомов с увеличением порядкового номера изменяются периодически: в периодах с возрастанием заряда ядра при одинаковом количестве элементов уменьшается. В группах атомный радиус увеличивается, но для главных подгрупп(s-р элементов) идет закономерное увеличение радиуса, а в побочных подгруппах идет то же увеличение, но после периода радиус практически не меняется за счет экранирования лантаноидами.
Б) энергия ионизации и ионизационный потенциал
Это энергия, которуб необходимо затратить чтобы удалить электрон с его нормального уровня на бесконечно далекий уровень и выражается в кДж/моль или эВ(электронвольт)
В) сродство к электрону
Это энергия, которая выделяется или поглощается при присоединении к электронейтральному атому электрона образуя отрицательнуюзастицу.
Г) электроотрицательность
Это способность атома притягивать к себе общую электронную пару при образовании химический связи.
Электроотрицательность алгебраически представляется
Э.О. = 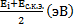
Еi – Энергия ионизации
Ес.к.э. – Энергия сродства к электрону
Существует около 20 шкал элеткроотрицательности. Чаще всего используется шкала Полинга. Для удобства используют относительнуюэлектроотрицательность. Самый электроотрицательный – Фтор(4 эВ)
| H(2,1) | ||||||
| Li(1,0) | Be(1,5) | B(2,0) | C(2,5) | N(3,0) | O(3,5) | F(4) |
| Na(0,9) | Mg(1,2) | Ae(1,5) | Si(1,8) | P(2,1) | S(2,5) | Сi(3,0) |
| K(0,8) | Ca1,0 | Se(1,3) | Ti(1,6) | As(2,0) | Se(2,4) | Br(2,8) |
|
|
|
Д) окислительно-восстановительные способности
По периоду слева направо окислительные св-ваувеличиваются а восстановительные св-ва уменьшаются.
По группам окислительные св-вауменьшаются а восстановительные св-ва увеличиваются.
Окислительная способность – способность присоединять электроны понижая степень окисления.
Восстановительная способность – способность отдавать электроны повышая степень окисления.
Виды химической связи
Химическая связь - это взаимное сцепление атомов в молекуле и кристаллической решётке в результате действия между атомами электрических сил притяжения.




Основные характеристики химической связи, энергия и длина связи.
Химическая связь характеризуется длиной, энергией, направленностью и насыщаемостью (каждый атом способен образовать ограниченное число связей). Кратность связи равна числу общих электронных пар. Форма молекул определяется типом электронных облаков, участвующих в образовании связи, а также фактом наличия или отсутствия неподеленных электронных пар.
|
|
|
Энергия связи – это энергия, необходимая для разрыва химической реакции. Энергия разрыва и образования связи равны по величине но противоположны по знаку. Чем больше энергия химической связи, тем устойчивее молекула. Обычно энергию связи измеряют в кДж/моль.
Для многоатомных соединений с однотипными связями за энергию связи принимается среднее ее значение, рассчитанное делением энергии образования соединения из атомов на число связей. Так, на разрыв связи H–H затрачивается 432,1 кДж/∙моль, а на разрыв четырех связей в молекуле метана CH4 – 1648 кДж/∙моль и в этом случае EC–H = 1648 : 4 = 412 кДж/моль.
Длина связи – это расстоянию между ядрами взаимодействующих атомов в молекуле. Измеряется в нм или А (ангстрем=10-8 см). Она зависит от размеров электронных оболочек и степени их перекрывания.
Ионная связь.

Полярность связи
Полярность связи – это распределение электрического заряда между атомами образовавшими химическую связь. Для определения полярности связи надо сравнить электоотрицательности атомов, участвовавших в образовании связи. Если электроотрицательностиодинаковы, то связь будет неполярная, а в случае разных электроотрицательностей – полярной. Крайний случай полярной связи, когда общая электронная пара практически полностью смещена к более электроотрицательному элементу, приводит к ионной связи.
|
|
|
Например: Н–Н – неполярная, Н–Сl – полярная и Nа+–Сl- – ионная.
Смещением электронной пары к более электроотрицательному атому приводит к образованию диполя. Диполь – система из двух равных, но противоположных по знаку зарядов, находящихся по разным сторонам связи.
Полярность молекулы – это векторная сумма дипольных моментов всех связей молекулы. Следует различать полярности отдельных связей и полярность молекулы в целом.
Например, линейная молекула CO2 (О=С=О) неполярна, так как дипольные моменты полярных связей С=О компенсируют друг друга. Полярность молекулы воды означает, что она нелинейна, то есть дипольные моменты двух связей О—Н не компенсируют друг друга, так как расположены под углом, не равным 180°.
Пространственное строение молекул – форма и расположение в пространстве электронных облаков.
В соединениях, содержащих более двух атомов, важной характеристикой является валентный угол, образуемый химическими связями в молекуле и отражающий ее геометрию.
|
|
|
Метод валентных связей.
Метод валентных связей (локализованных электронных пар) предполагает, что каждая пара атомов в молекуле удерживается вместе при помощи одной или нескольких общих электронных пар. Поэтому химическая связь представляется двухэлектронной и двухцентровой, т.е. локализована между двумя атомами. В структурных формулах соединений обозначается черточкой:
H-Cl, H-H, H-O-H
Рассмотрим в свете Метода ВС, такие особенности связи, как насыщаемость, направленность и поляризуемость.
Валентностьатома — определяется числом неспаренных (валентных) электронов, способных принять участие в образовании химической связи. Валентность выражается небольшими целыми числами и равна числу ковалентных связей. Валентность элементов, проявляющуюся в ковалентных соединениях, часто называют ковалентностью. Некоторые атомы имеют переменную валентность, например углерод в основном состоянии имеет 2 неспаренных электрона и будет двух валентен. При возбуждении атома, возможно распарить другие два спаренных электрона и тогда атом углерода станет четырех валентен:
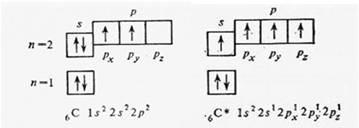
электронное строение атома углерода
Возбуждение атома до нового валентного состояния требует затраты энергии, которая компенсируется выделяемой при образовании связей энергией.
!!!19!!!!
20-21.σ-, π-, δ- связи. Кратные связи. Делокализация связи.
АО-атомныеорбитали



ВС-валентных связей

Дата добавления: 2018-06-27; просмотров: 340; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
