Электрические процессы на мембране
3.1. Мембранный потенциал (потенциал покоя)
3.2. Потенциал действия
Мембранный потенциал (потенциал покоя)
С помощью электрофизиологических исследований было доказано, что внутри и снаружи клеточная мембрана заряжена разноимённо. Установлено, что в состоянии физиологического покоя, на наружной поверхности мембраны имеется положительный заряд, а на внутренней поверхности – отрицательный. Следовательно, на мембране существует разность потенциалов, которая возникает по причине неодинаковости концентраций катионов и анионов внутри и вне клетки (табл. 3). Величина потенциала покоя относительно стабильна, у разных клеток варьирует в среднем в пределах от -30 до -90 мВ.
Таблица 3
Внутри- и внеклеточные концентрации ионов (ммоль/л) в мышечных клетках теплокровных животных
| Концентрации Ионы | Внутриклеточная концентрация | Внеклеточная концентрация |
| Na+ | 12 | 145 |
| K+ | 155 | 4 |
| Ca2+ | 7-10 | 2 |
| Cl- | 4 | 120-130 |
| HCO3- | 8 | 27 |
| Анионы высокомолекулярных органических соединений | 155 | - |
| Прочие катионы | Менее 1 | 5 |
Концентрация К+ для вне- и внутриклеточной среды электровозбудимых клеток разнится в 30-40 крат. Если в уравнение Нернста подставить в константы, то при нормальной температуре тела (T=36,6 С0 или 310 К0) можно легко подсчитать равновесный потенциал, например, для одного из самых важных потенциалобразующих ионов при формировании мембранного потенциала покоя – иона К+. Например, если разница в концентрациях внешнего и внутреннего К+ составит 39, то равновесный потенциал по К+ будет:
|
|
|
Ек= -61мВ∙log39 = -61мВ∙1,59 = -97мВ
 Однако в эксперименте мембранный потенциал отличается от равновесного потенциала по калию. Какой же вклад вносят другие ионы в величину мембранного потенциала? Почему возникает равновесное состояние с неравномерным распределением ионов и заряда по разные стороны клеточной мембраны?
Однако в эксперименте мембранный потенциал отличается от равновесного потенциала по калию. Какой же вклад вносят другие ионы в величину мембранного потенциала? Почему возникает равновесное состояние с неравномерным распределением ионов и заряда по разные стороны клеточной мембраны?
Чтобы ответить на эти вопросы необходимо вспомнить об исследованиях английского физико-химика Фредерика Джоржа Доннана (1911). Его основные работы посвящены изучению растворов и коллоидных систем. Если рассматривать клеточную
мембрану как фазовый раздел сред, содержащих ионы с
Ф. Доннан неодинаковой проницаемостью, то термодинамическим
условием равновесия ионов по разные стороны мембраны является равенство произведений концентрации катионов и анионов по обе стороны мембраны. Основную роль в создании такого равновесия играют ионы K+ и высокомолекулярные внутриклеточные анионы. Мембрана клетки не проницаема для органических внутриклеточных анионов, в частности анионов аспаргиновой, гистаминовой и других аминокислот. Органические соединения в силу своего большого молекулярного веса не в силах выйти за пределы клеточной мембраны, но ничто не препятствует выходу ионов К+ и Cl-. Становится понятным почему концентрация внутриклеточного хлора в 50 раз меньше внеклеточной. Согласно законам термодинамики, ионы Na+ , концентрация которых в 12 раз выше во внеклеточной среде, должны стремиться войти в клетку благодаря существующему градиенту концентраций. Однако в состоянии покоя этого практически не происходит по причине того, что натриевые белковые каналы конкурентно блокируются более крупными по своему размеру катионами Са2+. Возникает неравномерное распределение ионов по обе стороны мембраны, получившее название доннановского равновесия. С внешней стороны клеточной мембраны будут в основном находится в высоких концентрациях ионы Na+, Cl-, Са2+. На внутренней поверхности мембраны будут преимущественно отрицательно заряженные ионы органических соединений и катионы К+, стремящегося по электрохимическому градиенту покинуть клетку. Именно концентрация внешнего (вышедшего) К+ и определяет величину регистрируемой разности потенциалов. Вследствие этого в литературе мембранный потенциал часто называют концентрационным калиевым потенциалом.
|
|
|
|
|
|
Пассивный и активный транспорт ионов через мембрану поддерживают создавшееся состояние доннановского равновесия.
Пассивным транспортом называется перенос неэлектролитов и ионов через мембрану по градиенту химического или электрохимического потенциала. В нейрофизиологии под градиентом понимают наличие пространственно ориентированных количественных отличий в системах, направляющих вектор изменения этих системах в сторону выравнивания существующих отличий. Известны следующие механизмы пассивного транспорта:
1. Простая диффузия через фосфолипидный бислой – по своей сути представляет собой растворение вещества в липидной фазе мембраны, диффузию и последующий выход из мембраны на противоположной стороне. Легче всего простой диффузией проходят через мембрану малые неполярные молекулы (О2, стероиды, тиреоидные гормоны) и жирные кислоты. С более низкой скоростью диффундируют малые полярные незаряженные молекулы (СО2, NH3, Н2О, этанол, мочевина). Однако для большинства ионизированных атомов и молекул гидрофобный слой мембраны практически непреодолим.
|
|
|
2. Облегченная диффузия. При облегченной диффузии вещества переносятся через мембрану также по градиенту концентрации, но с помощью специальных трансмембранных белков-переносчиков – транслоказ. Эти белки имеет центр связывания, комплементарный переносимому веществу, поэтому для облегченной диффузии, в отличие от простой, характерна высокая избирательность: для каждого иона, вещества или группы сходных веществ имеется свой переносчик. Переносимое вещество присоединяется к транслоказе, в результате чего изменяется ее конформация, в мембране открывается канал, и вещество освобождается с другой стороны мембраны. Поскольку в канале нет гидрофобного препятствия, то этот механизм называют облегченной диффузией. Перенос ионов через гидрофильные ионные каналы представляет собой вариант облегченной диффузии (рис.5).
Процессы облегченной и простой диффузии направлены на выравнивание градиентов и установление равновесия в системе клетка-внеклеточная среда
Каналы в мембране формируются интегральными белками, которые "прерывают" липидный бислой, образуя пору, заполненную водой. Стенки канала "выстилаются" радикалами аминокислот этих белков. Трансмембраный перенос путем облегченной диффузии осуществляется по двум основным типам белковых молекул – селективных каналов и неселективных «пор». Селективность канала определяется наличием в белке специфического центра связывания иона. В настоящее время такие каналы описаны для большинства потенциалобразующих ионов – Са2+, Na+, К+, О2-. Неселективные каналы различают вещества только по размеру и пропускают все молекулы меньше определённой величины, по градиенту концентрации, т.е. служат фильтрами. Например, в мембране находятся неспецифические каналы для ионной утечки, каждый из которых проницаем дляK+, Nа+ и Сl- (больше всего для К+). Эти каналы не имеют воротных механизмов, всегда открыты и почти не меняют своего состояния при электрических воздействиях на мембрану.
 |
Белковые каналы могут находиться в открытом или закрытом состоянии благодаря наличию т.н. «ворот». М-ворота (активационные) находятся в глубине канала, h-ворота (инактивационные) на его поверхности. В зависимости от состояния ворот белковый канал может быть
 открыт – открыты оба вида ворот
открыт – открыты оба вида ворот
 закрыт – закрыты активационные ворота
закрыт – закрыты активационные ворота
 инактивирован – закрыты инактивационные ворота
инактивирован – закрыты инактивационные ворота
Так, в состоянии покоя натриевый канал не пропускает ионы Na+, поскольку закрыты м–ворота, большинство калиевых каналов при этом находится в открытом состоянии.
Причины открытия и закрытия ворот разнообразны. Это могут быть изменениями мембранного потенциала и тогда каналы называются потенциалзависимыми. К потенциалзависимым относятся Na+, K+, Са2+, Сl-–
каналы. В этом случае стимул, приводящий к открытию ворот, действует непосредственно на канал. Если причина открытия канала – взаимодействие с определенными химическими веществами, специфическое фосфорилирование ворот, то каналы являются потенциалнезависимыми. В этом случае рецептор химического стимула пространственно разобщен с каналом. Такие каналы могут быть гормонрегулируемыми, рецепторрегулируемыми. Кроме перечисленных существуют каналы смешанного типа.
Соотнеся химические процессы, происходящие на мембране клетки, с электрическими мы получаем полное представление о причинах возникновения мембранного потенциала:
1. механический фактор – ионы К+ имеют малый диаметр, поэтому они проходят через узкие калиевые каналы утечки. Ионы Na+ в два раза крупнее и через калиевые каналы войти в клетку не могут.
2. электростатический фактор – у входа в потенциалзависимый канал есть заряд, создаваемый белковой молекулой, что препятствует проникновению одноименных ионов.
3. конкурентный фактор – в состоянии покоя натриевые каналы часто блокированы большими по размеру ионами Са2+.
Таким образом, уравнение Нернста является частным случаем сложных суммационных процессов пассивного транспорта, протекающих на клеточной мембране. Итоговая величина суммарного диффузионного потенциала, который создаётся утечкой нескольких видов ионов, рассчитывается по формуле Гольдмана-Ходжкина-Катца. В ней учтено, что потенциал покоя зависит от:
 полярности электрического заряда каждого иона
полярности электрического заряда каждого иона
 проницаемости мембраны Р для каждого иона
проницаемости мембраны Р для каждого иона

 |
[концентраций соответствующих ионов] внутри (внутр) и снаружи мембраны (внеш).
Итак, вследствие протекающих постоянно процессов движения ионов по градиенту концентраций, мембранный потенциал должен со временем терять свою величину. Однако этого не происходит, так как живой системе свойственно поддерживать саморегуляцию и самоорганизацию затрачивая на эти процессы метаболическую энергию. Мембрана клетки не исключение – это активная транспортная система. Белки клеточной мембраны, обеспечивающие активный транспорт ионов против электрического и концентрационного градиентов называют ионными насосами. Наиболее важным активным транспортным процессом, направленным на поддержание постоянного уровня мембранного потенциала, является работа натрий-калиевого насоса. Эти белки присутствуют в мембране любой клетки, но наиболее многочисленны в возбудимых клетках – нервных мышечных, секреторных. Максимальная концентрация этих белков выявлена в миелиновых волокнах в областях перехватов Ранвье.
Как транспортный мембранный белок Na+/K+-насос представляет собой переносчик, осуществляющий антипорт – перенос ионов в противоположном направлении. Na+ перемещается против градиента за пределы клетки, а K+ внутрь. (Напомним, что унипорт – простой перенос ионов в определенном направлении, а симпорт – перенос двух и более разных веществ в одном направлении.) Таким способом поддерживается высокая внутриклеточная концентрация ионов калия и низкая концентрация ионов натрия.
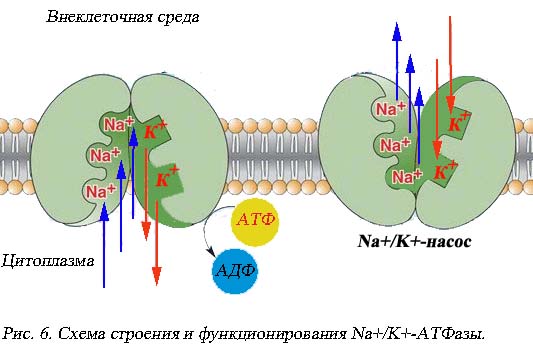 |
Как молекула – белок Na+/K+-насос относится к ферментам из группы транспортных аденозинтрифосфотаз – катализирует отщепление от молекулы АТФ одного или двух остатков фосфорной кислоты. Сама АТФ поступает к насосу от митохондрий. Энергия, освобождаемая при этих процессах, идет на перенос соответствующих ионов. При расщеплении одной молекулы АТФ происходит перенос трех ионов натрия из клетки и одновременно дух ионов калия в клетку(рис. 6). Транспортный ток осуществляется с высокой скоростью – до 6000 ионов Na+ в секунду. В некоторых наиболее активных клетках до 60-70% синтезируемой энергии идет на работу этих мембранных белков.
Основная функция Na+/K+-насоса – поддержание высокой концентрации внутреннего калия, который всегда стремиться покинуть клетку по градиенту концентрации. Другая функция поддержание электроотрицательности с внутренней стороны клеточной мембраны, так как стереохимия ионного обмена приводит к потере одного катиона за один цикл переноса (3:2).
Сделаем вывод: мембранный потенциал (потенциал покоя) является результатом как пассивных, так и активных механизмов транспорта через мембрану. Степень участия этих механизмов неодинакова, зависит от структуры мембраны, функциональной нагрузки, наличия ионов по разные стороны мембраны. Создавая разность потенциалов по обе стороны мембраны, возбудимая клетка приобретает уникальный потенциальный механизм, позволяющий генерировать возбуждение под действием стимула, проводить возбуждение и передавать его другим клеточным структурам.
Потенциал действия
При совершении работы, то есть, находясь в состоянии функциональной активности, электровозбудимые клетки быстро теряют потенциал покоя, или говоря иными словами, теряют гомеостатическую «поляризацию» клеточной мембраны. Трансмембранным методом после действия стимула регистрируется резкое изменение заряда клеточной мембраны. Это может быть полная инверсия заряда: в точке приложения стимула мембрана снаружи приобретает отрицательный заряд, а внутри положительный. Такая потеря нормальной поляризации получила название деполяризации(лат. приставка de- означает отсутствие, отмену, устранение чего либо). В этом случае результатом действия стимула будут процессы возбуждения, развивающиеся на мембране нейрона. Однако в результате действия стимула может возникнуть не деполяризация, а наоборот – усиление поляризации клеточной мембраны. Заряд наружной поверхности становится еще более положительным, а внутренней – еще более отрицательным. Эти процессы в электрофизиологии получили название гиперполяризации (от греч. hyper – над, сверх, превышающий норму), соответствуют повышению электрического сопротивления мембраны и, следовательно, развитию процессов торможения. Экспериментальные исследования убедительно показали, что состояния деполяризации и гиперполяризации обусловлены изменением проницаемости клеточных мембран для ионов натрия и калия.
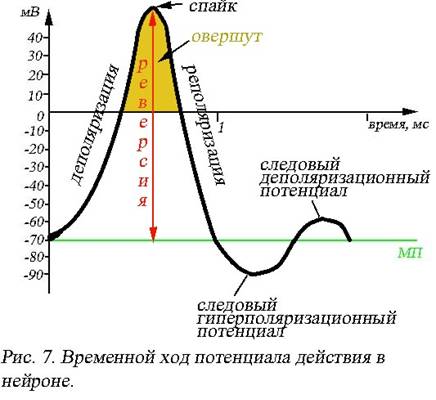 |
Деполяризация клеточной мембраны (рис. 7) сопровождается быстрым сдвигом мембранного потенциала в положительном направлении, соответствует на графике фазе нарастания и длится около 0,2-0,5 мс. Верхняя точка фазы нарастания лежит в области положительных значений, соответствует амплитуде потенциала действия, является фиксированной для данного нейрона величиной и называется спайк (пик). Разность потенциалов, на которую произошла перезарядка мембраны (от уровня МП до спайка) именуется реверсией. Участки кривой, лежащие в области положительных значений оси ординат, соответствуют инверсии заряда, - мембрана снаружи становится заряженной отрицательно, изнутри положительно, - называют овершут (перелет). Минуя спайк, график переходит в фазу убывания, которой соответствуют процессы реполяризации (лат. re – снова, заново) клеточной мембраны, в течение этой фазы происходит восстановление исходного мембранного потенциала покоя. Последний участок реполяризации часто бывает пологим, например, в мышечных клетках длительность этой фазы может достигать 0,5-1,5 мс. В нейронах кроме потенциала действия можно наблюдать и следовые потенциалы. Следовый гиперполяризационный потенциал – участок кривой, расположенный ниже значений потенциала покоя. Следовый деполяризационный потенциал – является результатом незначительной затухающей деполяризации клеточной поверхности.
Что бы ответить на вопрос: «какова причина столь резких изменений возникающих на клеточной мембране под действием стимула?» необходимо проследить кинетику ионных токов через мембрану при развитии ПД.
Под действием стимула открываются потенциалзависимые Na+-каналы. Напомним, что в состоянии покоя вход Na+ в клетку конкурентно блокируется катионами кальция. Если сила раздражителя меньше пороговой величины, то потенциал действия не возникает, но развиваются локальные (подпороговые) потенциалы. Если сила раздражителя менее 50-75% пороговой величины, то проницаемость мембраны для ионов изменяется неспецифично и незначительно. Если сила раздражителя достигает и/или превышает 50-75% от порога раздражимости, то начинает преобладать Na+ проницаемость (рис. 8). Под действием стимула мембранные натриевые каналы освобождаются от Са2+, что приводит к изменению мембранного потенциала. Следует отметить, что высокие концентрации наружного Са2+ стабилизируют потенциал покоя, деполяризация в этом случае развивается с задержкой до 35 мс. Напротив, снижение концентрации наружного Са2+, способствует развитию быстрой деполяризации мембраны. Низкие концентрации наружного Na+ приводят к невозможности развития ПД даже при действии стимула.
Графически порог раздражимости клетки отражает критический уровень деполяризации– КУД – это разность потенциалов, которая должна быть достигнута, чтобы местные изменения перешли в распространяющиеся. Иными словами разность потенциалов между МП и КУД отражает возбудимость ткани. В нейронах эта величина практически постоянная и равна -40-(-50) мВ.
Локальные потенциалы (на рис. 8 обозначены красным цветом) могут суммироваться в том случае, если они превышают 50-75% от КУД. Известны два вида суммации: пространственная и временная. При пространственной суммации потенциал действия возникает в результате одновременного пространственно разобщенного действия некоторого числа подпороговых стимулов. Временная суммация – процесс развития потенциала действия после серии подпороговых стимулов, приложенных к одной точке мембраны. Если локальные потенциалы ниже
 |
50-75% от КУД, то они не суммируются ни при каких условиях.
При преодолении КУД деполяризация развивается лавинообразно, т.к. все потенциалзависимые m-ворота натриевых каналов в точке действия стимула открываются для вхождения Na+ внутрь клетки. Открытие Na+-каналов является самоподкрепляющимся регенеративным процессом: развивающаяся деполяризация мембраны вызывает дополнительное увеличение ее проницаемости для Na+. Именно поэтому фаза деполяризации характеризуется как Na+-ток, направленный внутрь клетки.
В тот момент, когда амплитуда потенциала действия достигает максимального значения, происходит закрытие h-ворот (инактивационных) Na+-каналов, которые наиболее чувствительны к величине внутриклеточного положительного заряда и поступление Na+ в клетку прекращается. Точка спайка достигается при установлении электрохимического равновесия по Na+ с обеих сторон клеточной мембраны.
Одновременно с наступлением электрохимического равновесия по Na+ происходит повышение проводимости для К+. В мембране открываются K+-каналы, имеющие только одни ворота (активационные), закрытые в покое. Экспериментально установлено, что если при проведении потенциала действия искусственно снизить проводимость мембраны для К+ (этого можно добиться вводя препарат тетраэтиламмоний), то реполяризация развивается очень медленно и очень полого. Следовательно фаза реполяризации характеризуется К+-током, направленным за пределы клетки.
Физиологический смысл реполяризации состоит в восстановлении возбудимости клеточной мембраны. Это возможно только при возвращении состояния потенциала покоя. Для этого необходимо «откачать» катионы натрия и калия против градиента концентрации, что и происходит в результате активации натрий-каливого насоса. При реполяризации происходит накопление ионов натрия на наружной поверхности клеточной мембраны вследствие двух причин: инактивации натриевых каналов и из-за работы Na+/К+-насоса. При достижении значений потенциала близких к значениям потенциала покоя часто наблюдается замедление реполяризации, которое связано с закрытием значительной части ворот K+-каналов, а также - с возрастанием противоположно направленного электрического градиента.
Однако процессы перемещения ионов через мембрану характеризуются достаточной инерционностью. Следовый гиперполяризационный потенциал возникает в результате выхода избытка К+ за пределы клетки. Это происходит по тему, что, несмотря на возникающее при реполяризации электрическое равновесие при достижении значений мембранного потенциала, соответствующего состоянию покоя, концентрационный градиент по калию все еще остается высоким. Состояние гиперполяризации всегда сопровождается повышением сопротивления мембраны и, следовательно, снижением возбудимости клетки. Длительная следовая гиперполяризация хорошо выражена в тонких немиелинизированных нервных волокнах, например, в болевых афферентах. Натрий-калиевый насос непосредственно на фазы потенциала действия не влияет, он работает как в состоянии покоя, так и продолжает работать во время развития потенциала действия.
Компенсирует эти процессы следовый деполяризационный потенциал (развивается не всегда). Причины возникновения этого потенциала просты: избыточный внешний калий действует на m-ворота Na+-каналов как подпороговый внешний стимул, внутренние h-ворота открываются по причине нарастания электроотрицательности. В результате этих процессов внутрь клетки просачивается некоторое количество ионов Na+. Такие изменения демонстрируют все свойства местного возбуждения, а именно: градуальны, затухают со временем. Как только К+ проницаемость вернется к исходному уровню регистрируется мембранный потенциал (покоя).
Возбудимость клеточной мембраны неоднократно изменяется в зависимости от фазы потенциала действия:
1. Кратковременное повышение возбудимости – на графике соответствует начальному участку кривой, до достижения значений 50-75% от КУД. Это состояние вызывается как подпороговыми, так и пороговыми (или надпороговыми) стимулами. В зависимости от силы раздражителя на этом участке графика формируется либо локальный ответ, либо участок кривой потенциала действия, соответствующий латентному периоду (времени, затраченному на преодоление порога раздражимости клетки). Возбудимость повышается потому, что клетка частично деполяризована, разность между величиной деполяризации и критическим уровнем деполяризации ниже пороговых значений. То есть мы получаем наглядное подтверждение снижения порога раздражимости. Любой дополнительный подпороговый стимул, воздействующий на данный участок мембраны в это время, может оказаться достаточным для развития полноценного потенциала действия.
2. Рефрактерность – самая длительная и самая важная фаза потенциала действия. Выделяют рефрактерность абсолютную и относительную. Графически абсолютный рефрактерный период начинается от точки пересечения восходящей кривой деполяризации до окончания овершута. Какой бы по силе дополнительный стимул не подействовал в данный момент – он не вызовет никаких изменений в развитии потенциала действия. Клетка не в состоянии распознать стимуляцию в этот период, потому что m-ворота Na+-каналов уже открыты, а еще закрытые открываются в ответ на уменьшение мембранного потенциала. По преодолении спайка, в начальном участке реполяризации рефрактерность тоже еще абсолютна так как, закрываются h-ворота Na+-каналов, и это состояние не изменяется даже при сильной стимуляции. Относительный рефрактерный период соответствует оставшемуся нисходящему участку реполяризации и включает в себя следовый гиперполяризационный потенциал. В это время происходит восстановление возбудимости, но концентрация внешнего калия все еще достаточно высока. В это время клетка способна ответить на сверхсильную стимуляцию, но амплитуда развивающегося при этом потенциала действия будет ниже исходной. Рефрактерность предохраняет клетку от перевозбуждения и отграничивает отдельные потенциалы действия во времени и пространстве. Чем короче время рефрактерного периода, тем выше лабильность нервного волокна. При продолжительности абсолютного рефрактерного периода 2мс нервное волокно способно генерировать потенциалы с частотой 500имп/с. Этот показатель типичен для большинства нервных волокон. Однако в перехватах Ранвье миелиновых двигательных волокон и в аксонах нейронов ретикулярной формации плотность натриевых каналов настолько высока, что лабильность достигает 1000имп/с.
3. Экзальтация –вторичное кратковременное повышение возбудимости – фаза, возникающая при следовом деполяризационном потенциале. Этому участку кривой соответствует повышенная проницаемость для катионов натрия, следовательно, порог раздражимости будет снижаться по сравнению с потенциалом покоя. Действующий в это время подпороговый стимул может привести к преодолению критического уровня деполяризации и развитию полноценного потенциала действия.
Заметим, что скорость смены возбудимости клеточной мембраны не является строго определенной величиной, она в значительной степени зависит от обменных процессов (метаболических и энергетических) и от силы и длительности стимуляции. Если в клетке снизится запас энергии (влияет на активный транспорт) или израсходуется запас метаболитов, в том числе потенциалобразующих ионов – лабильность и возбудимость будут стремительно падать. То же самое мы будем наблюдать при действии пессимального (длительного по времени или слишком сильного раздражителя): каждый раз активируясь в фазу относительной рефрактерности, клетка все слабее с более низкой амплитудой будет отвечать на стимуляцию, пока ответ станет невозможен вовсе. Такое состояние расценивается как парабиоз. Если стимул продолжает действовать и дальше – клетка погибает. Если стимуляция прекращается – через некоторое время (пессимальное торможение) клетка восстанавливает свои потенции и вновь готова отвечать на стимуляцию (подробнее см. тему 4.2).
Дата добавления: 2018-06-27; просмотров: 1025; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
