Жидкостные (химические) методы травления
По характеру взаимодействия растворителя с веществом химическое травление (растворение) бывает трех типов: молекулярное, ионное и реактивное.
Молекулярное растворение. Отличительной чертой этого типа растворения является полная идентичность химической формулы вещества в исходном состоянии и в растворе. После удаления (например, испарения) растворителя растворенное вещество может быть получено в химически неизменном виде, хотя с ним могут произойти морфологические изменения. Примером такого типа реакций может служить растворение сахара в воде, полистирола в бензоле и так далее. Частным случаем молекулярного растворения является образование коллоидных растворов, когда вещество в растворе находится не в виде отдельных молекул, а группируется в крупные полимолекулярные образования, так называемые коллоидные частицы.
Ионное растворение. В этом случае исходное состояние вещества и состояние в растворе не идентичны. В растворе происходит разделение ионного кристалла на катионы и анионы, которые окружены сольватационными оболочками (в водных растворах образованными полярными молекулами воды), которые обеспечивают устойчивость таких растворов. Тем не менее, как и в случае молекулярных растворов, после удаления растворителя растворенное вещество может быть выделено в химически неизменном виде. Примером такого типа реакций является растворение NaCl в воде.
|
|
|
Реактивное растворение. Процесс растворения сопровождается химическим взаимодействием между растворенным веществом и растворителем, которое происходит со значительным тепловым эффектом, существенно превышающим тепловой эффект при молекулярном или ионном растворении. При этом в растворе будут присутствовать продукты, химически отличные от исходного состояния системы. Удаление растворителя не позволяет получить растворенное вещество в исходном виде. Примером такого типа растворения является реакция:
Zn(тв) + 2HCl(жидк) ® ZnCl2(раств) +H2(газ).
В основном процесс травления можно представить в виде пяти стадий.
 |
 1. Перенос молекул или ионов травителя из объема раствора к поверхности полупроводника.В начальный момент после погружения пластины полупроводника в раствор вблизи ее поверхности за счет интенсивной реакции образуется слой d, обедненный молекулами травителя (рис. 3.22), что приводит к возникновению градиента концентрации молекул травителя и формированию диффузионного потока этих молекул к поверхности полупроводника. Плотность потока jx на основании первого закона Фика можно оценить по формуле
1. Перенос молекул или ионов травителя из объема раствора к поверхности полупроводника.В начальный момент после погружения пластины полупроводника в раствор вблизи ее поверхности за счет интенсивной реакции образуется слой d, обедненный молекулами травителя (рис. 3.22), что приводит к возникновению градиента концентрации молекул травителя и формированию диффузионного потока этих молекул к поверхности полупроводника. Плотность потока jx на основании первого закона Фика можно оценить по формуле |
|
|
где D – коэффициент диффузии молекул травителя; N0 и Ns – концентраций молекул травителя в объеме раствора и у поверхности пластины.
2. Адсорбция молекул травителя на поверхности полупроводника. На этой стадии молекулы травителя вступают в контакт с поверхностью. Этот контакт может быть либо химической адсорбцией (хемосорбцией), либо физической адсорбцией. В первом случае между молекулами травителя и поверхностными атомами полупроводника возникают ионные или ковалентные связи. Во втором случае молекулы травителя удерживаются на поверхности слабыми силами Ван-дер-Ваальса. Соответственно энергия активации адсорбции при хемосорбции оказывается существенно больше, чем при физической адсорбции.
3. Кинетическая стадия процесса. На этой стадии в результате химических реакций молекул травителя с поверхностными атомами происходит разрыв химических связей последних и переход их в раствор. Механизмы этих реакций зависят от материала пластины, состава травителя и условий травления. Они отличаются большим многообразием и часто бывают довольно сложны.
4. Десорбция продуктов реакции. В результате протекания химических реакций на поверхности полупроводника накапливаются продукты реакции, которые могут быть физически или химически связаны с поверхностью. Для того чтобы перевести их в раствор, необходимо разорвать эти связи, что и происходит на данной стадии.
|
|
|
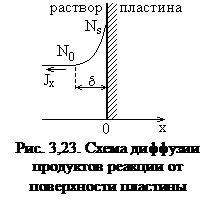
5. Удаление продуктов реакции от поверхности полупроводника в объем раствора. В результате перехода растворенного материала в жидкую фазу вблизи поверхности полупроводника на расстоянии d накапливаются продукты реакции, концентрация которых Ns существенно превышает их концентрацию N0 в объеме раствора (рис. 3.23). В результате возникает диффузионный поток jx молекул вещества, пропорциональный градиенту концентрации.
 Таким образом, весь процесс травления состоит из двух диффузионных, двух сорбционных и одной кинетической стадий. Общая скорость процесса определяется скоростью наиболее медленной (лимитирующей) стадии. Как правило, сорбционные стадии редко ограничивают скорость травления. В большинстве случаев скорость травления ограничивается либо диффузией компонентов травителя или продуктов реакции в растворе, либо скоростью химической реакции на поверхности пластины. В зависимости от того, какая из этих стадий является лимитирующей, результаты травления оказываются различными.
Таким образом, весь процесс травления состоит из двух диффузионных, двух сорбционных и одной кинетической стадий. Общая скорость процесса определяется скоростью наиболее медленной (лимитирующей) стадии. Как правило, сорбционные стадии редко ограничивают скорость травления. В большинстве случаев скорость травления ограничивается либо диффузией компонентов травителя или продуктов реакции в растворе, либо скоростью химической реакции на поверхности пластины. В зависимости от того, какая из этих стадий является лимитирующей, результаты травления оказываются различными.
|
|
|
Пусть, например, лимитирующей стадией является диффузия молекул травителя (первая стадия) или молекул растворенного вещества (пятая стадия). В этом случае общая скорость процесса травления будет определяться плотностью потока jx молекул (см. формулу 3.29), которая зависит от температуры, вязкости травителя, механических воздействий, способствующих перемешиванию травителя. От свойств самой поверхности (кристаллической ориентации, наличия поверхностных дефектов и так далее) скорость травления не зависит. Следовательно, травление в этом случае должно происходить изотропно, и в результате травления поверхность должна становится гладкой, то есть травление носит полирующий характер. Травители, для которых лимитирующей стадией является диффузия, называются полирующими, а сам процесс травления – интегральным. Полирующие свойства травителей можно усилить, если уменьшить скорость протекания диффузионных процессов. Это можно сделать с помощью специальных добавок, увеличивающих вязкость травителя, или за счет уменьшения температуры процесса. Интенсивное перемешивание травителя, напротив, разрушает диффузионный слой d, что снимает диффузионное ограничение и ухудшает, таким образом, полирующие свойства травителя.
Если лимитирующей стадией является кинетическая стадия, то общая скорость процесса травления Vтр будет примерно равна скорости химической реакции на поверхности:
 |
где Атр – константа скорости химической реакции на поверхности объекта; Ns – концентрация молекул травителя на поверхности; DЕ – энергия активации химической реакции (избыточная энергия, которой должна обладать молекула в момент столкновения с другой молекулой, чтобы быть способной к химическому взаимодействию).
Энергия активации DЕ зависит от неоднородности поверхности пластины, кристаллографической ориентации, наличия на поверхности структурных дефектов. Если, например, на поверхности имеются выходы дислокаций, то в этих местах энергия активации меньше, чем на участках поверхности без дефектов. Поэтому в «дефектных» участках скорость травления будет выше, и на поверхности образуются ямки травления, форма которых зависит от кристаллографической ориентацией поверхности пластины.
Травители, у которых лимитирующей стадией является химическая реакция, называются селективными, а процесс травления – дифференциальным. Как следует из выражения (3.30), характер селективного травления определяется не только свойствами поверхности, способными повлиять на значение энергии активации химической реакции DE, но и в значительной степени температурой. С ростом температуры селективность травителя оказывается выраженной меньше. Поэтому для выявления поверхностных дефектов желательно проводить травление при низких температурах. Однако при снижении температуры уменьшается вязкость травителя, и на скорость всего процесса начинают влиять диффузионные стадии, снижающие селективность травителя.
Дата добавления: 2018-05-12; просмотров: 377; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
