ТЕПЛОТЫ ФАЗОВЫХ ПЕРЕХОДОВ
Здесь, как правило, имеются в виду фазовые переходы первого рода: испарение/конденсация и плавление/кристаллизация.
5.1. ТЕПЛОТЫ ИСПАРЕНИЯ.
Поскольку различие интенсивности межмолекулярных взаимодействий в газах и жидкостях в докритическом состоянии вещества весьма существенно, значения теплот испарения при температурах Тr≤0,90 хорошо описывыаются
и поддается расчёту на основании принципа соответственных состояний.
5.1.1. ТЕПЛОТЫ ИСПАРЕНИЯ ПРИ НОРМАЛЬНОЙ ТЕМПЕРАТУРЕ КИПЕНИЯ - Tb.
Уравнение Трутона для неполярных и малополярных веществ
DНVb [Дж/моль] = 88 Tb
DSVb = 88 Дж/(моль.K)
Уравнение Кистяковского является достаточно точным для или умереннополярных апротонных органических веществ (углеводороды, алкил- и арилгалогениды; простые и сложные эфиры; сульфиды; альдегиды, кетоны).
DНVb [Дж/моль] = (36,636 + R lnTb) Tb (4)
DSVb =36,636 + R lnTb
Уравнение Риделя более точно для полярных органических веществ (карбоновые кислоты, спирты, фенолы, галогенангидриды, нитросоединения, ангидриды)
DНVb [Дж/моль] = 1,093 R Tb  =9,088Tb
=9,088Tb  (5)
(5)
DSVb =9,088 
где TКР - критическая температура, К;
PКР - критическое давление, атм;
Θb = Tb/TКР - приведённая температура кипения.
* 1 МПа = 9,8692 атм.
Уравнение Морачевского-Сладковаболее точно для полярных неорганических веществ (кислоты, оксиды, сульфиды, галогенангидриды, нитросоединения, ангидриды)
DНVb [Дж/моль] =  =
=  (5)
(5)
DSVb =8,3144 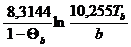
Где 
Vb- молярный объём жидкости при температуре кипения
5.2. ТЕПЛОТЫ ИСПАРЕНИЯ ПРИ ДРУГИХ ТЕМПЕРАТУРАХ КИПЕНИЯ.
Теплоты испарения при более низких температурах заметно возрастают, а при более высоких убывают и становятся равными нулю при ТКР. Эта зависимость хорошо аппроксимируется.
Уравнение Уотсона -для более высоких температур : T>Tb
DНVТ = DНVb  (6)
(6)
Уравнение Чью-Свенсона -для более низких температур T<Tb
DНVТ = DНVb 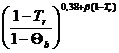 (7)
(7)
b = (0,12...0,20)
Tr = T/ TКР - приведённая температура.
5.2. ТЕПЛОТЫ ПЛАВЛЕНИЯ
Данных для теплот плавления значительно меньше, чем для теплот испарения. Кроме того, ситуация осложняется тем, что надежных корреляций для расчёта значений этого свойства не существует. Приведённое в ряде изданий
(в том числе - в I томе «Справочника химика») соотношение
DНm /DНVb = 0,36 – НЕВЕРНО !
В действительности это соотношение находится в пределах: DНm /DНVb = (0,02…1,12).
Можно рекомендовать ряд чисто эмпирических соотношений.
Неорганические вещества
DНm = 6,147 Tm4/3 - неполярные и малополярные вещества, Дж/моль;
DНm = 64,4 Tm – 4400 - высокополярные вещества, Дж/моль.
Органические вещества
DSm = DНm/Tm = (48 ±2) - неполярные вещества, Дж/моль.К;
DSm = DНm/Tm = (52±2) - малополярные вещества, Дж/моль.К;
DSm = DНm/Tm = (56±2) - высокополярные вещества, Дж/моль.К;
В этой связи наиболее правильным представляется использовать метод ЛЭСЭ и выражать теплоты плавления
искомых веществ через «базовые вещества» с известной температурой и теплотой плавления. Базовое вещество по
строению должно принадлежать к тому же классу, что и искомое
Неорганические вещества
DНm = DНmо (Tm /Tmо) 4/3 - неполярные и малополярные вещества;
DНm =DНmо + 64,4 (Tm – Tmо) - высокополярные вещества, Дж/моль.
Где DНm, DНmо - теплота плавления искомого и базового вещества, Дж/моль;
Tm , Tmо - температура плавления искомого и базового вещества, К;
Органические вещества
DНm = DНmо (Tm /Tmо)
ВЯЗКОСТЬ
ВЯЗКОСТЬ ГАЗОВ
Почти все процессы химической технологии БАВ протекают при атмосферном или пониженном давлении. Обширные сведения о вязкости основных газов приведены в справочной литературе [].
При отсутствии справочных данных вязкость чистого однокомпонентного газа при низких давлениях можно рассчитать несколькими способами, например – на основе принципа соответственных состояний – исходя из
значений критических параметров
h=hКР Т  при T<TKP
при T<TKP
h=hКР Т  при T>TKP
при T>TKP
где hКР= 3,5.10 -7  - критическая вязкость, Па.с;
- критическая вязкость, Па.с;
РКР – критическое давление, атм;
ТКР – критическая температура, К;
Тr – приведённая температура.
Вязкость смеси газов можно найти из соотношения
h=  =
= 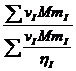
Где NI – молярная доли компонента I;
VI - объёмная доли компонента I.
ВЯЗКОСТЬЖИДКОСТЕЙ
Известно несколько полуэмпирических методов расчёта вязкости жидкостей. Все они дают довольно значительные - (5…10) % - погрешности. В данном пособии рекомендуется инкрементный метод Оррика-Эрбара, основанный на моделировании параметров уравнения Эйринга для температурной зависимости вязкости
ln  = A +
= A +  = ln
= ln  +
+ 
Где h - динамический коэффициент вязкости, мПа.с;
h  - динамический коэффициент вязкости при Т=
- динамический коэффициент вязкости при Т=  , мПа.с;
, мПа.с;
rх – характерная плотность, г/см3
rх = r20 – плотность при t=20 ОС – при tпл<20OC;
rх = rL – плотность при tпл – при tпл>20OC;
Mm – молярная масса;
E0 – энергия активации вязкого трения, Дж/моль;
R –газовая постоянная, Дж/(моль.К).
Значения параметров А и В рассчитывают инкрементным методом
А = SnIjА
B = SnIjB
Где nI – число одноимённых групп
Метод применим при относительно низких температурах Tr<0,73.
Значения инкрементов для вычисления параметров А и В приведены в таблице.
Таблица - Значения инкрементов для вычисления параметров А и В по методу Оррика-Эрбара.
| Группа (синтон) | Инкремент jА | Инкремент jВ |
| 1 | 2 | 3 |
| Атом углерода* | - (6,95+0,21n) | 275+99n |
| R R-C-R | | -0,15 | 0,35 |
| R R-C-R R | -1,20 | 400 |
| Двойная связь | 0,24 | -90 |
| Пятичленный цикл | 0,10 | 32 |
| Шестичленный цикл | -0,45 | 250 |
| Фенил | 0 | 20 |
| о-замещение | -0,12 | 100 |
| м-замещение | 0,05 | -34 |
| п-замещение | -0,01 | -5 |
| Хлор | -0,61 | 220 |
| Бром | -1,25 | 365 |
| Йод | -1,75 | 400 |
| -ОН | -3 | 1600 |
| -СОО- | -1 | 420 |
| -О- | -0,38 | 140 |
| | -C=O | -0,5 | 350 |
| -COOH | -0,9 | 770 |
| 1 | 2 | 3 | |
| Серо-, азот- и фосфорсодержащие группы надо заменить соответствующими углеродсодержащими группами | |||
| Группа | Эквивалент | ||
| -S- | -O- | ||
| -SH | -OH | ||
| -SO3H | -COOH | ||
| -SO2- | -СОО- | ||
| -N- | | -O- | ||
| -NH2 | -OH | ||
| - NO2 | -СОО- | ||
| -РH2 | -OH | ||
| -PO3H | -COOH | ||
Примечание: n -число атомов углерода, не включённые в другие структурные группы.
ВЯЗКОСТЬ ЖИДКИХ СМЕСЕЙ
Существует много корреляций для расчёта вязкости многокомпонентных смесей жидкостей. Все они так или иначе основаны на учёте вязкостей и объёмных долей компонентов.
Неполярные неассоциированные жидкости (углеводороды)
lg h = SNIlghI
Малополярные слабоассоциированные жидкости (алкилгалогениды, арилгалогениды, альдегиды, кетоны, диалкиламиды, простые и сложные эфиры)
h = (S 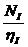 )-1
)-1
Высокополярные ассоциированные жидкости (спирты, фенолы, кислоты, ангидриды, галогенангидриды,
амиды, нитросоединения). В этом случае более точна корреляция значений кинематической вязкости
lg ν = SNIlgνI
Дата добавления: 2018-05-12; просмотров: 736; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
