По аддитивности молярных долей компонентов.
r = S ri Ni (3.1.4)
где Ni - молярная доля i-го компонента
По аддитивности объёмных долей компонентов.
r = S ri Vi (3.1.5)
где Vi - объёмная доля i-го компонента
Исходя из массовых долей компонентов.
r = S ri Mi/MmI (3.1.6)
где Mi - массовая доля i-го компонента газа;
Mm i - молярная масса i-го компонента газа, кг/кмоль.
3.1.3. ОБЪЁМНОЕ РАСШИРЕНИЕ ГАЗОВ
Коэффициент объёмного расширения газов также следует из уравнений состояния газа.
Уравнение Менделеева-Клапейрона
b=(¶lnV/¶T)P = 1/T (3.1.7)
Уравнение Ван-дер-Ваальса
Как видно из п. 3.1.1., непосредственно вычислить коэффициент объёмного расширения газа из уравнения Ван-дер-Ваальса сложно. Алгоритм расчёта таков.
1. Для заданного давления – Р – вычисляют приведённое давление π = Р/РС.
2. Для заданной температуры – Т – находят два опорных значения: Т1=Т+2,5 и Т2=Т-2,5. Вычисляют два опорных значения приведённой температуры: Θ1= Т1 /ТС и Θ2= Т2 /ТС.
3. Используя формулы (3.1.4) - (3.1.4в), рассчитывают значения молярного объёма:
- V1 = V(π; Θ1);
- V2 = V(π; Θ2);
4. Вычисляют значение коэффициента объёмного расширения
b=(¶lnV/¶T)P =  = { Т1- Т2=5}=
= { Т1- Т2=5}=  (3.1.8)
(3.1.8)
3.2. ЖИДКОСТИ
Сведения о денситометрических свойствах (плотности и объёмном расширении) жидкостей приведены в ряде изданий [ ]. Почти все методы расчёта плотности жидкостей относятся к состоянию насыщения, т.е. равновесия с паром. Обычно реальное состояние жидкостей достаточно близко к насыщенному; поэтому данное приближение применимо к практическим случаям.
3.2.1. МОЛЯРНЫЙ ОБЪЁМ И ПЛОТНОСТЬ ПРИ НОРМАЛЬНОЙ ТЕМПЕРАТУРЕ КИПЕНИЯ
Существует ряд аддитивных инкрементных методов вычисления этих важных показателей. Параметры некоторых из них приведены в таблице 3.1.
Исходя из значений молярного объёма, плотность можно вычислить по формуле
rb =  (3.2.1)
(3.2.1)
Mm – молярная масса, г/моль.
Таблица 3.1 – Значения инкрементов для расчётов молярных объёмов жидкости
при нормальной температуре кипения Vb
| Структурный фрагмент | Значение, см3/моль | Структурный фрагмент | Значение, см3/моль | |||||||||
| Метод Шредера | Метод Ле Ба | Метод Шредера | Метод Ле Ба | |||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | |||||||
| Углерод | 7 | 14,8 | С=С | 7 | ||||||||
| Водород | 7 | 3,7 | СºС | 14 | ||||||||
| Кислород (кроме отмеченных случаев) | 7 | 7,4 | Цикл | -7 | ||||||||
| - метиловые простые и сложные эфиры |
| 9,1 | трёхчленный |
| -6,0 | |||||||
| - этиловые простые и сложные эфиры |
| 9,9 | четырёхчленный |
| -8,5 | |||||||
| - высшие простые и сложные эфиры |
| 11,0 | пятичленный |
| -11,5 | |||||||
| - кислоты |
| 12,0 | шестичленный |
| -15,0 | |||||||
| - соединения с S, P, N |
| 8,3 | нафталиновое |
| -30,0 | |||||||
| Азот | 7 | антраценовое |
| -47,5 | ||||||||
| -имины |
| 15,6 | Фтор | 10,5 | 8,5 | |||||||
| - первичные амины |
| 10,5 | Хлор | 24,5 | 24,6 | |||||||
| - вторичные амины |
| 12,0 | Бром | 31,5 | 27,0 | |||||||
| Сера | 21 | 23,5 | Йод | 38,5 | 37,0 | |||||||
| Приближенные значения Vb для простых веществ | ||||||||||||
| Вещество | Значение, см3/моль | Вещество | Значение, см3/моль | Вещество | Значение, см3/моль | Вещество | Значение, см3/моль | |||||
| H2O | 18,9 | O2 | 25,6 | N2 | 31,2 | CO | 30,7 | |||||
| H2 | 14,3 | CO2 | 34,0 | SO2 | 44,8 | NO | 23,6 | |||||
| N2O | 36,4 | NH3 | 25,8 | H2S | 32,9 | OCS | 51,5 | |||||
| Cl2 | 48,4 | Br2 | 53,2 | J2 | 71,5 |
|
| |||||
3.2.2. ПЛОТНОСТЬ ПРИ ПРОИЗВОЛЬНОЙ ТЕМПЕРАТУРЕ
Значение плотности при температурах ТХ<0,9TКР можно вычислить из известной плотности жидкости при некоторой опорной температуре Т0, используя корреляционные соотношения. В данном пособии предлагается метод Ганна-Ямады [1].
r TХ = r T0  (3.2.2)
(3.2.2)
Где
FT0 = 0,33593 – 0,33953 Tr + 1,51941 Tr2 - 2,02512 Tr3 + 1,11422 Tr4 при 0,2£ Tr £0,8 (3.2.2.а)
FT = 1 + 1,3(1-Tr)1/2 lg(1-Tr) - 0,50879(1-Tr) - 0,91534 (1-Tr)2 при 0,8< Tr <1 (3.2.2.б)
Г = 0,29607 – 0,09045 Tr - 0,04842 Tr2 при 0,8< Tr <1 (3.2.2.в)
Tr – приведённая температура;
w - фактор ацентричности Питцера [формула (2.1.)]
3.2.3. КОЭФФИЦИЕНТ ОБЪЁМНОГО РАСШИРЕНИЯ
Коэффициент объёмного расширения в диапазоне температур от Т1 до Т2 по известным (справочным или расчётным) значениям плотности rТ1 и rТ2 вычисляют по формуле
b =  (3.7)
(3.7)
3.2.4.ПЛОТНОСТЬ МНОГОКОМПОНЕНТНЫХ ЖИДКОСТЕЙ
Экспериментальные данные о плотности многокомпонентных жидкостей (смесей, растворов) приведены в ряде справочных изданий [1-5]. Однако эти данные относятся преимущественно к бинарными системам; в основном – к водным/водно-органическим растворам. Поэтому расчётные методы также весьма важны. В наиболее общем виде плотность многокомпонентной системы можно рассчитать по феноменологической формуле
r0Т = 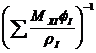 (3.8.)
(3.8.)
Где r0Т – плотность смеси (раствора) при температуре Т, кг/м3;
MXI - массовая доля компонента I;
rIТ – плотность компонента I при температуре Т, кг/м3;
fI – коэффициент изохорности компонента I (коэффициент контракции).
Как известно, физическая химия подразделяет все растворы на идеальные (атермальные изохорные: DH=0; DV=0); регулярные (атермальные неизохорные: DH=0; DV¹0); реальные (термальные неизохорные: DH¹0; DV¹0). Идеальные (точнее, близкие к ним по свойствам) растворы сравнительно редки; в большинстве случаев образование раствора сопровождается заметными изменениями энтальпии и объёма; причём эти изменения довольно сложны. Коэффициент изохорности (контракции) f приближённо характеризует степень неаддитивности объёмов компонентов при образовании раствора в определённом диапазоне концентраций.
Таблица 3.2 – Значения коэффициентов изохорности
| Компонент | Вид раствора | ||||
| Водный | Смеси полярных органических веществ с водой | Смеси полярных ор-ганических веществ | Смеси полярных и непо-лярных огани-чеcких веществ | Смеси неполярных органических веществ | |
| Вода | 1 | 0,95…1,00 | 0,99…1,01* | 0,99…1,01 | - |
| Полярные апротонные вещества | 0,96…1,00 | 0,98…1,02 | 0,98…1,01 | 0,98…1,01 | 0,99…1,01* |
| Полярные протонные вещества | 0,95…1,00 | 0,96…1,01 | 0,99…1,01 | 0,99…1,01 | 0,99…1,01* |
| Соли карбоновых кислот, алкоголяты и феноляты | 0,85…0,95 | 0,90…0,95 | 0,93…0,98 | 0,93…0,98* | - |
| Неполярные вещества | 0,98…1,02* | 0,93…0,98 | 0,99…1,01 | 0,99…1,01 | 0,99…1,01 |
| Серная кислота | 0,680…20 0,7620…50 0,850…90 | 0,75…0,85 | 0,90…0,95 | ~1 | ~1 |
| Азотная кислота | 0,710…20 0,7620…50 0,9050…90 | 0,85…0,95 | 0,90…0,95 | ~1 | ~1 |
| Хлороводород | 0,550…15 0,7515…40 | 0,75…0,85 | 0,90…0,95 | ~1 | ~1 |
| Едкое кали и соли калия | 0,45…0,55 | 0,55…0,65 | - | - | - |
| Едкий натр и соли натрия | 0,35…0,50 | 0,45…0,55 | - | - | - |
Дата добавления: 2018-05-12; просмотров: 549; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
