Критический (псевдокритический) объём
VСm = 1/8 S[NiNj (VСi1/3 + VСj1/3)]3 (1.2.2.)
Где VСi, VСj - критические объёмы компонентов i и j,
Фактор ацентричности для смеси
wm = S Niwi (1.2.3.)
Коэффициент сжимаемости
ZCm = 0,291 – 0,08 wm (1.2.4.)
Критическое (псевдокритическое) давление
РСm = R (ZCmТСm/ VСm) (1.2.5.)
Где М – относительная молярная масса
Коэффициенты парного взаимодействия
Коэффициенты парного взаимодействия kij можно найти в литературе или вычислить по эмпирическим соотношениям [1].
1. Для смесей углеводородов
kij = 0,98 + 0,045 (VСi/VСj) + 0,0025 (VСi/VСj)2 (1.2.6)
2. Для смесей, содержащих C2H2, H2S и СО2.
kij = 0,93 + 0,005 (VСi/VСj) + 0,0035 (VСi/VСj)2 (1.2.7)
СТРУКТУРНЫЕ КОНСТАНТЫ ВЕЩЕСТВА
Знание критических свойств позволяет вычислить ряд других важных характеристик реальных неидеальных веществ.
1. Фактор ацентричности Питцера (характеризует несферичность структуры молекулы)[11].
w =  (2.1)
(2.1)
|
|
|
где Qb. = ТVb/ ТС – приведённая температура кипения;
[PКР] = атм.
Фактор сложности
y = 0,1 lnТVb – 0,122 Vb + 0,006 (2.2)
где Vb –объём жидкости при температуре кипения, см3/ моль.
Коэффициенты уравнения Ван-дер-Ваальса
Уравнение Ван-дер-Ваальса – одно из наиболее широко используемых в инженерной практике уравнений
состояния реальных газов.
(Р+  )(V-b) = RT (2.3)
)(V-b) = RT (2.3)
a=  =
=  (2.3.1)
(2.3.1)
b=  =
=  (2.3.2)
(2.3.2)
Критические параметры связаны соотношением PCVC = 3/8 RTC (2.3.3)
Значения констант уравнения Ван-дер-Ваальса для многих газов приведены в литературе [ ]. Уравнение Ван-дер-Ваальса можно представить в безразмерной форме
|
|
|
(π + 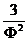 )(3Ф -1) =8 Θ (2.3.4)
)(3Ф -1) =8 Θ (2.3.4)
где π = Р/РС - приведённое давление;
Ф = V/VС - приведённый объём;
Θ= Т/ТС - приведённая температура.
Парахор
Парахор – одна из важных структурных (конститутивных) характеристик вещества, - определяется выражением
П =  , Дж1/4 см5/2 моль-1. (2.4)
, Дж1/4 см5/2 моль-1. (2.4)
Где MM – относительная молярная масса;
s - поверхностное натяжение, Дж/м2;
rЖ, rП – плотность жидкости и пара, кг/м3.
Данные о значениях парахора приведены в ряде справочников [ ] Наиболее точно значение парахора можно вычислить по следующим формулам
3 __________
П= 0,0183 Ö Tvb VK2,2/K (2.5)
Где
K = 1 при y < 0,08 (2.5.1)
K = 4,675y +0,656 при y > 0,08 (2.5.2)
|
|
|
Или
П= TC exp (-7,4y - 4,76) (2.6)
Погрешность расчётов по формулам (2.5) и (2.6) не превышает 2 %.
ПЛОТНОСТЬ
3.1. ГАЗЫ
3.1.1. ИНДИВИДУАЛЬНЫЙ (ОДНОКОМПОНЕНТНЫЙ) ГАЗ.
Уравнение Менделеева-Клапейрона
Применимо при невысоких - до 1 МПа - давлениях.
r = MmP/RT (3.1.1)
Mm – молярная масса газа, кг/кмоль.
Если известна плотность газа при одном значении температуры и давления, то для иных условий плотность определяется выражением
r = r0  (3.1.2)
(3.1.2)
Где r0 – плотность при опорных (известных) значениях температуры и давления, кг/м3;
Р, Р0 – расчётное и опорное абсолютное давление, Па;
Т, Т0 – расчётная и опорная абсолютная температура, К.
Значения r0 для многих важных газов приведены в литературе [ ].
Уравнение Ван-дер-Ваальса
Применимо при давлениях до (2…4) МПа. Существенно точнее уравнения Менделеева-Клапейрона, однако получаемые выражения намного сложнее.
|
|
|
r =  (3.1.3)
(3.1.3)
V = VC  -
- 
 - молярный объём (3.1.4)
- молярный объём (3.1.4)
Где Q =  | (3.1.4а)
| (3.1.4а)
q = 2  } безразмерные параметры (3.1.4б)
} безразмерные параметры (3.1.4б)
p =  | (3.1.4в)
| (3.1.4в)
Ввиду сложности расчётных выражений уравнение Ван-дер-Ваальса следует использовать только при расчёте процессов, протекающих при высоких давлениях.
3.1.2. МНОГОКОМПОНЕНТНЫЙ ГАЗ.
Плотность многокомпонентного газа (смеси газов) можно вычислить, используя любое из приведённых ниже эквивалентных выражений:
Дата добавления: 2018-05-12; просмотров: 814; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
