Основные физ. Свойства жидкостей и газов
Основные физические свойства жидкости и газов
ПлотностьПлотностью r (кг/м3) называется масса единицы объема жидкости:
 ,
,
где m - масса жидкого тела, кг; W - объем, м3.
Плотность жидкостей уменьшается с увеличением температуры. Исключение представляет вода в диапазоне температур от 0 до 40С, когда ее плотность увеличивается, достигая наибольшего значения при температуре 40С r = 1000 кг/м3.
Удельный вес Удельным весом g (Н/м3) жидкости называется вес единицы объема этой жидкости:
 ,
,
где ^G - вес жидкого тела, Н; W - объем, м3.
Для воды при температуре 40С g = 9810 Н/м3.
Между плотностью и удельным весом существует связь:
, 
где g - ускорение свободного падения, равное 9,81 м/с2.
Сопротивление жидкостей изменению своего объема под действием давления и температуры характеризуется коэффициентами объемного сжатия и температурного расширения.
СжимаемостьКоэффициент объемного сжатия bw (Па-1) - это относительное изменение объема жидкости при изменении давления на единицу:
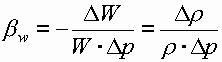 ,
,
где D^W - изменение объема W; Dr - изменение плотности r , соответствующие изменению давления на величину Dp.
Величина, обратная коэффициенту объемного сжатия, называется модулем упругости жидкостейEж (Па)
 .
.
Значение модуля упругости жидкостей зависит от давления и температуры.
Температурное расширение Коэффициент температурного расширения bt (0С)-1, выражает относительное изменение объема жидкости при изменении температуры на один градус:
|
|
|
 ,
,
где D^W - изменение объема W, соответствующее изменению температуры на величину Dt.
Коэффициент температурного расширения воды увеличивается с возрастанием температуры и давления; для большинства других капельных жидкостей bt с увеличением давления уменьшается.
Уравнение состояния газаГазы нередко бывают реагентами и продуктами в химических реакциях. Не всегда удается заставить их реагировать между собой при нормальных условиях. Поэтому нужно научиться определять число молей газов в условиях, отличных от нормальных.
Для этого используют уравнение состояния идеального газа (его также называют уравнением Клапейрона-Менделеева):
PV = nRT
где n – число молей газа;
P – давление газа (например, в атм;
V – объем газа (в литрах);
T – температура газа (в кельвинах);
R – газовая постоянная (0,0821 л·атм/моль·K).
Например, в колбе объемом 2,6 л находится кислород при давлении 2,3 атми температуре 26 оС. Вопрос: сколько молей O2 содержится в колбе?
Из газового закона найдем искомое число молей n:

Не следует забывать преобразовывать температуру из градусов Цельсия в кельвины: (273 оС + 26 оС) = 299 K. Вообще говоря, чтобы не ошибиться в подобных вычислениях, нужно внимательно следить за размерностью величин, подставляемых в уравнение Клапейрона-Менделеева. Если давление дается в мм ртутного столба, то нужно перевести его в атмосферы, исходя из соотношения: 1 атм= 760 мм рт. ст. Давление, заданное в паскалях (Па), также можно перевести в атмосферы, исходя из того, что 101325 Па = 1 атм.
|
|
|
Основные физ. Свойства жидкостей и газов
Кавитация - пустота; Нарушение сплошности потока за счет появления в нем мельчайших пузырьков, наполненных воздухом ( в воде всегда есть растворенный воздух) и парами самой жидкости. Образования пузырьков (кавитация) возникает когда понижается ее давление (напр. На задней кромке судовых винтов), или повышение температуры, или и то и другое.
Капиллярность - выражается в поднятии или опустошении поверхности жидкости внутри тонких трубок ( капилляров) . Зависит от рода жидкости. Объясняется возникновением сил поверхностного притяжения между молекулами жидкости и стенкой капилляра.
Поверхностное натяжение – Силы поверхностного натяжения очень малы; Очень распространены в природе и в технике.
Вязкость - Характеризуется 2-мя коэффициентами
Z – кинематическимкоэф. Вязкости
V(ню) – наиболее употребляемый При расчетах
|
|
|
Вязкость технических масел отражена в их марке. При повышении температуры вязкость жидкости уменьшается, а при понижении – значительно увеличивается.
Дата добавления: 2018-05-02; просмотров: 569; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
