Порядок работы с установкой для измерения зависимости ЭДС Холла от тока через образец.
Характер проводимости полупроводников, концентрацию и подвижность носителей можно определить на установке, схема которой представлена на рисунке 5.2. Исследуемый образец полупроводника (германий), изготовленный в виде прямоугольной пластинки, помещается в постоянное магнитное поле, создаваемое электромагнитом. Величина поля между полюсами N, S пропорциональна току в катушке.
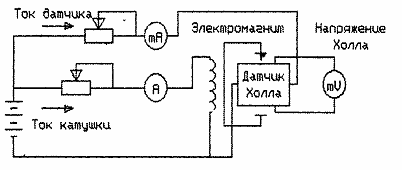
Рисунок 5. 2 - Схема установки для измерения зависимости ЭДС Холла от тока через образец
Порядок выполнения работы.
- Включить установку в сеть переменного тока с напряжением 220 В частотой 50 Гц.
- Поместить пластинку с установленным на ней полупроводником в разрез сердечника катушки индуктивности.
- Установить ручкой "Установка тока катушки" необходимый ток, контролируя его по прибору "Ток катушки".
- Изменяя ручкой "Установка тока датчика" ток через полупроводник (Датчик Холла) и контролируя его по прибору "Ток датчика" записать показания прибора "Напряжение Холла".
- Перевернуть пластину с датчиком Холла на 180°. Повторить пункты 3 и 4.
Данные записать в таблицу 1.
Таблица 1
| Ток датчика, Iд | |||
| Напряжение Холла, U1 | |||
| Напряжение Холла после поворота, U2 | |||
| ЭДС Холла, Uх |
По результатам измерений рассчитать ЭДС Холла Ux .
Измеренное напряжение является суммой холловской, контактной, термоэдс, а также эдс за счет расположения контактов на не эквипотенциальных поверхностях. Для исключения указанных сторонних ЭДС можно воспользоваться тем, что они не меняют знак при изменении направления магнитного поля. Поэтому нужно измерить значения напряжений U1, U2 при двух противоположных направлениях магнитного поля и отделить искомую ЭДС Холла от дополнительных Uд с помощью соотношений:
|
|
|
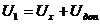

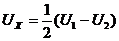
- Изменение направления поля через образец можно осуществить поворотом образца на 1800 или изменением направления тока, протекающего через катушки электромагнита.
- Построить график зависимости Ux от тока через полупроводник.
Повторить пункты п.3 - п.7 при разных токах через катушку.
- Контрольные вопросы
- В чем заключается эффект Холла? Выведите формулу для Холловской разности потенциалов?
- Какие данные о проводниках и полупроводниках можно получить на основе исследования эффекта Холла?
- Как зависит постоянная Холла от температуры? Как это влият на концентрацию свободных носителей?
- Что представляет собой датчик Холла? Для чего он применяется?
Лабораторная работа №2. 6
ОПРЕДЕЛЕНИЕ ЧИСЛА ФАРАДЕЯ И ЗАРЯДА ЭЛЕКТРОНА
|
|
|
1. Цель работы : ознакомиться с явлением прохождения тока через электролиты; определить число Фарадея и заряд электрона, используя явление электролиза.
2. Метод измерений : в течение заданного времени через электролит пропускается постоянный ток известной величины; взвешиванием определяется масса выделившегося на катоде вещества, по которой определяются число Фарадея и заряд электрона.
3. Приборы и принадлежности : выпрямитель ВС-24. амперметр. электролитическая с раствором CuSO4, ключ, весы технические с разновесом. секундомер, стакан с водой, наждачная бумага, проводники, электропечь.
4.Введение
Известно, что для прохождения тока через вещество необходимо выполнение двух условий:
1) наличие в этом веществе носителей тока — свободных электрических зарядов;
2) наличие электрического поля, которое заставит свободные заряды двигаться направленно,
В проводниках-металлах ток создается направленным движением электронов. В водных растворах кислот, солей, щелочей молекулы диссоциируют. При этом в равном количестве появляются положительные и отрицательные ионы. Если в таком растворе-электролите создать электрическое поле, то направленное движение ионов образует электрический ток. Электролиты обладают ионной проводимостью. Расплавы солей, щелочей также являются электролитами.
|
|
|
Для создания электрического поля в электролит погружаются электроды, подключенные к источнику тока. Положительные ионы движутся к отрицательному электроду — катоду, отрицательные — к положительному — аноду. Отдавая свой заряд электродам, ионы оседают на них, если не происходят химические реакции у поверхности электродов. В результате происходит выделение вещества из раствора или расплава электролита на электродах. Такое явление называется электролизом. Его законы установлены Фарадеем.
1 З А К О Н: Масса m вещества, выделившегося на из электролита, пропорциональна прошедшему через электролит количеству электричества q (заряду):
m = kq (6. 1)
Так как заряд равен произведению силы тока на время прохождения заряда через электролит (q = It), то
m = kIt (6. 2)
где коэффициент пропорциональности k — электрохимический эквивалент.
|
|
|
Из (6 .1) имеем, что k = m / q, т.е. он числено равен массе вещества, выделившейся при прохождении через электролит заряда, равного одному кулону.
2 З А К О Н: Электрохимический эквивалент пропорционален химическому эквиваленту:
k = C ( A / Z) (6. 3)
где A / Z ¾ химический эквивалент,
А ¾ атомная масса вещества,
Z ¾ его валентность.
Коэффициент С = 1 / F, где F ¾ число Фарадея.
Тогда k = (1 / F ) • (A / Z) (6. 4 )
Оба закона можно объединить. Подставляя (6 .4) в (6 .1), получим: m = (1 / F) • (A / Z)• q. (6. 5)
Из объединенного закона Фарадея следует, что если
m = A / Z кг,
то F = q,
т.е. число Фарадея равно заряду, который должен пройти через электролит, чтобы из него выделился один моль одновалентного вещества.
Пусть заряд одного иона равен Z ∙ e, где е — заряд электрона. Тогда заряд, создаваемый n ионами будет равен
q = nZe (6. 6)
Масса, выделившегося на электроде вещества:
m = nm0 (6. 7)
где m0 — масса одного иона.
Так как в одном моле вещества содержится молекул, равное числу Авогадро (NА = = 6,023• 1023 моль-1), то
m0 = А / NА (6. 8)
Из равенств (6 .7) и (6 .8) получаем:
m = (A / NА ) n (6. 9)
Подставляя (6 .6) и (6 .9) в ( 6.5) получаем:
(A / NА ) n = (1 / F) • (A / Z)• nZe,
откуда для заряда электрона получаем выражение:
е = F / NА (6. 10)
Из формулы (6 .4)
F = A / Zk (6. 11)
6 .Описание лабораторной установки
Лабораторная установка собирается по схеме, приведенной на рисунке 6.1.
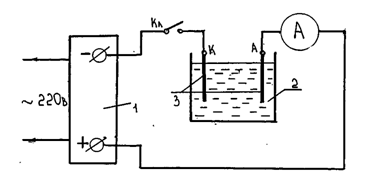
Рисунок 6. 1
В качестве источника тока 1 используется выпрямитель ВС-24, позволяющий получать ток до 10 А при напряжении до 30 В. Напряжение регулируется ручкой на лицевой панели выпрямителя. Электролитической ванной 2 является сосуд в котором находится электролит - раствор CuSO4 (медный купорос). Электродами служат медные пластины 3. При прохождении тока ионы меди выделяются на катоде и его масса увеличивается. Химические процессы у анода приводят к его растворению, т.е. к переходу атомов меди с анода в электролит. Масса анода уменьшается.
6 Порядок выполнения работы
1. Собрать цепь по схеме рисунка 6.1. При этом пластины А и К не должны быть погружены в электролит.
2. Платину К, подключаемую к “—” источника тока (катод), очистить наждачной бумагой, тщательно протереть и взвесить на технических весах с точностью до 0,02 г. Записать ее массу m1.
3. Установить пластину К в держатель, погрузить электроды А и К в электролит. Включить выпрямитель, замкнуть ключ Кл и установить в цепи ток силой 1 - 1,5 А.
4. Поддерживая ток неизменным с помощью ручки регулятора на выпрямителе, пропускать его в течение 15 -20 мин.
5. Выключить ток. Высушить катод горячим воздухом над электропечкой и взвесить его. Записать массу катода после проведения опыта — m2 .
6. Определить массу меди, выделившейся на катоде m = m2 — m1. Зная силу тока I и время его прохождения t, по формуле (6.2) вычислить электрохимический эквивалент меди в кг/Кл.
7. По формуле (6 .11) вычислить число Фарадея (Атомная масса меди А = 63,54; валентность меди Z = 2).
8. Определить относительную погрешность определения электрохимического эквивалента по формуле:
Dk / k = (Dm1 + Dm2) / (m2 — m1) + (DI / I) + (Dt / t).
Считать Dm1 + Dm2 = 0,01 г, Dt = 0,2 с, DI определяется по классу точности амперметра (см. лаб.№2.1).
7. Контрольные вопросы
1) Что такое электролиты? Почему они проводят электрический ток?
2) Что такое электролиз? Сформулируйте 1-й и 2-ой законы электролиза, а также обобщенный закон Фарадея.
3) Какой физический смысл имеет число Фарадея?
4) После проведения опыта обнаружено, что ошибочно изменена полярность подключения электродов к выпрямителю. Можно ли в этом случае определить электрохимический эквивалент?
Лабораторная работа №2. 7
Дата добавления: 2018-04-15; просмотров: 483; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
