Лабораторные работы по физико-химическим методам анализа
Работа 1. Фотоколориметрический метод определения ионов меди в водных растворах.
Цель работы: Ознакомиться с методом фотоколориметрии, определить содержание ионов меди в растворе методом сравнения.
Сущность работы. Ионы меди в водном растворе аммиака образуют комплексные ионы синего цвета:
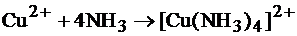 .
.
Светопоглощение измеряют при lmax=620нм с красным светофильтром.
Аппаратура, материалы, реактивы. Фотоколориметр; мерные колбы вместимостью 50 см3, пипетки вместимостью 5 см3, мерный цилиндр вместимостью 25 см3; стандартный раствор сульфата меди CuSO4×5H2O, Сст=1 мг/см3; дистиллированная вода; раствор аммиака , w=25%.
Методика выполнения работы.
1. Приготовление стандартного раствора.
В мерную колбу, вместимостью 50 см3 , вносят пипеткой 5,0 см3 раствора CuSO4×5H2O (Сст=1 мг/см3), добавляют мерным цилиндром 5 см3 водного раствора аммиака (w=25%), доводят до метки дистиллированной водой, раствор перемешивают. Затем полученный раствор помещают в кювету и измеряют оптическую плотность раствора (Аст) при l=620 нм, по отношению к дистиллированной воде.
2. Определение содержания Cu2+ в анализируемом растворе.
Контрольный раствор соли меди получают в мерной колбе, вместимостью 50 см3 , и готовят для анализа так же как и стандартный раствор сравнения. Затем измеряют в тех же условиях оптическую плотность (Ах) контрольного раствора. Концентрацию ионов меди в исследуемом растворе (Сх) рассчитывают по формуле:
|
|
|
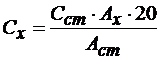 , мг/дм3,
, мг/дм3,
где Сст -концентрация ионов меди в стандартном растворе сравнения; Аст – оптическая плотность стандартного раствора;
Ах – оптическая плотность исследуемого раствора;
20 – коэффициент перевода 50см3 в 1 дм3.
Работа 2. Определение токсичных веществ в водках и питьевых спиртах методом газо-жидкостной хроматографии
Цель работы. Ознакомиться с методом газо-жидкостной хроматографии, рассчитать содержание токсичных веществ в водках и питьевых спиртах методом абсолютной градуировки и дать социальную оценку результата.
Сущность метода. Содержание исследуемых компонентов в водках и спиртах определяют методом газо-жидкостной хроматографии с пламенно-ионизационным детектором. Диапазон измеряемых концентраций: метилового спирта 0,005-0,1об.%,альдегидов 1,0-30 мг/дм3, сложных эфиров 10-100 мг/дм3, изоамилового спирта 3-60 мг/дм3. В водках и спиртах в зависимости от сорта и вида содержание метилового спирта должно быть не более 0,03-0,05 об.% количество альдегидов 2-15 мг/дм3, сложных эфиров 18-50 мг/дм3.
Аппаратура, материалы и реактивы. Хроматограф с пламенно-ионизационным детектором, микрошприц вместимостью 10 мкл; баллон с водородом ОСЧ с редуктором.
|
|
|
Стандартные растворы: уксусный альдегид – 1; 6; 4; 8; 20 мг в 1 дм3 безводного спирта; метиловый спирт – 0,05; 0,03 об.% в пересчете на безводный спирт; сивушные масла в пересчете на смесь изобутилового и изоамилового спиртов 3; 4; 15 мг в 1дм3 безводного спирта; спирт этиловый, метиловый, изомиловый и изобутиловый для хроматографии; уксусно-этиловый эфир и уксусный альдегид.
Условия проведения анализа. Колонка кварцевая капиллярная длиной 25-35 м, d=0,2-0,3 мм; неподвижная фаза - полиэтиленгликоль ПЭГ –20М; температура испарителя 1600С, температура детектора 1800С, расхода воздуха 115 см3/мин, расход водорода 35 см3/мин, величина сброса пробы после делителя потока газа-носителя 20 см3/мин, чувствительность электрометра при определении этилового спирта 1,0×10-9А, при определении остальных компонентов
2,0×10-12А, скорость диаграммной ленты 0,6 см/мин. Объем дозируемой пробы 1 мкл.
Порядок выполнения работы
1.Ознакомиться с методом газо-жидкостной хроматографии.
2.Готовят стандартный раствор анализируемых токсичных веществ.
3. Получают хроматограммы стандартных веществ.
4. Получают хроматограмму анализируемого объекта (водки или питьевого спирта) согласно варианта.
5. Проводят обработку стандартных хроматограмм (определить время удерживания стандартных веществ t Rст).
|
|
|
6.Проводят обработку хроматограммы исследуемого образца (определить время удержания (tRi) для всех компонентов). Результаты занести в таблицу.
7. Устанавливают наличие токсичных веществ в анализируемом образце (качественный анализ). Для этого сравнить время удерживания стандартных веществ с временем удерживания веществ на хроматограмме исследуемого образца.
8.Строят градуировочные графики h=f(С) для токсичных веществ.
9. Определяют высоты пиков (hi) определяемых токсичных веществ на хроматограмме исследуемого образца и найти количественное содержание их по соответствующему градуировочному графику.
10.Дают оценку полученного результата.
Таблица
Результаты хроматографического анализа
| Хроматограммы стандартных веществ | Хроматограмма анализируемого образца | |||||
| Наименование в-в | Время удерживания t Rст, мм | Номер пика | Время удерживания, tRi, мм | Результаты качественного анализа | Высота пика определяемого токсич. в-ва, hi, мм | Конц. токсич. в-ва, мг/дм3 или об.% |
| 1. | 1. | |||||
| 2. | 2. | |||||
| 3. | 3. | |||||
| 4. | 4. | |||||
Работа 3. Определение ионов цинка в водном растворе методом вольтамперометрии.
|
|
|
Цель работы. Количественное определение ионов цинка методом вольтамперометрии.
Сущность работы. Ионы цинка образуют в аммиачно-аммонийном буферном растворе комплексные ионы [Zn(NH3)4]2+, которые восстанавливаются на платиновом электроде, образуя одну волну на вольт-амперной кривой:
[Zn(NH3)4]2++2e–®Zn+4NH3.
Потенциал полуволны Е1/2 для этих ионов равен 1,36В относительно хлоридсеребряного электрода сравнения. Для количественного определения ионов цинка используют метод градуировочного графика.
Аппаратура, материалы, реактивы. Полярограф, электролитическая ячейка, индикаторный платиновый электрод, хлоридсеребряный электрод сравнения, магнитная мешалка с роликом, мерные колбы вместимостью 50 см3, пипетки вместимостью 1; 10 см3, мерный цилиндр вместимостью 15 см3, стандартный раствор соли Zn(CH3COO)2, Сст(Zn2+)=2мг/см3 (или стандартный раствор соли Сэкв =0,02 моль/дм3), насыщенный раствор сульфита натрия (Na2SO3), аммонийно-аммиачная буферная смесь.
Методика выполнения работы.
1. Подготавливают полярограф и электролитическую ячейку согласно инструкции к прибору.
2. Готовят серию стандартных растворов соли ацетата цинка для построения градуировочного графика. Для этого в 5 мерных колб вместимостью 50 см3 добавляют последовательно 1,00; 2,00; 3,00; 4,00; 5,00 см3 раствора ацетата цинка с концентрацией 2 мг/см3, по 10 см3 аммонийно-аммиачного буферного раствора, по 1 см3 насыщенного раствора Na2SO3 для удаления кислорода , доводят дистиллированной водой до метки и тщательно перемешивают.
3. Через 15-20 мин. выливают раствор в электролитическую ячейку и снимают вольт-амперные кривые.
4. Затем на вольт-амперных кривых измеряют высоты волн (h).
5. На основании полученных данных строят график зависимости высоты волны от концентрации.
6. Получают контрольный раствор в мерной колбе вместимостью 50 см3, добавляют 10 см3 буферного раствора, 1 см3 насыщенного раствора сульфита натрия, доводят до метки дистиллированной водой и тщательно перемешивают.
7. Через 15–20 минут снимают вольт-амперную кривую, измеряют на ней высоту волны hx и по градуировочному графику определяют концентрацию Zn2+ в контрольном растворе.
Работа 4. Определение нитратов в продукции растениеводства методом ионометрии.
Цель работы. Освоить метод прямой потенциометрии на примере определения нитратов в овощах и плодах.
Сущность метода. Ионометрическое определение нитратов основано на извлечении их из анализируемого образца раствором алюмокалиевых квасцов с последующим измерением концентрации с помощью нитрат-селективного электрода.
Аппаратура, материалы и реактивы. Нитратомер НМ–002; магнитная мешалка; нитрат – селективный электрод ЭМ – NO3 – 01; хлоридсеребряный электрод ЭВЛ- 1 МЗ (или каломельный); весы технические; колбы мерные, вместимостью 100 см3; стаканы, вместимостью 100-150см3; вода дистиллированная; раствор алюмокалиевых квасцов (КАl(SO4)2×12H2O), w=0,25%; раствор нитрата калия, С(KNO3) =0,1 моль/дм3.
Порядок выполнения работы.
1. Приготовление фонового электролита – раствора алюмокалиевых квасцов с массовой долей 0,25%: навеску 2,5 г алюмокалиевых квасцов растворяют в мерной колбе вместимостью 1 дм3.
2. Приготовление стандартных растворов: стандартные растворы нитрата калия с концентрацией 1×10-2; 1×10-3; 1×10-4 моль/дм3 готовят путем последовательного разбавления из раствора с концентрацией 1×10-1 моль/дм3.
2.1. Приготовление основного стандартного раствора нитрата калия с концентрацией 1×10-1 моль/дм3: 1,0110 г нитрата калия (предварительно высушенного при температуре 100±50С до постоянной массы) помещают в мерную колбу, вместимостью 100 см3 и доводят до метки дистиллированной водой.
2.2. Приготовление стандартного раствора нитрата калия с концентрацией 1×10–2 моль/дм3: отбирают 10 см3 раствора нитрата калия с концентрацией 1×10–1 моль/дм3, переносят в мерную колбу вместимостью 100 см3, доводят до метки раствором фона и тщательно перемешивают.
2.3. Приготовление стандартного раствора нитрата калия с концентрацией 1×10–3 моль/дм3 : отбирают 10 см3 раствора нитрата калия с концентрацией 1×10–2 моль/дм3, переносят в мерную колбу вместимостью 100 см3, доводят до метки раствором фона и тщательно перемешивают.
2.4. Приготовление стандартного раствора нитрата калия с концентрацией 1×10–4 моль/дм3: отбирают 10 см3 раствора нитрата калия с С(КNO3)= 1×10–3 моль/дм3, переносят в мерную колбу вместимостью 100 см3, доводят до метки раствором фона и тщательно перемешивают.
3. Градуировка прибора. Градуировку ионометрических каналов прибора для измерения концентрации нитрат – ионов проводят по стандартным растворам, согласно инструкции.
4. Подготовка пробы к анализу. Пробы продукции растениеводства, отобранные для анализа, измельчают с помощью мелкой терки до получения однородной массы. Зеленые культуры предварительно измельчают ножницами или ножом до размеров частиц 0,5-1 см.
5. Методика выполнения анализа 10 г измельченной пробы взвешивают с точностью до 0,1 г, помещают в стакан, приливают раствор алюмокалиевых квасцов (w=0,25%) до 100 см3 и перемешивают с помощью магнитной мешалки в течение 3 минут. Для определения содержания нитратов, приготовленные к работе нитратный и хлоридсеребряный электроды ополаскивают дистиллированной водой и опускают в анализируемый раствор. Считывают показания с табло прибора и умножают на 10. Полученная величина, показывает содержание нитратов в анализируемом образце в мг/кг.
6. Сравнивают полученные результаты с табличными данными (см. приложение, табл.4 «Допустимые уровни нитратов в плодоовощной продукции»).
7. Делают вывод о качестве анализируемого продукта.
Работа 5. Потенциометрическое определение содержания кобальта в растворе.
Цель работы. Освоить метод косвенной потенциометрии на примере определения ионов Со2+ в растворе.
Сущность работы. Оксидиметрическое определение кобальта основано на реакции окисления комплексных ионов кобальта (II), гексацианоферратом (III) калия в аммиачной среде:
Со2++6NH3®[Co(NH3)6]2+ (1)
[Co(NH3)6]2++[Fe(CN)6]3-®[Co(NH3)6]3++ [Fe(CN)6]4- (2)
Оборудование и реактивы. pН-метр (иономер), магнитная мешалка, индикаторный электрод-платиновый, электрод сравнения –хлоридсеребряный, стакан для титрования вместимостью 100-150 см3, бюретка вместимостью 25 см3, мерная колба вместимостью 50 см3, пипетка вместимостью 5 см3, раствор гексацианоферрата (III) калия, Сэкв=0,0500 моль/дм3.
Порядок выполнения работы.
1. Получают у лаборанта контрольный раствор.
2. Добавляют в контрольный раствор 10 см3 20% раствора хлорида аммония и 10 см3 25% раствора аммиака. Полученный раствор разбавляют дистиллированной водой до 60-70 см3.
3. Проводят ориентировочное титрование, добавляя рабочий раствор порциями по 0,50 см3. Данные титрования записывают в таблицу. Строят интегральную кривую титрования (зависимость электродного потенциала от объема титранта) и определяют область скачка на кривой титрования.
4. Проводят уточненное титрование, добавляя рабочий раствор по 0,10 см3 в области скачка на кривой титрования.
5. Данные титрования записывают в таблицу.
Таблица
Данные ориентировочного и уточненного титрований
| Ориентировочное | Уточненное | |||||
| V, см3 | Е, мВ | V, см3 | Е, мВ | DV, см3 | DЕ, мВ | DЕ/DV, мВ/см3 |
6. На основании полученных данных строят дифференциальную кривую потенциометрического титрования (зависимость DЕ/DV от объема титранта).
7. По дифференциальной кривой титрования определяют объем в конечной точке титрования.
8. Рассчитывают массу кобальта в контрольном растворе по формуле:
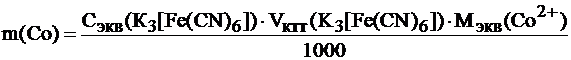
Мэкв(Со2+) – молярная масса эквивалента кобальта, г/моль; численно равна молярной массе кобальта, т.к. Z=1 (см. уравнение реакции (2)).
9. Рассчитывают абсолютную и относительную погрешность анализа.
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
1. Васильев В.П. Теоретические основы физико-химических методов анализа. – М.:Высшая школа, 1979. – 184 с.
2. Дорохова Е.Н., Прохорова Г.В. Аналитическая химия. Физико-химические методы анализа. – М.: Высшая школа, 1991. – 256 с.
3. Лурье Ю.Ю.Справочник по аналитической химии. – М.: Химия, 1989. – 440 с.
4. Ляликов Ю.С. Физико-химические методы анализа. – М.: Химия, 1974. – 536 с.
5. Ляликов Ю.С., Булатов М.И., Бодю В.И., Крачун С.В. Задачник по физико-химическим методам анализа. – М.: Химия, 1972, - 268с.
6. Основы аналитической химии. В 2 кн. Кн.1 Общие вопросы. Методы разделения. Кн.2. Методы химического анализа: Учебн. для вузов/Ю.А.Золотов, Е.Н.Дорохова, В.И.Фадеева и др.; Под ред.Ю.А.Золотова. – М.: Высшая школа, 1996. Кн.1, 383с., кн.2, 461с.
7. Пилипенко А.Т., Пятницкий И.В. Аналитическая химия, кн.1,2. – М.: Химия, 1990. Кн.1, 480с. Кн.2, 365с.
8. Плахотин В.Я. Контроль качества пищевых продуктов. – Киев: Урожай, 1988. – 144с.
9. Практическое руководство по физико-химическим методам анализа. Под ред.акад.Алимарина И.П. Изд.Московского университета, 1987. – 205с.
10. Физико-химические методы анализа./ Под ред.Алесковского В.Б. – Л.: Химия, 1988. – 376с.
11. Цитович И.К. Курс аналитической химии. – М.: Высшая школа, 1994. – 495с.
12. Чарыков А.К. Математическая обработка результатов химического анализа: Учеб.пособие для вузов. – Л.: Химия, 1984. – 168с.
Приложение
Таблица 1
Предел обнаружения в некоторых инструментальных
методах анализа
| Метод | Предел обнаружения, моль/дм3 | Метод | Предел обнаружения, моль/дм3 |
| Флуориметрия Классическая полярография Инверсионная вольтамперо-метрия Атомно-абсорбционный анализ Кулонометрия | 10-8 10-5 10-10 10-6 – 10-7 10-9 | Спектрофотометрия, в т.ч. фотоколориметрия Кондуктометрия, в т.ч. высокочастотное титрование Потенциометрия Амперометрическое титрование Рефрактометрия | 10-6 10-4 10-5 – 10-6 10-8 – 10-9 1% |
Таблица 2
Удельное вращение некоторых оптически активных веществ
в водных растворах
| Оптически активные вещества | Формула | [a]20D, град. |
    L-Молочная кислота
D – Винная кислота
L – Глюкоза
D – Фруктоза
Сахароза
Лактоза
Мальтоза L-Молочная кислота
D – Винная кислота
L – Глюкоза
D – Фруктоза
Сахароза
Лактоза
Мальтоза
| СН3-СН(ОН)-СООН НООО-СН(ОН)-СН(ОН)-СООН СН2(ОН)-(СН)4- С = О ОН Н СН2(ОН) -С – (СН)3 –СН2-СН О ОН С12Н22О11 С12Н22О11 С12Н22О11 | + 1,7 +12,0 +52,5 - 92,4 +66,5 +55,4 +130,4 |
Таблица 3
Состав и потенциал некоторых электродов сравнения
по отношению к нормальному водородному электроду (при 200С)
| Электрод сравнения | Состав электрода сравнения | Потенциал Е0ср, В |
| Хлоридсеребряный (Х-сер.Э) Ag[AgCl, Cl-] | Металлическое серебро, покрытое слоем AgCl, в растворе HCl или KCl при следующих концентрациях 0,1 М 1,0 М | +0,290 +0,226 |
| Каломельный (КЭ) Hg [Hg2Cl2, KCl] 1,0 (НКЭ) Насыщенный (нас.КЭ) | Металлическая ртуть, паста из металлической ртути и Hg2Cl2 в растворе KCl при следующих его концентрациях 1,0 М Насыщенный | +0,284 +0,247 |
Таблица 4
Допустимые уровни нитратов в плодоовощной продукции (мг/кг) и усредненное содержание влаги
| Продукт растениеводства | Содержание нитратов | Усредненное содержание влаги, w % |
| Картофель, морковь поздняя Капуста поздняя Капуста ранняя Морковь ранняя Томаты Огурцы Свекла столовая Лук репчатый Лук перо Кабачки Листовые овощи: щавель, салат, петрушка, сельдерей Перец сладкий Виноград столовых сортов | 250 500 900 400 150 150 1400 80 600 400 2000 200 60 | 88,5 90 90 88,5 93,5 95 86,5 86 90 90 90 92 80 |
Таблица 5
Эквивалентная электрическая проводимость ионов при бесконечном разбавлении и 250С
(См×см2/моль.экв.)
| КАТИОНЫ | l0+ | АНИОНЫ | l0- |
| Н+ К+ NH4+ 1/2PB2+ 1/3Fe3+ 1/2Ba2+ 1/2Ca2+ Na+ 1/2Cu2+ 1/2Zn2+ 1/2Mg2+ 1/2Fe2+ | 349,8 73,5 73,5 69,5 68,0 63,9 59,5 50,1 53,6 52,8 53,1 54,0 | ОН- 1/4Fe(CN)64- 1/3Fe(CN)63- 1/2SO42- 1/2CrO42- Br – I – Cl – NO3- CH3COO- HCO3- 1/2CO32- | 198,6 110,5 101,0 80,0 82,0 78,1 76,8 76,4 71,4 40,9 44,5 69,3 |
Таблица 6
Значение потенциалов полярографических полуволн
на ртутном капающем электроде
| Определяемый элемент | Состав фона | Изменение степени окисления | Потенциал полуволны Е1/2, В |
| Са2+ и другие щелочно- земельные металлы Cd2+ Co2+ Cr3+ Cr6+ Cu2+ Fe2+ Fe3+ K+ и другие щелочные металлы Pb2+ Sn2+ Sn4+ As3+ Zn2+ | В растворах солей тетраметиламмония 0,1н HCl 0,25 М KCl 0,1 М KCl 1 М КОН 1 М NH3+1M NH4Cl 1М Na2CO4 0,5 M (NH4)2C4H4O5+ 1 M NH3+0,005%жел. 0,1 М тетраметиламмоний 1 M KCl 1 M H2SO4 1 M HCl+ 4 M NH4Cl +0,005% жел. 1М H2SO4+0,01% жел. 1 М KCl, рН=3 | 2®0 2®0 2®0 3®2 2®0 6®3 1®2 1®0 3 2 3®2 2®0 1®0 2®0 2®0 4®2 2®0 3®0 2®0 | –2,22 –0,60 –1,2 –0,81 –1,50 –1,03 –0,25 –0,54 –0,24 –0,98 –1,53 –2,13 –0,43 –0,46 –0,25 –0,52 –0,70 –1,02 |
Таблица 7
Условия амперометрического титрования некоторых ионов
(а-анодный ток окисления, к-катодный ток восстановления)
| Ион, дающ. Iдиф | Электродн. реакция | E(Pt-го электрода относительно нас. КЭ), B | Фон | Титруемый ион | Титрант |
| Ag+ | к | –0,25 | HNO3, KNO3 | Cl–, Br–, J– | Ag+ |
| Fe2+ | а | +0,85 | H2SO4, HCl | Fe2+ | MnO4–, CrO42– |
| Ce4+ | к | +0,20 | HCl | Sn2+ | Ce4+ |
| Fe3+ | к | –0,25 | ≈ 1,2 М HCl | Fe3+ | аскорбиновая кислота |
| NO2– | а | +1,05 | 0,05 M H2SO4 | NO2– | MnO4–, Ce4+ |
| Pb2+ | к к | –0,85 +1,55 | CH3COONa CH3COONa | Pb2+ SO42– | Cr2O72– Pb2+ |
| J– | а | +0,75 | H2SO4, pH=1 | Hg2+ | J– |
| Br2 | к | +0,15 | 2M HCl | As3+, Sb3+ | BrO3– |
| Mn7+ | к | +0,55 | <8M H2SO4 | разл. восстановители, оксалат, V4+, Fe2+, As3+, Sb3+, и др. | MnO4– |
Таблица 8
Значение Q-критерия
| f P | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 0,95 | 0,94 | 0,77 | 0,64 | 0,56 | 0,51 | 0,48 | 0,46 | 0,45 |
| 0,99 | 0,99 | 0,89 | 0,76 | 0,70 | 0,64 | 0,58 | 0,53 | 0,48 |
Таблица 9
Значение коэффициента Стьюдента t для
различной доверительной вероятности
| Число степеней свободы | Доверительная вероятность | ||
| 0,90 | 0,95 | 0,99 | |
| 1 2 3 4 5 6 7 8 9 10 | 6,31 2,92 2,35 2,13 2,02 1,94 1,90 1,86 1,83 1,81 | 12,17 4,30 3,18 2,78 2,57 2,45 2,37 2,31 2,26 2,23 | 63,66 9,93 5,84 4,60 4,03 3,75 3,50 3,36 3,25 3,17 |
Таблица 10
Значение F для уровня значимости р=0,05
| f1 f2 | 1 | 2 | 3 | 4 | 5 | 6 | 12 | 24 |
| 1 2 3 4 5 6 7 8 9 10 | 64,4 18,5 10,1 7,7 6,6 6,0 5,6 5,3 5,1 5,0 | 199,5 19,2 9,6 6,9 5,8 5,1 4,7 4,5 4,3 4,1 | 215,7 19,2 9,3 6,6 5,4 4,8 4,4 4,1 3,9 3,7 | 224,6 19,3 9,1 6,4 5,2 4,5 4,1 3,8 3,6 3,5 | 230,2 19,3 9,0 6,3 5,1 4,4 4,0 3,7 3,5 3,3 | 234,0 19,3 8,9 6,2 5,0 4,3 3,9 3,6 3,4 3,2 | 244,9 19,4 8,7 5,9 4,7 4,0 3,6 3,3 3,1 2,9 | 249,0 19,5 8,7 5,8 4,5 3,8 3,4 3,1 2,9 2,7 |
ОГЛАВЛЕНИЕ
Общие методические указания. 3
1. Классификация инструментальных методов анализа. 4
1.1. Прямые инструментальные методы анализа. 5
1.2. Косвенные инструментальные методы анализа. 7
2. Примеры решения типовых задач по физико-химическим методам анализа 8
2.1. Оптические методы анализа. 9
2.2. Электрохимические методы анализа. 14
2.3. Хроматографические методы анализа. 19
2.4. Метрологические характеристики физико-химических методов анализа 21
3. Контрольная работа №1. 24
4. Контрольная работа 2. 32
5. Лабораторные работы по физико-химическим методам анализа. 50
Работа 1. Фотоколориметрический метод определения ионов меди в водных растворах. 50
Работа 2. Определение токсичных веществ в водках и питьевых спиртах методом газо-жидкостной хроматографии. 51
Работа 3. Определение ионов цинка в водном растворе методом вольтамперометрии. 53
Работа 4. Определение нитратов в продукции растениеводства методом ионометрии. 54
Работа 5. Потенциометрическое определение содержания кобальта в растворе. 55
Приложение. 58
Сизова Любовь Сергеевна, Гуськова Валентина Петровна,
Микилева Галина Николаевна
Аналитическая химия
(физико-химические методы анализа),
часть II
Редактор: Л. Г. Барашкова
Художественный редактор: Л.П. Токарева
Подписано к печати 20.02.03 г. Формат 60 ´ 90 1/16.
Объем 4,0 п.л. Тираж 1200 экз. Заказ №
Кемеровский технологический институт
пищевой промышленности,
650056, г. Кемерово, 56, б-р Строителей, 47.
Отпечатано на ризографе.
Отпечатано в лаборатории множительной техники КемТИППа.
650010, г. Кемерово, 10, ул. Красноармейская, 52. Цена
Дата добавления: 2018-04-15; просмотров: 619; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
