Хроматографические методы анализа
Пример 13.Рассчитайте содержание веществ (в %) в анализируемой смеси, если площади пиков (см2) на хроматограмме равны: для гексана – 15,41; бензола – 6,75; этанола – 35,18; этилацетата – 10,51. Поправочные коэффициенты равны соответственно 0,70; 1,00; 0,64; 0,79.
Решение.Анализ проведён газовой хроматографией, методом внутренней нормировки (разд. 4.2.1, часть I). Содержание каждого компонента рассчитываем по формуле (4.7, часть I):
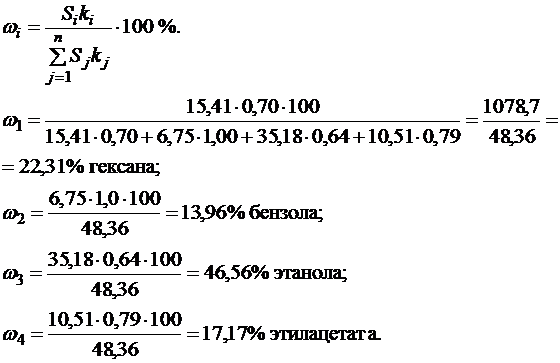
Пример 14.Рассчитайте объем раствора нитрата меди (II) с молярной концентрацией эквивалента 0,0500 моль/дм3, который можно пропустить через 25 см3 набухшего катионита КУ–2 до момента проскока ионов Cu2+. Динамическая обменная емкость (ДОЕ) катионита равна 2,6 ммоль/см3.
Решение.ДОЕ = 2,6 ммоль/см3, т.е. 1 см3 ионита может поглотить 2,6 ммоль эквивалентов нитрата меди, следовательно 25см3 набухшего ионита поглотят:
nэкв(Сu(NO3)2)=2.6·25=67,0 ммоль=0,067 моль.
Так как nэкв(Сu(NO3)2)=Сэкв(Сu(NO3)2)·V(Cu(NO3)2), то
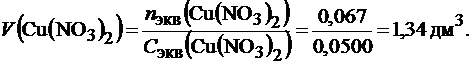
Пример 15.При разделении смеси аминокислот методом бумажной хроматографии были получены три пятна с площадью S1=0,78см2, S2=0,92см2, S3=0,54см2. Пробег пятен равен соответственно l1=10, l2= 13, l3= 15см.
Установить качественный состав анализируемой смеси и рассчитать количественное содержание каждого компонента, если пробег растворителя равен 20 см, а пробег пятен свидетелей – глицина, аланина, серина, валина, лизина – равен соответственно 11,0; 10,5; 13,0; 15,0; 10 см.
Решение.Качественный анализ в БХ проводят по величине Rf (раздел 4.3.2, часть 1):
|
|
|
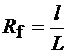 .
.
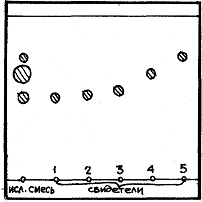
Хроматограмма исследуемой смеси со свидетелями–стандартами.
Так как разделение проводили одновременно на одной полосе бумаги, то качественный анализ можно оценить по длине пробега пятен.
1-й компонент – лизин, так как l1=lлизина. 2-й компонент – серин, так как l2=lсерин, 3-й компонент – валин, l3=lвалин. Количественное содержание каждого компонента можно рассчитать по формуле (4.6, часть I):
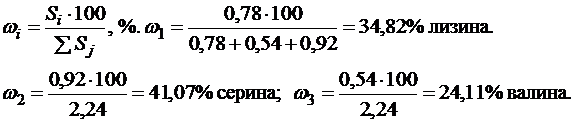
Метрологические характеристики физико-химических методов анализа
Пример 16.Молярная концентрация ионов меди в растворе равна 1·10–7 моль/дм3. Каким из физико-химических методов анализа – инверсионной вольтамперометрией, фотоколориметрией или кондуктометрией – можно установить его точную концентрацию?
Решение.Для решения этой задачи используем справочные данные по пределу обнаружения в указанных методах (приложение, табл. 1). Чтобы с достаточной точностью определить количественное содержание компонента необходимо, чтобы концентрация его в растворе была выше предела обнаружения данным методом (Смин) не менее чем в 10-15 раз. В данной задаче Сх равно 1·10–7 моль/дм3, что ниже предела обнаружения в фотоколориметрии и кондуктометрии. Можно использовать инверсионную вольтамперометрию, так как Сх>Смин в 100 раз.
|
|
|
Пример 17.При определении содержания хлорид-ионов в минеральной воде методом потенциометрии были получены следующие результаты (мг/дм3): 650,2; 660,8; 654,2; 649,8; 650,1; 649,9; 630,8. Рассчитайте среднее содержание хлорид-ионов в воде, интервальные значения измеряемой величины.
Решение.Прежде чем рассчитывать среднее содержание хлорид-ионов, следует проверить наличие грубых погрешностей. Для этого можно использовать Q-критерий (уравнение 1.12, часть I). Расположим полученные результаты измерений в порядке возрастания их величины и для каждого рассчитаем экспериментальный Q-критерий; например:
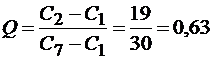 .
.
| С, мг/дм3 | 630,8 | 649,8 | 649,9 | 650,1 | 650,2 | 654,2 | 660,8 |
| Qэксп | 0,63 | 0,003 | 0,007 | 0,003 | 0,13 | 0,22 |
Полученные значения сравниваем с табличным значениям Q (приложение, табл. 5) для Р = 0,95 и f = n – 1 = 7 – 1 = 6; Qтабл=0,56.
Так как Qэксп.1 > Qтабл результат 630,8 следует признать недостоверным и исключить из дальнейших расчетов.
Среднее содержание хлоридов в минеральной воде рассчитываем из шести оставшихся результатов, по формуле (1.5, часть 1):
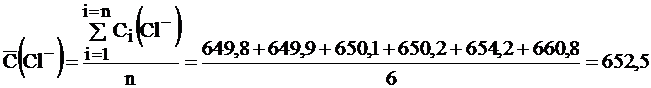 Рассчитываем стандартное отклонение по формуле (1.7, часть 1):
Рассчитываем стандартное отклонение по формуле (1.7, часть 1):
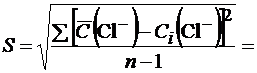
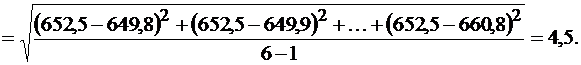
Доверительный интервал рассчитываем по уравнению (1.10, часть 1): 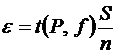 . Для P = 0,95 и f = n – 1= 6: t (P, f)= 2,57 (приложение, табл. 9),
. Для P = 0,95 и f = n – 1= 6: t (P, f)= 2,57 (приложение, табл. 9),
|
|
|
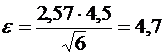 мг/дм3.
мг/дм3.
Следовательно, содержание хлоридов в минеральной воде равно:
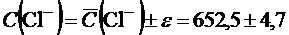 мг/дм3.
мг/дм3.
Пример 18.Определить по критерию Фишера и t-критерию существует ли значимое различие между данными определения содержания ионов магния в яблочном соке методом кондуктометрического и фотоэлектрического титрования:
| № | 1 | 2 | 3 | 4 | 5 | 6 |
| С1(Mg2+), ммоль/дм3 | 2,05 | 2,20 | 2,13 | 2,21 | 2,15 | 2,31 |
| С2(Mg2+), ммоль/дм3 | 2,09 | 2,18 | 2,13 | 2,11 | 2,20 | 2,19 |
Решение.По данным задачи число определений в каждом случае равно n1=6; n2=6. Для расчета критерия Фишера необходимо знать численное значение среднего результата определений 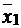 и
и 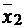 и дисперсии S21 и S22. Средний результат определений рассчитываем по формуле (1.5, часть 1):
и дисперсии S21 и S22. Средний результат определений рассчитываем по формуле (1.5, часть 1):
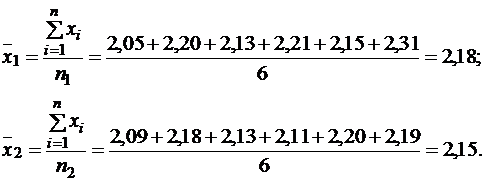
Дисперсии можно рассчитать по формуле (1.6, часть 1):
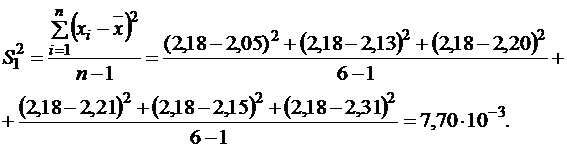

Аналогично вычисляем S22; S22 = 2,65×10-3.
Экспериментальный критерий Фишера рассчитываем по формуле (1.17, часть 1):
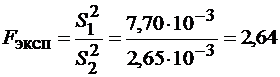 ,
,
где S1 – бóльшая по величине дисперсия.
Сравниваем Fэксп с Fтабл (приложение, табл. 10); Fтабл для Р=0,95 и f1 = n1 – 1 = 6 – 1 = 5 и f2 = n2 – 1=5 равно 5.1.
Так как Fэксп<Fтабл различие не является значимым. Рассчитаем, есть ли статистически значимое различие в средних результатах кондуктометрического и фотоэлектрического титрования. Средневзвешенное стандартное отклонение рассчитываем по формуле (1.18, часть 1):
|
|
|
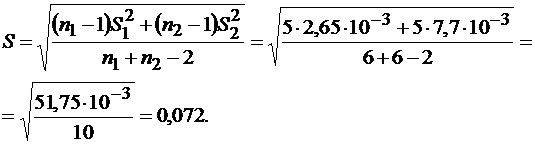
Коэффициент Стьюдента или t-критерий рассчитываем по формуле (1.19, часть 1):
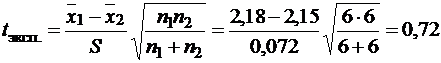 .
.
Сравниваем полученное значение с табличным значением коэффициента Стьюдента для P=0,95 и числа степеней свободы f=n1+n2–2=6+6–2=10 (приложение, табл. 9): tтабл=2,23. Так как tэксп<tтабл разница между средними результатами обоих титрований незначима и обе выборки можно считать принадлежащими одной генеральной совокупности с числом определений, равным n=n1+n2.
Контрольная работа №1
Вариант 1
1. Какие электроды в потенциометрическом методе анализа называют индикаторными? Какие из них можно использовать при определении рН раствора?
2. На каком явлении основан метод молекулярной абсорбционной спектроскопии? В какой области спектра его используют?
3. Какое явление называется люминесцентным излучением и какова его природа?
4. В чем сущность метода классической полярографии? Из чего состоит электролитическая ячейка в данном методе?
5. Охарактеризуйте метод высокоэффективной жидкостной хроматографии.
6. Почему световой луч преломляется на границе раздела двух сред? Какой величиной характеризуют способность среды к преломлению и как она зависит от концентрации?
7. На каких явлениях основано хроматографическое разделение веществ? Как классифицируют методы хроматографии по агрегатному состоянию фаз?
8. Какой вид имеет кривая кондуктометрического титрования соляной кислоты раствором гидроксида натрия? Как определяют объем в конечной точке титрования и рассчитывают массу соляной кислоты в растворе? Укажите используемые в данном методе приборы и электроды?
9. Какими способами рассчитывают количественное содержание вещества в методе пламенной эмиссионной фотометрии?
10. Какие вещества, концентрация которых указана в таблице, не могут быть определены методом высокочастотного титрования?
| вещество | C, моль/дм3 | Вещество | C, моль/дм3 |
| HCl | 1·10-8 | MgSO4 | 2·10-6 |
| NaOH | 3·10-3 | AgNO3 | 4·10-2 |
11. В чем заключается сущность метода радиометрического титрования? Какой вид имеют графики радиометрического титрования? Приведите пример.
ВАРИАНТ 2
1. Какие индикаторные электроды используют в ионометрии? Объясните принцип их работы.
2. На чем основаны качественный и количественный люминесцентный анализ?
3. Сформулируйте основной закон светопоглощения. Запишите его математическое выражение. Какова зависимость оптической плотности от различных факторов?
4. Приведите примеры количественного полярографического анализа (метод градировочного графика и метод стандартов).
5. Укажите назначение основных узлов газового хроматографа. Начертите его блок-схему.
6. Как зависит показатель преломления в рефрактометрии от температуры, давления и длины волны света?
7. Какой вид имеет кривая кондуктометрического титрования нитрата бария раствором сульфата натрия? Покажите как определяют на ней эквивалентный объем и напишите расчетную формулу массы сульфата бария в растворе. Какие приборы и электроды используют в данном методе?
8. Приведите схему пламенного фотометра. Укажите назначение основных его узлов.
9. Назовите подвижные и неподвижные фазы, используемые в бумажной хроматографии. Как проявляют бумажные хроматограммы?
10. Каким из методов- фотоколориметрическим или кондуктометрическим - можно определить дихромат-ионы в растворе, если их концентрация равна 1·10–5 моль/дм3?
11. Каково устройство и принцип работы ионизационного детектора - счетчика, используемого в радиометрических методах анализа?
ВАРИАНТ 3
1. Какой вид имеют кривые потенциометрического титрования при использовании реакций осаждения? Какие факторы влияют на величину скачка на кривой титрования? Приведите пример.
2. Какую величину называют коэффициентом пропускания в спектрофотометрии? В каких пределах изменяется эта величина и от каких факторов она зависит?
3. На чем основан люминесцентный метод анализа? Приведите классификацию люминесцентных методов анализа по способам возбуждения.
4. В чем заключается сущность качественного полярографического анализа? Привести пример.
5. Как классифицируют методы хроматографии в зависимости от природы процесса разделения?
6. На чем основан количественный рефрактометрический анализ при использовании удельных рефракций?
7. Что называют обменной емкостью ионита? В каких условиях ее измеряют? От каких факторов она зависит?
8. Дайте характеристику метода высокочастотного титрования. Укажите типы используемых в этом методе ячеек.
9. Дайте краткую характеристику метода атомной абсорбционной спектроскопии.
10. Какие ионы, концентрации которых указаны в таблице, могут быть определены методом фотоколориметрии?
| ион | C, моль/дм3 | ион | C, моль/дм3 |
| Fe2+ | 1·10-8 | MnO4– | 2·10-6 |
| Fe3+ | 3·10-3 | Cr2O72– | 4·10-2 |
11. Как можно количественно определить методом радиометрического титрования ионы Ba2+? Укажите титрант, начертите кривую титрования, напишите расчетную формулу.
ВАРИАНТ 4
1. Какие типы электрохимических ячеек используют в высокочастотной кондуктометрии?
2. Начертите принципиальную схему флуориметра; назовите основные его узлы и укажите их назначение.
3. Какой вид имеет кривая фотоэлектрического титрования сульфата железа (II) раствором перманганата калия? Покажите как определяется по этой кривой эквивалентный объем, напишите формулу расчета массы FeSO4 в растворе. С каким светофильтром следует вести титрование?
4. Какие условия следует соблюдать при проведении полярографического анализа?
5. Основные типы детекторов, применяемых в газовой хроматографии. Объясните принцип действия детектора по электронному захвату.
6. На чём основан количественный рефрактометрический анализ при использовании градуировочного графика?
7. Какие индикаторные электроды можно использовать при потенциометрическом титровании смеси соляной и уксусной кислот раствором щелочи? Какой вид имеет кривая титрования? Как можно рассчитать содержание каждой кислоты?
8. Какие типы катионитов используют в ионообменной хроматографии? Привести пример, написать уравнение ионообменной реакции.
9. Начертите схему установки для атомно-абсорбционного анализа. Укажите назначение основных узлов.
10. Каким методом (потенциометрическим или кулонометрическим) можно определить концентрацию ионов меди, равную 2,5·10–8 моль/дм3?
11. Дайте характеристику радиохимического метода изотопного разбавления.
ВАРИАНТ 5
1. Как проводят количественный флуориметрический анализ методами добавок и ограничивающих растворов?
2. Укажите способы нахождения объема в конечной точке титрования(Vктт) в методе потенциометрии.
3. Как проводят регенерацию ионитов в ионообменной хроматографии?
4. Какие факторы и как влияют на величину диффузионного тока в полярографии (уравнение Ильковича)?
5. Что называют спектром поглощения в молекулярном абсорбционном анализе, в каких координатах его можно представить, для чего его используют? Привести пример.
6. На чем основан принцип работы катарометра и пламенно-ионизационного детектора в газовой хроматографии?
7. Покажите на рисунке преломление светового луча при переходе его из среды оптически менее плотной в более плотную. Объясните возникновение границы светотени в рефрактометре.
8. В чем заключается сущность кондуктометрического метода анализа? Дать определение удельной и молярной электропроводности, указать факторы, которые влияют на их величину.
9. Как проводят количественное определение веществ в атомно-абсорбционной спектроскопии? Какие источники света и атомизаторы используют в этом методе?
10. Можно ли методами рефрактометрии и фотоколориметрии определить сахар в растворе, массовая доля которого равна 0,01%? Свой ответ обоснуйте.
11. Дайте характеристику радиоактивационных методов анализа.
ВАРИАНТ 6
1. Как проводят выбор светофильтров в спектрофотометрии? Ответ обоснуйте.
2. На чем основан количественный флуориметрический анализ? Дайте характеристику метода градуировочного графика и метода сравнения.
3. Охарактеризуйте методы качественного анализа компонентов в высокоэффективной жидкостной хроматографии.
4. В каких реакциях можно использовать электроды первого рода при потенциометрическом титровании? Приведите конкретные примеры и напишите уравнение Нернста для этих электродов.
5. Приведите примеры количественного полярографического анализа: метод добавок и расчетный метод.
6. Какие приборы применяют в рефрактометрии? Начертите оптическую схему одного из них, объясните принцип его работы.
7. Какой вид имеет кривая кондуктометрического титрования смеси уксусной и соляной кислот раствором гидроксида натрия? Объясните вид кривой титрования. Как определяют объем в конечной точке титрования и рассчитывают массу определяемых компонентов?
8. Охарактеризуйте метод абсолютной градуировки в газовой хроматографии.
9. Дайте краткую характеристику метода эмиссионной пламенной фотометрии.
10. В каком растворе может быть точно определена концентрация свинца методом фотоколориметрии, если С1=1·10–5; С2=1·10–8; С3=1·10–4 моль/дм3?
11. На каких механизмах взаимодействия излучений с веществом основаны важнейшие методы регистрации в радиометрических методах анализа?
ВАРИАНТ 7
1. Дайте характеристику поляриметрического метода анализа.
2. Какое явление в люминесцентном анализе называют смещением Стокса? Объясните его причину.
3. Дайте краткую характеристику метода ионообменной хроматографии. Какие подвижные и неподвижные фазы в ней используют ? Напишите реакции ионного обмена.
4. Как проводят количественный анализ веществ в пламенной фотометрии методом градуировочного графика?
5. Какие индикаторные электроды применяют при потенциометрическом титровании с использованием реакций окисления-восстановления? Приведите пример.
6. Какой вид имеет вольтамперная кривая? Указать основные ее характеристики. Какие из них используются в качественном и количественном полярографическом анализе?
7. Начертите оптическую схему электрофотоколориметра. Укажите назначение основных его узлов.
8. Укажите основные параметры хроматографического пика. Какие из них используют в качественном и количественном анализе?
9. Какой вид имеет кривая кондуктометрического титрования раствора гидроксида аммония серной кислотой? Покажите как определяют на ней эквивалентный объем и напишите формулу для расчета массы гидроксида аммония в растворе. Какие приборы и электроды используют в данном методе анализа?
10. Точную концентрацию каких ионов, приведенных в таблице, можно определить методом инверсионной вольтамперометрии?
| ион | C, моль/дм3 | ион | C, моль/дм3 |
| Sn2+ | 1·10–10 | Pb2+ | 2·10-6 |
| Ni2+ | 1·10–9 | Ag+ | 4·10-2 |
11. В чем сущность и каковы особенности нейтронно-активационного анализа.
ВАРИАНТ 8
1. Охарактеризуйте прямые методы фотометрического анализа: метод добавок и сравнения.
2. Какое явление называют тушением люминесценции? Укажите его виды.
3. Дайте характеристику метода тонкослойной хроматографии.
4. В чем заключается сущность амперометрического титрования? Какие электроды используют в этом методе?
5. Как проводят количественное определение веществ в газовой хроматографии методами нормировки?
6. Какой вид имеет кривая кондуктометрического титрования соляной кислоты раствором гидроксида аммония? Объясните вид кривой титрования. Как определяют объем в конечной точке титрования и рассчитывают массу определяемого вещества? Какие приборы и электроды можно использовать для данного титрования?
7. Какие индикаторные электроды можно использовать в реакциях комплексообразования при потенциометрическом титровании? Приведите пример, обоснуйте выбор электродов.
8. Что называют абсолютным и относительным показателями преломления в рефрактометрии? Для анализа каких веществ используют этот метод в пищевой промышленности?
9. Какова природа происхождение атомных спектров?
10. Каким из методов – кондуктометрией, потенциометрией или инверсионной вольтамперометрией можно определить ионы цинка, концентрация которых в растворе равна 1·10–8 моль/дм3?
11. Укажите типы радиоактивных превращений, используемых в радиометрических методах анализа.
ВАРИАНТ 9
1. В чем заключается физический смысл молярного коэффициента светопоглощения? От каких факторов зависит его величина?
2. Дать определение квантового и энергетического выходов в люминесцентном анализе. Что они характеризуют? От каких факторов зависит интенсивность люминесценции?
3. Как определяют концентрацию вещества в атомно-абсорбционной спектроскопии с помощью одного стандартного раствора?
4. Какова классификация ионитов по характеру входящих в их структуру ионогенных групп? Приведите примеры.
5. В каких реакциях можно использовать ионоселективные электроды при потенциометрическом титровании? Ответ обоснуйте.
6. Какой вид имеет кривая амперометрического титрования FeSO4 раствором дихромата калия (электродноактивными являются ионы Fe2+)? Объясните кривую титрования. Как определяют объем в конечной точке титрования и рассчитывают массу определяемого вещества? Какие электроды можно использовать при этом определении?
7. Как проводят качественный анализ веществ в газовой хроматографии?
8. Дайте характеристику явления рефракции. Покажите на рисунке как преломляется луч при переходе из оптически более плотной среды в менее плотную.
9. Какой вид имеет кривая кондуктометрического титрования смеси гидроксида калия и гидроксида аммония раствором соляной кислоты? Укажите используемые при этом электроды и приборы. Как определяют объем в конечной точке титрования и рассчитывают массу определяемых веществ?
10. Какие ионы с указанной ниже концентрацией можно определить методом амперометрического титрования?
| ион | C, моль/дм3 | ион | C, моль/дм3 |
| Ba2+ | 1·10-6 | Fe2+ | 3·10-10 |
| H+ | 4·10-8 | Cl– | 1·10-3 |
11. Каково устройство и принцип работы сцинтилляционных счетчиков, используемых для регистрации излучений в радиометрических методах анализа?
ВАРИАНТ 10
1. Какая величина называется оптической плотностью и от каких факторов она зависит?
2. Дать определение удельной и эквивалентной электропроводности. Указать от каких факторов и каким образом зависит их величина.
3. Дайте характеристику количественного определения веществ в газовой хроматографии методом внутреннего стандарта.
4. Какой вид имеют кривые потенциометрического титрования смеси веществ в реакциях осаждения? Как по ним определяют эквивалентный объем? Приведите пример.
5. Какой вид имеет спектр люминесценции? Что является качественной и количественной характеристикой вещества в этом спектре?
6. Что такое характеристические частоты, какова их роль в качественном анализе методом ультрафиолетовой спектроскопии?
7. Какие иониты называют слабокислотными и слабоосновными? В каких средах (кислой, нейтральной или щелочной) их лучше использовать в методе ионообменной хроматографии? Почему?
8. Как меняется показатель преломления с изменением концентрации? Где используют эту зависимость в рефрактометрическом методе анализа и при анализе каких продуктов?
9. В чем сущность метода инверсионной вольтамперометрии? Чем обусловлена высокая чувствительность этого метода?
10. Какими из методов: фотоколориметрией, кондуктометрией или потенциометрией можно определить концентрацию иодид-ионов в растворе, равную 4·10–5 моль/дм3?
11. Как можно количественно определить методом радиометрического титрования ионы SO42–? Начертите кривую титрования. Покажите, как можно определить на ней эквивалентный объем. Напишите расчетную формулу массы SO42–.
Контрольная работа 2
ВАРИАНТ 1
1. Рассчитайте молярную концентрацию исследуемого водного раствора (Сх) этиленгликоля по следующим данным рефрактометрического анализа: для стандартного раствора ωст=50%, n20D=1,3831; для исследуемого раствора: n20D= =1,3546; ρ=1,050 г/см3.
2. Для определения статической обменной емкости катионита, находящегося в H+-форме, к 2 г его добавили 25,00 см3 раствора хлорида натрия с молярной концентрацией 0,3500 моль/дм3. После установления равновесия ионит отделили фильтрованием, промыли небольшим количеством дистиллированной воды. Анализируемый раствор и промывные воды объединили и полученную смесь оттитровали 15,70 см3 раствора щелочи NaOH с молярной концентрацией, равной 0,5000 моль/дм3. Рассчитайте обменную емкость катионита.
3. При определении калия в молоке методом фотометрии пламени были получены следующие результаты (мг/100г): 146,0; 144,2; 150,0; 149,1; 149,8; 150,0; 130,0; 146,0. Рассчитайте среднее содержание калия в исследуемом образце и интервальные значения измеряемой величины.
4. Для определения содержания нитрит-ионов в воде 10,00 см3 анализируемой пробы разбавили в мерной колбе до 100 см3. 1 см3 стандартного раствора, содержащего 0,1500 г нитрита натрия в 1 дм3 разбавили водой до 100 см3. После обработки обоих растворов реактивом Грисса измерили оптическую плотность полученных окрашенных растворов, которая оказалась равной 0,44 и 0,40 соответственно. Вычислить содержание нитрит-ионов в воде (мг/дм3).
5. Для потенциометрического определения содержания ионов натрия в молоке с помощью Na-селективного электрода приготовили серию стандартных растворов и измерили электродный потенциал:
| С, моль/дм3 | 0,001 | 0,005 | 0,01 | 0,05 | 0,1 |
| Е, мВ | –38 | 4 | 20 | 63 | 78 |
Электродный потенциал в исследуемой пробе молока был равен 42мВ. Определите содержание ионов натрия (мг/дм3) в молоке.
6. 100 см3 фруктового сока оттитровали раствором комплексона с молярной концентрацией эквивалента, равной 0,0310 моль/дм3. Рассчитать содержание магния (мг/дм3), используя результаты высокочастотного титрования:
| V(ЭДТА), см3 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| I, мА | 26 | 25 | 23 | 21 | 19 | 17 | 16 | 14 | 13 | 14 | 16 | 17 | 19 |
7. Рассчитайте общую массовую долю примесей в фальсифицированном спирте по данным, полученным с помощью газовой хроматографии:
| Компоненты смеси | Площадь пика, S, мм | Поправочный коэффициент, k |
| Этанол Пропанол Метанол Ацетальдегид Вода | 115,1 3,2 1,3 1,5 5,8 | 0,84 0,72 1,00 0,90 1,10 |
8. При анализе серии стандартных растворов тиамина методом флуориметрии были получены следующие данные:
| C, мкг/см3 | 1,0 | 2,0 | 3,0 | 4,0 | 5,0 |
| Показания прибора | 0,32 | 0,44 | 0,55 | 0,67 | 0,78 |
Чему равна массовая доля тиамина в пищевом продукте, если из 10 г его были получено 100 см3 раствора и интенсивность флуоресценции, измеренная в тех же условиях, была равна 0,46.
9. При полярографировании насыщенного раствора Pb(SCN)2 высота полярографической волны составила 15,0 мм. Стандартный раствор ацетата свинца с молярной концентрацией эквивалента 0,0250 моль/дм3 имел высоту волны 21,9 мм. Рассчитать произведение растворимости тиоцианата свинца
10. Какие из представленных зависимостей соответствуют методу фотоэлектрического титрования?
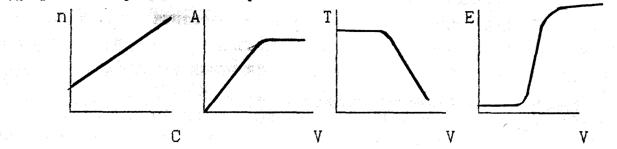
Назовите применяемые в этом методе приборы, измеряемую на них величину, единицы её измерения. Покажите на выбранных кривых как можно определить эквивалентный объём.
ВАРИАНТ 2
1. При определении содержания кальция в молоке 50,00 см3 молока оттитровали рабочим раствором комплексона с молярной концентрацией эквивалента 0,0830 моль/дм3. Были получены следующие результаты потенциометрического титрования:
| Vкомплексона, см3 | 0 | 5 | 10 | 15 | 17 | 18 | 19 | 20 | 21 | 24 |
| Е, мВ | 260 | 276 | 288 | 312 | 320 | 440 | 450 | 455 | 460 | 463 |
Постройте интегральную кривую по результатам титрования в координатах (Е-V),рассчитайте содержание кальция в мг/дм3. Напишите уравнение химической реакции, предложите электроды для данного титрования.
2. Для анализа озолили 100 см3 молока и полученную золу растворили в 10см3 соляной кислоты. Полученный раствор перенесли в мерную колбу, вместимостью 100см3, и довели до метки фоновым электролитом. Затем приготовили стандартный раствор, содержащий 5мг меди в 100 см3. При последовательном полярографировании полученных растворов высоты волн равнялись 16,0 и 26,5 мм соответственно. Рассчитайте содержание меди в молоке ( в мг/дм3).
3. При определении жира в порошке какао была взята навеска 1,500 г и обработана 2,50 см3 монобромнафталина с показателем преломления 1,6570. После извлечения жира показатель преломления уменьшился до 1,6420. Определить массовую долю жира в какао, если показатель преломления чистого жира какао равен 1,4630, а плотность его 0,9264 г/см3.
4. При фотоколориметрическом определении ионов железа с сульфосалициловой кислотой из стандартного раствора с содержанием железа 10 мг/см3 приготовили ряд растворов методом разбавления в мерных колбах вместимостью 50 см3 и измерили их оптическую плотность:
| Vст. р-ра, см3 | 1,0 | 2,0 | 3,0 | 4,0 | 5,0 |
| А | 0,12 | 0,25 | 0,37 | 0,50 | 0,62 |
Чему равна молярная концентрация контрольного раствора хлорида железа, если его оптическая плотность, измеренная в этих же условиях равна 0,48?
5. Сопротивление ячейки в растворе хлорида натрия равно 51,2 Ом. Площадь каждого электрода равна 2,0 см2, а расстояние между ними 1 см. Рассчитайте удельную электропроводность раствора и его концентрацию, если эквивалентная электропроводность равна 110 См·см2·моль–1.
6. Для люминесцентного определения рибофлавина (витамина В2) в пищевом продукте методом добавок 0,1500 г продукта, растворили и после соответствующей обработки измерили интенсивность люминесценции полученного раствора. Она оказалась равной 25. После добавления стандартного раствора, содержащего 26 мкг витамина В2 интенсивность люминесценции увеличилась до 60. Определите массовую долю витамина В2 в продукте, если интенсивность люминесценции холостого раствора равна 12.
7. Сколько граммов никеля останется в растворе, если через колонку, заполненную 10,00 г катионита, пропустили 500,00 см3 раствора соли никеляс молярной концентрацией 0,05 моль/дм3? Полная динамическая емкость катионита в данных условиях 1,4 ммоль/г.
8. При вольтамперометрическом определении меди в томатном соке в двух лабораториях были получены результаты (мг/кг):
Лаборатория №1: 0,28; 0,26; 0,22; 0,26; 0,24;0,23
Лаборатория №2: 0,27; 0,24; 0,28; 0,26; 0,26; 0,25; 0,25
Определить по t-критерию существует ли значимое различие между данными анализа обеих лабораторий.
9. Реакционную массу после нитрования толуола проанализировали методом газожидкостной хроматографии с применением этилбензола в качестве внутреннего стандарта. Определить массовую долю непрореагировавшего толуола по экспериментальным данным: навеска реакционной массы 12,7500 г, внесено этилбензола 1,2530 г, площадь пика толуола 307 мм2, поправочный коэффициент для толуола 1,01, площадь пика этилбензола 352 мм2, поправочный коэффициент 1,02.
10. Какая из предложенных кривых соответствует амперометрическому титрованию? Назовите прибор, используемый в этом методе анализа, измеряемую на нем величину, единицу её измерения. Покажите на выбранной кривой, как определяется эквивалентный объём.
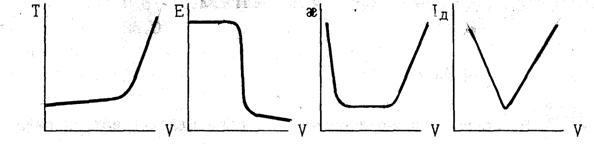
ВАРИАНТ 3
1. Определите содержание этанола в фальсифицированной водке, если её показатель преломления равен 1,3610, а показатели преломления стандартных растворов имели следующие значения:
| ωоб., % | 0 | 10 | 20 | 30 | 40 |
| n20D | 1,3330 | 1,3415 | 1,3493 | 1,3571 | 1,3652 |
2. Определите обменную ёмкость катионита по CaCl2, если 1,050 г катионита в Н+-форме залили 100 см3 раствора CaCl2, с молярной концентрацией эквивалента 0,1000 моль/дм3 и на титрование 25,00 см3 фильтрата израсходовано 12,20 см3 раствора NaOH (Сэкв(NaOH) = 0,1000 моль/дм3, К = 0,9850).
3. Для определения кислотности кефира 10,00 см3 его поместили в электрохимическую ячейку, добавили 20,00 см3 воды и оттитровали раствором гидроксида натрия с молярной концентрацией эквивалента 0,1000 моль/дм3. В процессе титрования измерили изменение потенциала. Вычислите кислотность кефира в градусах Тернера (Т0) по данным потенциометрического титрования (градус Тернера показывает объём 0,1000 NaOH, израсходованный на титрование 100 см3 кефира):
| VNaOH, см3 | 0 | 2,00 | 4,00 | 6,00 | 8,00 | 8,5 | 9,00 | 9,5 | 10,00 | 12,00 |
| E, мВ | 406 | 408 | 410 | 422 | 438 | 460 | 490 | 500 | 506 | 508 |
Какие электроды и приборы можно использовать при данном титровании?
4. Рассчитайте определяемый минимум для фотоколориметрического анализа железа (мг/см3) с сульфосалициловой кислотой в аммиачной среде. Толщина поглощающего слоя l=1 см, минимальный объём окрашенного раствора в кювете составляет 15,00 см3. Среднее значение молярного коэффициента светопоглощения комплекса равно 5500. Минимальная оптическая плотность, измеряемая прибором Амин=0,01.
5. При определении фосфора в рыбных консервах «Горбуша» методом фотоколориметрии были получены следующие результаты (мг/100г продукта): 228,0; 200,4; 230,1; 232,0; 229,8; 231,4; 232,0; 228,9; 233,4. Вычислить стандартное отклонение единичного результата и доверительный интервал среднего значения.
6. Рассчитайте содержание урана в растворе (мкг/см3) по данным определения его методом люминесценции : 0,05 см3 раствора выпарены и сплавлены со 100 мг смеси NaF и NaKCO3; относительная люминесценция сплава составляла 38% от люминесценции стандартного образца, подготовленного таким же образом и содержащего 0,50мкг урана.
7. Рассчитайте молярную концентрацию азотной кислоты и фенола C6H5OH, если при кондуктометрическом титровании 50 см3 их смеси раствором гидроксида калия, (С(KOH) = 0,5000 моль/дм3), были получены следующие результаты:
| VKOH, см3 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| L, См | 19 | 17 | 15 | 13 | 12,5 | 12,6 | 12,7 | 12,8 | 13,0 | 14,0 | 15,0 | 16,0 |
8. При определении этанола методом газожидкостной хроматографии в качестве внутреннего стандарта использовали пропанол. Рассчитайте содержание этанола в водке по данным хроматографического анализа: а) при градуировке масса этанола 0,052 г, площадь пика этанола 5,36 см3, масса пропанола 0,068 г, площадь пика пропанола 8,41 см2; б) при анализе водки: площадь пика этанола 6,48 см2, масса водки 0,2101 г, масса пропанола 0,049 г, площадь пика пропанола 6,06 см2.
9. При определении ионов железа Fe3+ в сточной воде методом амперометрического титрования раствором хлорида олова SnCl2 с молярной концентрацией эквивалента 0,0100 моль/дм3 были получены следующие результаты:
| V(SnCl2), см3 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 |
| Jd, мкА | 10 | 10 | 10 | 10 | 10 | 25 | 40 | 55 |
Постройте кривую титрования и рассчитайте содержание Fe3+ в мг/дм3, если на титрование было взято 100,00см3 воды.
10. Какие из представленных зависимостей соответствуют прямым методам инструментального анализа? В каждом выбранном варианте назовите прибор, измеряемую на нём величину, единицу измерения.
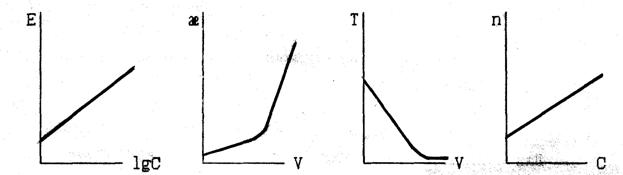
ВАРИАНТ 4
1. Рассчитайте молярную концентрацию глицерина в воде (Сх) по следующим данным рефрактометрического анализа:
| Для стандартных растворов: | ω1 = 20% n1 = 1,3575 ω2 = 50% n2 = 1,3981 |
| Для исследуемого раствора: | ρх = 1,070 г/см3 nх=1,3781 |
2. При потенциометрическом определении титруемой кислотности яблочного сока 100,00 см3 его оттитровали рабочим раствором NaOH, Сэкв(NaOH)=0,1 моль/дм3. Были получены следующие данные:
| VNaOH, см3 | 0 | 2,00 | 4,00 | 6,00 | 8,00 | 10,00 | 10,50 | 11,00 | 12,00 | 13,00 |
| рН | 2,69 | 3,6 | 4,0 | 4,5 | 5,0 | 5,9 | 7,0 | 11,5 | 11,8 | 12 |
Постройте дифференциальную кривую титрования в координатах (ΔрН/ΔV – V). Рассчитайте кислотность исследуемого сока в градусах Тернера (градус Тернера показывает объем 0,1000 М NaOH, израсходованный на титрование 100 см3 сока). Предложите индикаторные электроды и электроды сравнения для данного титрования.
3. Для люминесцентного определения рибофлавина (витамина В2) в пищевом продукте методом добавок 0,2500 г продукта растворили и после соответствующей обработки измерили интенсивность люминесценции полученного раствора. Она оказалась равной 27. После добавления стандартного раствора, содержащего 40 мкг витамина В2, интенсивность люминесценции увеличилась до 80. Определите массовую долю витамина В2 в продукте, если интенсивность люминесценции холостого раствора равна 8.
4. Смесь хлороводородной и уксусной кислот оттитровали раствором NаOH, С(NаOH) = 0,2000 моль/дм3. Постройте кривую кондуктометрического титрования и рассчитайте содержание кислот в анализируемом растворе.
| VNаОH, см3 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| L, См | 24 | 21 | 17,8 | 14,5 | 14,0 | 14,2 | 14,3 | 14,5 | 19,5 | 21,5 | 26,5 |
Какие приборы и электроды используют при данном титровании?
5. Рассчитайте массовую долю компонентов газовой смеси по следующим данным анализа методом газовой хроматографии:
| компонент | время удерживания tR, мин | высота пика h, см | поправочный коэффициент k |
| Пропан | 0,6 | 5,1 | 0,68 |
| Бутан | 1,5 | 8,5 | 0,68 |
| Пентан | 2,0 | 10,0 | 0,69 |
| циклогексан | 3,0 | 6,2 | 0,85 |
6. При определении витамина С в яблочном соке методом флуориметрии были получены следующие результаты (мг/дм3): 24,0; 26,0; 25,3; 24,0; 24,8; 29,9 25,0; 23,7; 24,9; 25,2. Обработайте данные по правилам математической статистики и определите, есть ли грубые погрешности в данных анализа.
7. Сколько граммов катионита КУ-2 в Н+-форме потребуется для выделения Ca2+ из 0,5 дм3 раствора хлорида кальция с молярной концентрацией эквивалента 0,1000 моль/дм3, если статическая обменная ёмкость катионита равна 4,75 ммоль/г?
8. Молярный коэффициент поглощения сульфосалицилатного комплекса железа равен 3000. Рассчитайте молярную концентрацию железа в исследуемом растворе, если его оптическая плотность, измеренная по отношению к раствору, содержащему 0,0576 мг железа в 50 см3 при толщине слоя 5 см, равна 0,34.
9. Вычислите содержание Cu2+ (мг/дм3) в консервированном фруктовом соке, если при анализе 20,00 см3 его, высота полярографической волны меди была равна 15,5 мм, а после добавления 1 см3 стандартного раствора Cu2+ с молярной концентрацией 0,0011 моль/дм3 высота волны увеличилась до 29,0мм.
10. Какие из предложенных кривых соответствует титрованию смеси веществ? Назовите приборы, величины измеряемые на них и единицы их измерения. Покажите на выбранных кривых титрования, как определяется эквивалентный объём.
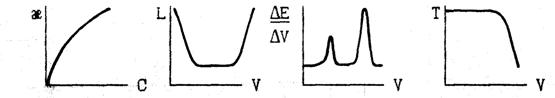
ВАРИАНТ 5
1. При потенциометрическом определении титруемой кислотности молока 100,00 см3 его оттитровали рабочим раствором NaOH, С(NaOH)= 0,1020 моль/дм3; были получены следующие результаты:
| VNaOH,см3 | 0 | 2,00 | 4,00 | 6,00 | 8,00 | 10,00 | 12,00 | 14,00 |
| рН | 6,5 | 6,8 | 7,0 | 7,1 | 7,5 | 7,8 | 8,0 | 8,2 |
| VNaOH,см3 | 16,00 | 18,00 | 19,50 | 20,00 | 21,00 | 22,00 | 24,00 |
| рН | 8,4 | 8,6 | 10,0 | 10,5 | 10,6 | 10,7 | 10,8 |
Постройте дифференциальную кривую титрования в координатах (DрН/DV-V). Определите титруемую кислотность молока в градусах Тернера (оТ). Под градусом Тернера понимают объём (см3) 0.1 М раствора NaOH, который расходуется на титрование 100 см3 молока. Предложите электроды индикаторный и сравнения для данного титрования.
2. Показатель преломления водного раствора с массовой долей уксусной кислоты в нём 19,25 % равен 1,3468. Рассчитайте молярную концентрацию CH3COOH в уксусе, если его показатель преломления равен 1,3385, а плотность 1,0095 г/см3(принять, что между показателем преломления и концентрацией существует линейная зависимость).
3. Смесь гидроксида натрия и уксуснокислого натрия оттитровали раствором хлороводородной кислоты, С(HCl)=0,1000 моль/дм3. Постройте кривую титрования и рассчитайте массу NaOH и CH3COONa в растворе по результатам кондуктометрического титрования:
| VHCl, см3 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| L,См | 13,5 | 10,1 | 6,2 | 3,1 | 2,3 | 2,4 | 2,6 | 2,7 | 3,0 | 4,2 | 5,4 | 6,6 | 8 |
4. Величина молярного коэффициента светопоглощения раствора комплексного соединения железа (II) с диметилглиоксимом равна 15000. Какова минимальная масса железа (в г), которую можно определить с помощью данной колориметрической реакции, если она проводится в мерной колбе вместимостью 25 см3 и оптическая плотность раствора должна иметь величину не менее 0,01 при толщине кюветы 3 см?
5. Сколько см3 раствора CaCl2 с молярной концентрацией равной 0,05 моль/дм3 можно пропустить через 100 см3 набухшего катионита КУ-2, если динамическая обменная ёмкость его равна 2,5 ммоль/дм3?
6. Для люминесцентного определения алюминия в томатной пасте 10.0000г ее озолили и золу растворили в 50 см3 соляной кислоты. Затем 5.00 см3 полученного раствора перенесли в мерную колбу вместимостью 100 см3, затем прибавили кислотного хром-сине-черного и довели раствор до метки. Интенсивность люминесценции этого раствора оказалась равной 0.72. Интенсивность стандартного раствора, приготовленного в идентичных условиях и содержащего 20 мкг алюминия была равна 0.82. Рассчитайте содержание алюминия в 100 г томатной пасты, если интенсивность флуоресценции холостого раствора равна 0,10.
7. При определении хлорид-ионов в минеральной воде методом потенциометрического титрования в двух лабораториях были получены следующие результаты ( мг/дм3):
1 лаборатория: 50,0; 48,9; 49,9; 50,8; 50,3
2 лаборатория: 51,0; 47,3; 49,9; 50,0; 51,0
Используя критерий Фишера установите: являются ли значимыми расхождения результатов анализа?
8. При анализе стандартных растворов хлорида натрия методом ионной хроматографии были получены следующие данные:
| Сст, мг/дм3 | 400 | 500 | 600 | 800 | 1000 |
| Sст,мм2 | 14,0 | 20,1 | 25,8 | 32,0 | 38,0 |
Определите концентрацию хлорид-ионов в минеральной воде, если площадь пика хлорид-иона на хроматограмме равна 29,6 мм2.
9. Для определения содержания меди в хлебе взята его навеска, равная 20,0039 г, и подвергнута озолению. После обработки золы получено 10,00 см3 раствора, содержащего Cu2+, 4 см3 этого раствора поместили в мерную колбу вместимостью 25,00 см3, и довели до метки фоновым электролитом. Высота полярографической волны полученного раствора была равна 24,5 мм. Во вторую колбу вместимостью 25,00 см3 внесли 4 см3 исследуемого раствора, полученного после обработки золы, 0.4 см3 стандартного раствора Cu2+ с титром 1 мг/см3 и довели до метки фоновым электролитом. Высота волны этого раствора оказалась равной 37,5 мм. Рассчитайте содержание меди в хлебе в мг/кг.
10. Какие из представленных зависимостей соответствуют косвенным методам инструментального анализа ? В каждом выбранном варианте назовите прибор, измеряемую на нём величину, единицу измерения её. Покажите на выбранных кривых, как определяется эквивалентный объем рабочего раствора.
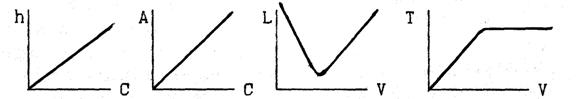
ВАРИАНТ 6
1. При анализе раствора рибофлавина (витамина В2), полученного из 10 г свеклы показания флуориметра были равны 0.38,а нулевого раствора 0.06. Рассчитайте содержание рибофлавина в 1,00 кг свеклы, если при флуориметрировании стандартного раствора , содержащего 0,5 мкг/см3 витамина В2 показания флуориметра составили 0,68, а нулевого раствора 0,04.
2. Определите чистоту D-винной кислоты, если раствор её, содержащий 2,57 г кислоты в 25,00 см3 , при длине трубки 25 см вращает плоскость поляризации вправо на 2,98о.
3. Через колонку, содержащую 100 см3 катионита, пропущен раствор хлорида кальция. Сколько кальция (ммоль·экв.) поглотит катионит при условии полного насыщения, если обменная ёмкость его равна 4,6 ммоль/г , а удельный объём его равен 2,9 см3/г?
4. По данным фотоколориметрического анализа кобальта в растворе в виде роданида при l=620 нм рассчитайте молярный коэффициент светопоглощения: оптическая плотность раствора 0,32; толщина слоя раствора 2 см; содержание кобальта 0,47 мг в 50см3.
5. Для определения ионов железа (III) в пиве прямой потенциометрией приготовили стандартные растворы Fe(NO3)3 и измерили потенциал индикаторного электрода в каждом из них:
| С(Fe3+)моль/дм3 | 10-4 | 5∙10-4 | 10-3 | 5∙10-3 |
| Е,мв | 290 | 278 | 272 | 260 |
25см3 пива разбавили фоновым электролитом в мерной колбе до 50 см3. Электродный потенциал этого раствора был равен 280 мВ. Определите содержание ионов железа в пиве (мг/дм3).
6. Cопротивление раствора сульфата калия в ячейке с площадью электродов 2,54 см2 и расстоянием между ними 0,65 см равно 5,61 Ом. Эквивалентная электропроводность раствора равна 75,8 См×см2/моль. Рассчитайте молярную концентрацию исследуемого раствора.
7. Для определения погрешности кондуктометрического анализа раствор серной кислоты с молярной концентрацией эквивалента 0,1002 моль/дм3 титровали раствором щелочи и были получены следующие результаты определения концентрации кислоты (моль/дм3): 0,0990; 0,0989; 0,1000; 0,0980; 0,0986. Обработайте эти данные по правилам математической статистики и установите, имеется ли систематическая погрешность в определении концентрации серной кислоты указанным методом.
8. При анализе смеси аминокислот методом бумажной хроматографии были получены три пятна с Rf=0,18, Rf=0,36, Rf=0,54 и площадью S1=0,74 см2, S2=0,52 см2, S3=0,29см2 соответственно. При анализе в тех же условиях для чистых аминокислот величина Rf была равна: лизин-Rf=0,22, серин-Rf=0,36, аланин-Rf=0,42; гистидин-Rf=0,54; валин-Rf=0,68; цистеиновая кислота Rf=0,18. Каков качественный и количественный (в %) состав смеси?
9. Вычислите концентрацию кадмия в растворе по следующим данным: объем анализируемого раствора 15,00см3, высота полярографической волны 22,5 мм; объем добавленного стандартного раствора 2,00см3 с молярной концентрацией эквивалентов 0,0500 моль/дм3, высота полярографической волны 40,4мм.
10. Какая из представленных зависимостей соответствует методу амперометрического титрования? Назовите прибор, измеряемую на нём величину, единицы её измерения. Покажите как по кривой титрования можно определить Vэкв.
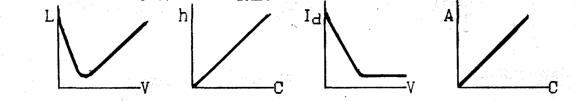
ВАРИАНТ 7
1. Рассчитайте молярную концентрацию сахарозы, если её раствор в кювете длиной 10 см вращает плоскость поляризации вправо на 13,96о.
2. Для определения витамина РР в рыбных консервах «Горбуша» была взята навеска 20,0000г и после ее разложения получено 50см3 раствора. Интенсивность люминесценции, измеренная на флуориметре, была равна 0,72. Для стандартного раствора, содержащего 0,26 мг витамина РР в 50см3 интенсивность люминесценции была равна 0,36. Рассчитайте массовую долю витамина РР в образце.
3. Сколько г натрия задержится в колонке при пропускании через неё раствора хлорида натрия, если объём катионита 50 см3, динамическая обменная емкость 3,6 ммоль на 1 г сухого катионита, удельный объем катионита равен 2.8 см3/г? Напишите уравнение ионного обмена .
4. При определении марганца в виде перманганата оптическая плотность раствора, содержащего 0,14 мг марганца в 100 см3, равнялась 0,155. Измеряли её при l= 525 нм в кювете с толщиной слоя 3см. Вычислите молярный коэффициент светопоглощения .
5. Рассчитать pH винного напитка, если потенциал водородного электрода, измеренный по отношению к хлоридсеребряному электроду, равен 0,512 В при температуре 20оС.
6. 50 см3 молока оттитровали раствором AgNO3 с молярной концентрацией 0.2824 моль/дм3. Рассчитайте содержание хлорид-ионов в молоке (мг/дм3) по данным кондуктометрического титрования:
| V(AgNO3), см3 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| L,См | 6,1 | 5,9 | 6,0 | 5,9 | 5,8 | 6,2 | 7,6 | 9,1 | 10,5 | 12,1 |
7. При определении содержания ртути в копчёной рыбе методом атомно-абсорбционной спектроскопии были получены следующие результаты (мг/кг): 0,40, 0.50, 0.25, 0.50, 0.40, 0.45, 0.20, 0.47,0.49, 0.54. Рассчитайте относительное стандартное отклонение Sr.
8. Для определения диоксидифенилметана (ДДМ) в овощах использовали метод тонкослойного хроматографического разделения и количественного определения по площади пятна S. Для стандартных образцов были получены следующие данные:
| С(ДДМ),мкг/0,02 см3 | 1,25 | 4,0 | 8,0 | 12,0 | 18,0 |
| S,мм2 | 9,0 | 17,0 | 28,0 | 39,3 | 56,0 |
150 г моркови обработали 100 см3 спирта, который затем упарили до 10 см3. При хроматографировании 0,02 см3 этого раствора получено пятно с площадью 35 мм2. Рассчитайте содержание диоксидифенилметана в навеске моркови.
9. Рассчитате концентрацию кадмия в растворе по данным полярографического анализа,если использовали ртутный капающий электрод: m=2,0 мг/с, t=4,4 с, Д=0,72×10-5 см2/с, сила тока 10 мкА.
10. Какие из представленных зависимостей соответствуют методам прямой и косвенной потенциометрии? Назовите применяемые приборы, измеряемую на них величину, единицы её измерения. Как по приведённым ниже кривым титрования можно определить эквивалентный объём?
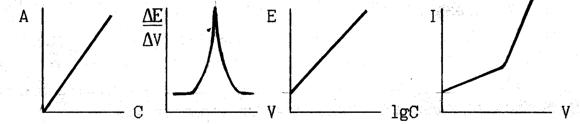
ВАРИАНТ 8
1. Для люминесцентного определения магния в молоке 100 см3 его озолили, золу растворили в мерной колбе вместимостью 50 см3. К 8,00 см3 полученного раствора добавили люмомагнезон и разбавили дистиллированной водой до 50см3. Затем приготовили точно такую же пробу, но с добавкой 1 см3 раствора, содержащего 2,4 мг магния. Интенсивность флуоресценции оказалась равной соответственно 0,50 и 0,86. Рассчитайте содержание магния в молоке (мг/дм3).
2. Рассчитайте массовую долю глицерина в водном растворе, если его плотность равна 1,020 г/см3, а показатель преломления 1,3447. Для воды: r = 1,000 г/см3, n20D = 1,3330. Для чистого глицерина:r = 1,260 г/см3, n20D = 1,4729. При расчёте используйте метод удельных рефракций.
3. Значение молярного коэффициента светопоглощения раствора моносульфосалицилата железа равно 1600. Рассчитайте, каково должно быть содержание железа в стандартных растворах, приготовленных в мерных колбах вместимостью 100 см3, чтобы оптические плотности их при измерении в кюветах с толщиной слоя 1 см находились в пределах значений от 0,1 до 0.5.
4. Для определения содержания меди методом вольтамперометрии взята навеска пищевого продукта 20,0087 г, которая после озоления и растворения золы перенесена в мерную колбу вместимостью 50,00 см3. Для полярографирования взято 20,00 см3 этого раствора, высота волны составила 24 мм. При полярографировании такого же объёма стандартного раствора, содержащего 0,16 мг меди, получена полярографическая волна высотой 20 мм. Вычислите массовую долю меди в анализируемом образце.
5. При анализе томатного сока, было проведено десять параллельных определений содержания калия (мг/100 см3): 200; 240; 238; 229; 231; 238; 229; 232; 230; 238. Обработайте данные по правилам математической статистики, исключив грубые результаты (если они есть) и рассчитав воспроизводимость результатов по величине дисперсии.
6. Методом хроматографии на бумаге, пропитанной гексацианоферратом (II) калия, были получены следующие площади пятен в зависимости от концентрации стандартных растворов меди:
| С, мг/0,2 см3 | 0,12 | 0.30 | 0,45 | 0,70 | 0,90 |
| S,мм2 | 14 | 26,3 | 35 | 52,5 | 66,5 |
При анализе творога 50,00 г его озолили, золу растворили в 100 см3 кислоты и пипеткой нанесли на хроматографическую бумагу 0,2 см3 полученного раствора. После хроматографического разделения определили площадь пятна для гексацианоферрата меди , которая оказалась равной 30,1 мм2. Рассчитайте содержание меди в твороге (мг/кг).
7. Рассчитате содержание хлорида натрия в рассоле (г/дм3), если при потенциометрическом титровании 10 см3 его раствором азотнокислого серебра с молярной концентрацией, равной 0,5090 моль/дм3 были получены следующие результаты:
| V(AgNO3), см3 | 15,0 | 20 | 22 | 24 | 24,5 | 24,9 | 25,0 | 25,1 | 25 | 27 |
| Е, мВ | 307 | 328 | 342 | 370 | 388 | 428 | 517 | 606 | 646 | 650 |
Какие электроды следует использовать для данного титрования?
8. При высокочастотном титровании 15,00 см3 уксусной кислоты раствором гидроксида калия были получены следующие результаты:
| VKOH,см3 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| J, мА | 33 | 38 | 43 | 48 | 50 | 54 | 50 | 48 | 46 | 40 |
Рассчитайте массу уксусной кислоты в 200 см3 раствора, если молярная концентрация гидроксида калия равна 0,1025 моль/дм3.
9. Рассчитайте степень извлечения Cu2+катионитом из 500 см3 раствора нитрата меди с молярной концентрацией 0,0020 моль/дм3, если на титрование меди, извлечённой соляной кислотой из окрашенной зоны, после добавления KJ, израсходовано 10,50 см3 раствора тиосульфата натрия с молярной концентрацией 0,0900 моль/дм3. Напишите уравнения реакции ионного обмена.
10. К каким методам инструментального анализа относятся представленные графики?. Назовите прибор, измеряемую на нём величину, единицы её измерения. Укажите, как по графикам определяют эквивалентный объём титранта или концентрацию исследуемого раствора?
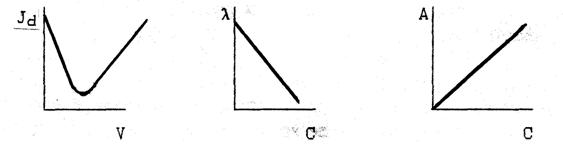
ВАРИАНТ 9
1. Для стандартных растворов сахарозы измерены показатели преломления:
| w ,% | 0 | 15 | 30 | 40 | 50 |
| n20D | 1,3330 | 1,3598 | 1,3881 | 1,4072 | 1,4260 |
Рассчитайте массовую долю сахара в сиропе, если его показатель преломления равен 1,3650.
2. Для определения витамина РР в апельсиновом соке методом флуоресценции использовали метод добавок. Интенсивность флуоресценции сока, после соответствующей обработки и разбавления в 2 раза водой в мерной колбе на 100 см3 равнялась 0,30. В другую мерную колбу такой же вместимости поместили 50,00 см3 сока, 5 см3 раствора, содержащего 0,20 мг витамина РР и довели до метки водой. Интенсивность флуоресценции была равна 0,71. Рассчитайте содержание витамина РР в 200 см3 апельсинового сока.
3. Определите обменную ёмкость катионита по NaCl, если 1,025 г катионита залили 100 см3 0,1000 М NaCl и на титрование 25,00 см3 элюата израсходовано 13,40 см3 раствора NaOH (Сэкв(NaOH)=0,1000 моль/дм3, К=1,2150). Напишите уравнение реакции ионного обмена.
4. Оптическая плотность раствора трисульфосалицилата железа, измеренная при l=433 нм в кювете с толщиной слоя 2 см, равна 0,51. Для реакции взято 4 см3 0,000582 М раствора железа и колориметрическая реакция проведена в колбе вместимостью 50 см3. Вычислите значение молярного коэффициента светопоглощения для данной реакции.
5. При определении цинка в томатной пасте методом полярографии были получены следующие результаты (мг/100г продукта): 1,10; 0,98; 0,92; 1,11; 1,00; 0,78. Установите наличие грубых результатов по величине стандартного отклонения.
6. Удельная электропроводность раствора NH4OH равна 1,02×10-4 См×см-1. Рассчитайте молярную концентрацию этого раствора и степень диссоциации NH4OH, если эквивалентная электропроводность раствора равная 9,38 См×см2/моль.
7. При анализе раствора сульфата цинка методом вольтамперометрии высота волны равнялась 28,5 мм. Высота волны для стандартного раствора, измеренная в тех же условиях, была равна 41,0 мм. Рассчитайте молярную концентрацию сульфата цинка в исследуемом растворе, если в 100см3 стандартного раствора содержалось 40мг Zn2+.
8. Потенциал нитрат-селективного электрода в 0,015 М растворе нитрата калия, измеренный по отношению к нормальному каломельному электроду, равен 0,240 В. Рассчитайте содержание нитрат-ионов в моркови (в мг/кг), если 10,00 г её измельчили, обработали 100 см3 фонового электролита и после 15-минутной экстракции измерили в тех же условиях потенциал, который был равен 0,300В.
9. Используя метод внутренней нормировки рассчитайте содержание компонентов анализируемой на газовом хроматографе смеси по следующим данным:
| компонент | Время удерживания tR, сек | Высота пика h,мм | Поправочный коэффициент, Кi |
| гексан | 5 | 5 | 1,0 |
| бензол | 20 | 20 | 1,1 |
| этанол | 10 | 70 | 0,8 |
Начертите хроматограмму анализируемой смеси.
10. Какие из представленных на рисунке кривых соответствуют косвенной потенциометрии ? Покажите на выбранной кривой титрования, как определяется эквивалентный объём. Назовите используемые приборы. Какая величина измеряется на них в этом случае и каковы её единицы измерения?
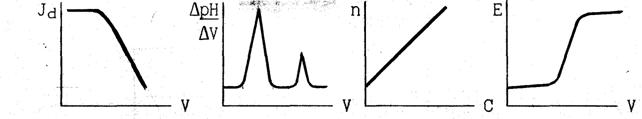
ВАРИАНТ 10
1. Для люминесцентного определения алюминия в соляной кислоте навеску ее 0,1500г выпарили, остаток растворили и получили 500 см3 раствора. 50см3 его перенесли в мерную колбу, вместимостью 100 см3, прибавили кислотный хром-сине-черный и довели до метки дистиллированной водой. Интенсивность флуоресценции полученного раствора была равна 60. Интенсивность стандартного раствора, содержащего 30мкг алюминия в 100 см3 ,равнялась 86. Рассчитайте массовую долю алюминия в исследуемом образце, если интенсивность люминесценции холостых растворов равна 10.
2. Для построения градуировочного графика смешали следующие объёмы глицерина и воды и измерили их показатели преломления:
| V(H2O), см3 | 10 | 8 | 6 | 4 | 2 | 0 |
| Vглицерина, см3 | 0 | 2 | 4 | 6 | 8 | 10 |
| n20D | 1,3330 | 1,3627 | 1,3915 | 1,4211 | 1,4484 | 1,4740 |
Определите массовую долю глицерина в анализируемом растворе, если его показатель преломления равен 1,4114, а плотность глицерина 1,2613 г/см3.
3. Найдите оптимальную толщину поглощающего слоя (кюветы) для фотометрирования окрашенного раствора соли железа с молярным коэффициентом светопоглощения emax, равным 2,4×103, если в 50 см3 раствора содержится 0,05 мг железа. Оптимальное значение оптической плотности равно 0,42.
4. Сколько см3 раствора (С(NaCl)=0,1 моль/дм3 ) можно пропустить через 100 см3 набухшего катионита КУ-2, если его динамическая обменная емкость 1,25 ммоль/см3? Напишите уравнение реакции ионного обмена.
5. Для амперометрического определения ионов Cd2+ в пиве 500 см3 его были выпарены до 10см3 и оттитрованы раствором K4[Fe(CN)6] с молярной концентрацией эквивалента 0,0100 моль/дм3. При этом были получены следующие показания прибора:
| V(K2Cr2O7), см3 | 05, | 1,0 | 1,5 | 2,0 | 2,5 | 3,0 | 4,0 |
| Jдиф., мкА | 83 | 44 | 5 | 4 | 4 | 4 | 4 |
Построить кривую титрования и рассчитать содержание ионов Cd2+в 1дм3 пива.
6. При определении содержания свинца в мясе методом амальгамной полярографии были получены следующие результаты (мг/кг): 0,45; 0,50; 0,21; 0,38; 0,40; 0,12; 0,30; 0,60; 0,41; 0,37. Обработайте данные по правилам математической статистики. Рассчитайте величину доверительного интервала, в пределах которого находится истинное значение определяемого показателя.
7. Рассчитайте содержание ионов натрия в молоке (в мг/дм3), если потенциал стеклянного натрий-селективного электрода, измеренный по отношению к хлоридсеребряному электроду сравнения (0,1 М), равен 0,048 В. Е0 для натрий-селективного электрода равен 0,371 В.
8. При титровании хлорида бария серной кислотой с молярной концентрацией, равной 0,1000 моль/дм3 были получены следующие данные по шкале высокочастотного титратора:
| V(H2SO4), см3 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 |
| J,мкА | 62 | 43 | 29,5 | 22,0 | 19,2 | 28 | 37 | 45 |
Построить кривую титрования и рассчитать массу хлорида бария в исследуемом растворе.
9. При определении этилового спирта методом газовой хроматографии была исследована зависимость высоты пиков от содержания спирта:
| m, мг | 2 | 4 | 6 | 8 | 10 |
| h, мм | 18 | 35 | 52 | 66 | 88 |
Рассчитайте массовую долю спирта в исследуемом растворе, если для 0,02 см3 его получен пик с высотой 57 мм, плотность раствора равна 0,950 г/см3.
10. Какие из представленных зависимостей соответствуют косвенным методам инструментального анализа? В каждом выбранном варианте назовите прибор, измеряемую на нём величину, её единицы измерения. Покажите на выбранных кривых как определяют эквивалентный объём.
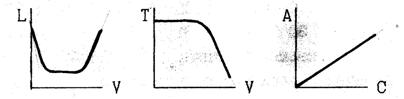
Дата добавления: 2018-04-15; просмотров: 2838; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
