Электрохимические методы анализа
Пример 8. Рассчитать массовую долю ионов натрия в рассоле, если потенциал индикаторного натрий-селективного электрода, измеренный по отношению к насыщенному каломельному электроду, при 20ºС равен – 57,6 мВ. Е' для натрий-селективного электрода равен 148,8 мВ. Плотность рассола 1,147 г/см. Решение.
| Дано: E'инд=148,8 мВ =0,1488 В DE= –57,6 мв = –0,0576 В ρ=1,147 г/см3 | Потенциал насыщенного каломельного электрода при 20ºС равен 0,247 В (приложение, табл.3). Потенциал индикаторного натрий-селективного электрода можно вычислить по уравнению Нернста (формула 3.5, часть I): |
| ω(NaCl) – ? |
 .
.
Коэффициент  для 20ºС равен 0,0581, n=1, т.к. ион натрия однозарядный:
для 20ºС равен 0,0581, n=1, т.к. ион натрия однозарядный:
Еинд = 0,1488+0,0581∙lgCNa+
Измеренную разность потенциалов гальванического элемента можно рассчитать по формуле:
DЕ = Еинд–Есравн;
–0,0576 = 0,1488 + 0,0581∙lgCNa+–0,247;

Из курса титриметрического метода анализа известно, что массовая доля ω и молярная концентрация С связаны между собой соотношением:
 ,
,
где М – молярная масса, г/моль; ρ – плотность, г/см3. М(NaCl)=58,5 г/моль.
 .
.
Пример 9. При потенциометрическом титровании 100 см3 молока раствором нитрата серебра были получены следующие данные:
| V(AgNO3), см3 | 0,0 | 2,0 | 4,0 | 6,0 | 6,5 | 7,0 | 7,5 | 8,0 | 8,5 | 9,0 | 9,5 |
| E, мВ | 100 | 102 | 104 | 108 | 110 | 113 | 160 | 190 | 195 | 198 | 200 |
Рассчитать содержание хлорид-ионов в молоке (мг/дм3), если молярная концентрация раствора азотнокислого серебра равна 0,4596 моль/дм3. Предложить для данного титрования индикаторный электрод и электрод сравнения.
|
|
|
Решение. Ионное уравнение, протекающей реакции:
Cl–+Ag+→AgCl↓.
До точки эквивалентности будет меняться концентрация хлорид-ионов- (они будут выпадать в осадок в виде AgCl), а после точки эквивалентности – концентрация ионов Ag+ (они будут находиться в избытке). Следовательно, можно выбрать индикаторные электроды, потенциал которых зависит от концентрации или Cl–, или Ag+: серебряный электрод I рода, хлоридсеребряный электрод II рода, хлорид-селективный электрод. В качестве электрода сравнения можно взять один из стандартных электродов: каломельный, меркуриодидный и др. (приложение, табл. 3). Чтобы определить объем в конечной точке титрования Vктт, необходимо построить дифференциальную кривую титрования. Для этого произведем расчеты ΔЕ, ΔV и DЕ/DV:
| V, см3 | 0 | 2,0 | 4,0 | 6,0 | 6,5 | 7,0 | 7,5 | 8,0 | 8,5 | 9,0 | 10,0 |
| ΔV, см3 | 2,0 | 2,0 | 2,0 | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 | 1,0 | |
| ΔЕ, мВ | 2 | 2 | 4 | 2 | 3 | 47 | 30 | 5 | 3 | 2 | |

| 1 | 1 | 2 | 4 | 6 | 94 | 60 | 10 | 6 | 2 |
Строим дифференциальную кривую титрования и методом касательных определяем эквивалентный объем: Vэкв=7,5см3.
|
|
|

Рассчитаем массу хлорид-ионов по формуле титриметрического анализа:

По условию задачи, аликвотная часть молока равна 100 см3, Vобщ=1000 cм3, т. к. надо рассчитать содержание ионов в 1 дм3.
М(Cl–)= Mэкв(Cl–) = 35,45 г/моль;

Пример 10.Рассчитать молярную концентрацию раствора хлорида кальция, если эквивалентная электропроводность раствора равна 123,10 См·см2/моль, площадь электродов 1,5 см2, расстояние между ними 0,5 см, сопротивление раствора равно 2,50 Ом.
Решение.При решении задачи используем формулу зависимости сопротивления раствора от размера электродов(формулы 3.10 и 3.11, часть I) и связи эквивалентной и удельной электропроводности (формула 3.13, часть I):
 .
.
Рассчитаем удельную электропроводность по формуле:
 См/см.
См/см.
Эквивалентная электропроводность равна:

 моль/дм3.
моль/дм3.
Пример 11.При амперометрическом титровании смеси нитратов свинца и бария раствором дихромата калия с молярной концентрацией эквивалента 0,5000 моль/дм3 были получены следующие данные:
| V(K2Cr2O7), см3 | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| I, мкА | 90 | 70 | 50 | 30 | 10 | 10 | 10 | 10 | 35 | 60 | 85 |
Рассчитать титр раствора по Pb(NO3)2 и Ba(NO3)2, если аликвотная часть исследуемого раствора была равна 20 см3.
Решение. Это пример титрования смеси веществ:
|
|
|
2Pb(NO3)2+K2Cr2O7+H2O→2PbCrO4↓+2KNO3+2HNO3; ПР=1,8·10-14
2Ba(NO3)2+K2Cr2O7+H2O→2BaCrO4↓+2KNO3+2HNO3; ПР=1,2·10-10
На основании полученных данных строим кривую титрования и по методу касательных определяем объем рабочего раствора K2Cr2O7, израсходованный на титрование каждого компонента.

Кривая амперометрического титрования смеси нитратов свинца и бария раствором дихромата калия.
Так как произведение растворимости хромата свинца меньше произведения растворимости хромата бария, то ионы свинца будут выпадать в осадок первыми, т. е. первыми будут титроваться. Следовательно, объем, израсходованный на их титрование, равен V1, а объем, израсходованный на титрование ионов бария, равен разности V2–V1.
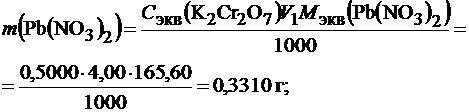





Пример 12.Навеску 20,2354 г хлебобулочного изделия, содержащего цинк, подвергают озолению. После обработки золы получено 10,00 см3 раствора. 8 см3 этого раствора поместили в мерную колбу вместимостью 25 см3, добавили 10,00 см3 фонового электролита, довели до метки дистиллированной водой, удалили кислород и полярографировали. Высота полярографической волны оказалось равной 22,5мм. Во вторую колбу вместимостью 25,00 см3 внесли 8,00 см3 раствора, полученного после обработки золы, 0,5 см3 стандартного раствора Zn (II) с титром, равным 1 мг/см3, 10 см3 фонового электролита и довели до метки дистиллированной водой. Высота полярографической волны, записанной для этого раствора, равна 39,00 мм. Определите содержание цинка в хлебобулочном изделии в мг/кг.
|
|
|
Решение.
| mнав=20,2354г Vp-ра золы=10 см3 Vх=8 см3 Vст=0,5 см3 Tст(Zn2+)= 1мг/см3 hх=22,5мм hх+ст=39,0 мм | В анализе использован метод добавок (разд. 1.1). Для решения задачи используем уравнение (1.5):
|
| mx – ? |
 мг.
мг.
Масса цинка в 1 кг хлебобулочного изделия равна:
 мг.
мг.
(1000 – коэффициент перевода кг в г)
Дата добавления: 2018-04-15; просмотров: 555; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

