Електрохімічне очищення промислових стічних водвід іонів міді
Мета роботи
Ознайомитися з електрохімічним методом очищення стічних вод від йонів важких металів.
Загальні положення
При проходженні струму через межу електрод-електроліт виникає перехід від електронної проникності (металевий провідник) до йонної (електроліти). В зв’язку з цим на межі електрод-електроліт проходить електрохімічна реакція.
Існує зв’язок між кількістю пропущеної через систему електроенергії та кількістю речовини, яка зазнала хімічних перетворень в міжфазовому просторі. Такий зв’язок був знайдений та описаний Фарадеєм у вигляді двох законів.
Перший закон Фарадея: кількість проредагованої на електродах речовини пропорційна силі струму (І), яка пройшла через систему, та часу проходження (Т).
Другий закон Фарадея: при електрохімічному розщепленні різних електролітів однією тією ж кількістю електрики, кількість отриманих на електродах продуктів пропорційна їх хімічним еквівалентом, тобто:
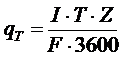 , (2.1)
, (2.1)
де qТ – теоретична кількість виділеного на катоді металу, г;
І – сила струму, А;
Z – хімічний еквівалент металу (атомна вага поділена на валентність йонів даного металу, Z=A/n);
F – число Фарадея, F=96500 Кл.
Кількість речовини (в грамах), яку отримали при проходженні одиниці електрики, називають електрохімічним еквівалентом. На практиці електрохімічний еквівалент відносять не до сталої Фарадея, а до 1А·год. Оскільки F=96500 Кл =26,8 А·год, то електрохімічний еквівалент (m) зв’язаний з хімічним наступним співвідношенням:
|
|
|
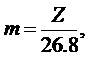 (2.2)
(2.2)
Електрохімічний еквівалент міді m=1,185.
Кількість металу, яка виділилась на катоді, згідно за законом Фарадея, визначається за формулою:
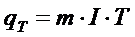 . (2.3)
. (2.3)
При електролізі розчину міді:
на катоді в електролізері проходять слідуючи процеси:
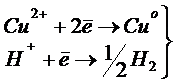 процес проходить з виділенням водню;
процес проходить з виділенням водню;
інколи 2Н++SO42- 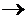 H2SO4 – проведення процесу без виділення водню;
H2SO4 – проведення процесу без виділення водню;
на аноді: 4OH- ‑ 4 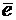
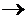 O2
O2 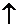 +H2O
+H2O
В реальних умовах при електролізі проходять побічні електрохімічні та другорядні хімічні реакції, які зменшують вихід за струмом (Вт). Величина Вт вказує наскільки правильно організовано процес електролізу і розраховується за формулою (%):
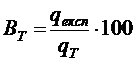 , (2.4)
, (2.4)
де qексп – кількість грамів металу, яка виділилась на катоді при проведенні досліду, г;
qТ – кількість грамів металу, яка повинна була виділитися на катоді згідно з законом Фарадея, г.
Реактиви, посуд та прилади
1. Стічна вода, яка містить 250 г/л CuSO4·5H2O та 64г/л H2SO4.
2. Стічна вода, яка містить 100 г/л CuSO4·5H2O та 64 г/л H2SO4.
|
|
|
3. Аналітичні терези.
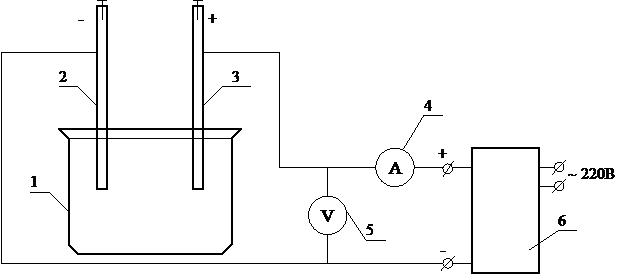 |
4. Лабораторна установка (рис. 2.1)
1 – електролізер;
2 – мідний катод;
3 – свинцевий анод;
4 – амперметр;
5 – вольтметр;
6 – джерело струму.
Рисунок 2.1 – Схема лабораторної установки для катодного осадження металу
Дата добавления: 2018-04-05; просмотров: 191; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
