ОСНОВНЫЕ СВЕДЕНИЯ О МЕТАЛЛАХ И СПЛАВАХ
Раздел первый ОСНОВЫ МЕТАЛЛОВЕДЕНИЯ
Глава I ОСНОВНЫЕ СВЕДЕНИЯ
О МЕТАЛЛАХ И ИХ СПЛАВАХ
Общие сведения о металлах и их сплавах
В настоящее время известно 107 химических элементов (см. Периодическую систему элементов Д. И. Менделеева), которые делятся на две основные группы: металлы и неметаллы (металлоиды). Большинство элементов (83) — металлы, отличительными признаками которых являются непрозрачность, специфический блеск, высокая теплопроводность и электропроводность, ковкость и др. При обычной температуре все металлы, кроме ртути, находятся в твердом состоянии. Металлоиды не имеют таких свойств.
Перечисленными выше свойствами металлы обладают в различной степени, что и определяет их различное практическое использование. Наиболее широкое применение в промышленности получили железо, медь, алюминий, магний, свинец, цинк и олово.
В земной коре металлы занимают небольшое место (около 15% по массе), остальную часть составляют кислород (49%), кремний (26%) и другие металлоиды. Самыми распространенными металлами являются алюминий (7%) и железо (5%), реже встречаются кальций, натрий, магний и калий. Содержание урана, золота, платины и других редких металлов определяется миллионными и миллиардными долями процента.
В технике слово «металлы» объединяет чистые металлы и сплавы. Чистыми металлами называют химические элементы обычно с небольшими добавками других элементов (примесей). Например, техническая медь содержит примеси свинца, висмута, сурьмы, железа, мышьяка, олова и других элементов.
|
|
|
Сплавы — это сложные материалы, образующиеся путем соединения двух и более элементов (в том числе и неметаллов).
Чистые металлы имеют заданные природой свойства. Сплавам можно придать необходимые свойства, поэтому они и получили наибольшее распространение.
В промышленности металлы обычно делят на две группы: черные и цветные. Черные металлы — это железо и его сплавы с углеродом (сталь и чугун). Цветные металлы — это медь, алюминий, магний, никель, цинк, олово, свинец и др. и их сплавы. Наиболее распространены черные металлы (на их долю приходится более 90% общей массы металлов). Из металлоидов широко применяют углерод и кремний.
Металлы получают из металлических руд, которые представляют собой скопление химических элементов в виде простых веществ или соединений. Добычей руд из недр земли занимается горнодобывающая промышленность, получением металлов и сплавов из руд — металлургическая. В соответствии с делением металлов на черные и цветные металлургия делится также на черную и цветную.
В настоящее время выплавляют около 75 металлов и огромное количество сплавов.
|
|
|
§ 2. Внутреннее строение металлов и их сплавов
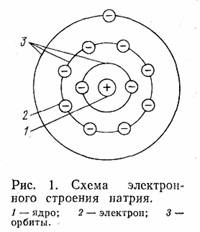 Все вещества состоят из атомов, а атом — из положительно заряженного ядра и вращающихся вокруг него отрицательно заряженных электронов (рис. 1). В ядре находятся положительно заряженные частицы — протоны. Количество протонов при обычном состоянии атома равно количеству электронов, т. е. атом электрически нейтрален. Число электронов, обозначенное порядковым номером в периодической системе элементов Д. И. Менделеева, для каждого элемента различно. Атом при определенных условиях может терять и приобретать электроны. Если электронов станет больше, чем протонов, то он будет заряжен отрицательно, а если меньше, то положительно. Такой электрически заряженный атом называется попом.
Все вещества состоят из атомов, а атом — из положительно заряженного ядра и вращающихся вокруг него отрицательно заряженных электронов (рис. 1). В ядре находятся положительно заряженные частицы — протоны. Количество протонов при обычном состоянии атома равно количеству электронов, т. е. атом электрически нейтрален. Число электронов, обозначенное порядковым номером в периодической системе элементов Д. И. Менделеева, для каждого элемента различно. Атом при определенных условиях может терять и приобретать электроны. Если электронов станет больше, чем протонов, то он будет заряжен отрицательно, а если меньше, то положительно. Такой электрически заряженный атом называется попом.
Электроны вращаются вокруг ядра по орбитам, число которых определяется номером периода элемента в периодической, системе.
У металлов на внешней орбите находятся один, два или три электрона, слабо связанных с ядром, поэтому под воздействием положительно заряженных атомов они могут отрываться от своего атома, превращая его в положительно заряженный ион. Электроны, свободно переходящие от одного атома к другому, называются свободными.
|
|
|
Атомы металлоидов при определенных условиях стремятся заполнить внешнюю оболочку, т. е. присоединить электроны и превратиться в отрицательно заряженные ноны.
ОСНОВНЫЕ СВЕДЕНИЯ О МЕТАЛЛАХ И СПЛАВАХ
Используемые в технике металлические материалы разделяют на простые и сложные металлы (сплавы).
Простые металлы состоят из одного основного элемента и незначительного количества примесей других элементов. Например, технически чистая медь содержит от 0,1 до 1 % примесей свинца, висмута, сурьмы и других элементов.
Сплавы — это сложные металлы, представляющие сочетание какого-либо простого металла (основы сплава) с другими металлами или неметаллами. Например, латунь — сплав меди с цинком. Здесь основу сплава составляет медь.
Химический элемент, входящий в состав металла или сплава, называется компонентом. По числу компонентов сплавы делятся на двухкомпонентные (двойные), трех-компонентные (тройные) и т. д.
Большинство сплавов получают сплавлением компонентов в жидком состоянии.
Сплавы превосходят простые металлы по прочности, твердости, обрабатываемости и т. д. Вот почему они применяются в технике значительно шире простых металлов. Например, железо — мягкий металл, почти не применяющийся в чистом виде. Зато самое широкое применение в технике имеют сплавы железа с углеродом — стали и чугуны.
|
|
|
Все применяемые в технике металлы и сплавы делят ся на черные и цветные.
К черным металлам относятся железо и его сплавь (сталь и чугун). Все остальные металлы и сплавы состав представляют группу цветных металлов.
Наибольшее распространение в технике получили черные металлы. Это обусловлено большими запасами железных руд в земной коре, сравнительной простотой технологии выплавки черных металлов, их высокой прочностью.
Цветные металлы применяются в технике реже, чем черные. Это объясняется незначительным содержанием многих цветных металлов в земной коре, сложностью процесса их выплавки из руд, недостаточной прочностью. Цветные металлы дороже черных. Во всех случаях, когда это возможно, их заменяют черными металлами, пластмассами и другими материалами.
Из большого числа цветных металлов и сплавов в сельскохозяйственной технике наибольшее распространение получили сплавы алюминия, меди, а также подшипниковые сплавы.
Все металлы и сплавы в твердом состоянии имеют
кристаллическое строение, т. е. их атомы (ионы) расположены в строго определенном порядке. Этим кристаллические тела отличаются от аморфных тел, у которых атомы расположены хаотично. Аморфными телами являются стекло, клей, воск и др.
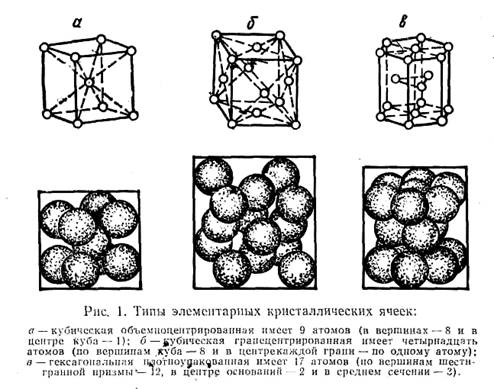 |
Если атомы металла мысленно соединить прямыми линиями, то получится правильная геометрическая система, называемая пространственной кристаллической решеткой. Из кристаллической решетки можно выделить элементарную кристаллическую ячейку, представляющую комплекс атомов, повторением которого в трех измерениях можно построить всю решетку. Наиболее распространены три типа элементарных кристаллических ячеек металлов (рис. 1): кубическая объемно-центрированная (такую решетку имеют хром, вольфрам, молибден и др.), кубическая гранецентрированная (алюминий, медь, свинец и др.) и гексагональная (цинк, магний и др.).
В узлах кристаллических решеток металлов расположены положительно заряженные ионы, удерживаемые на определенном расстоянии друг от друга свободными электронами. Такое внутреннее строение обусловливает характерные признаки металлов, такие, как высокая электро- и теплопроводность, пластичность (ковкость) и др.
Свойства металлов и сплавов зависят от природы их атомов, типа кристаллической решетки и от расстояния между атомами в решетке.
Все свойства металлов делятся на физические, химические, механические и технологические.
Физические свойстваметаллов и сплавов определяются цветом, плотностью, температурой плавления, тепловым расширением, тепло- и электропроводностью, а также магнитными свойствами (табл. 1). Плотность металла — величина, определяемая отношением массы металла к занимаемому им объему. Она измеряется в кг/м3. Для снижения массы изделия необходимо использовать материалы с небольшой плотностью (сплавы магния, алюминия и титана).
Температура плавления — температура, при которой металл переходит из твердого состояния в жидкое. Знание температуры плавления металлов и сплавов необходимо в металлургии, в литейном производстве, при горячей обработке металлов давлением, при сварке, пайке и других процессах, сопровождающихся нагреванием металлических материалов.
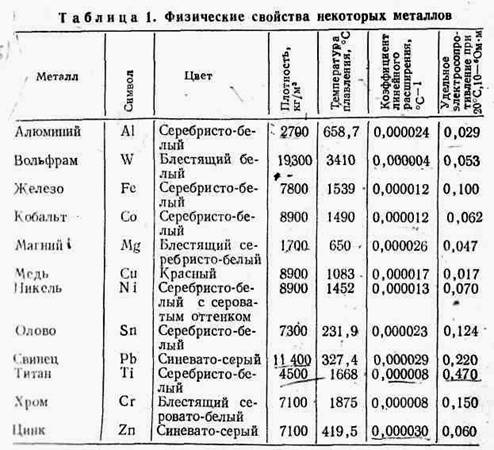 |
Тепловое расширение - изменение линейных размеров иобъема металлического материала при нагревани. Неодинаковость величины теплового линейного расширения материалов характеризуется коэффициентом линейного расширения а, который показывает, на какую долю первоначальной длины при 0 °С удлинилось тело вследствие нагревания его на 1 °С. Тепловое расширение металлов необходимо учитывать при изготовлении и эксплуатации точных, сложностью приборов и инструментов, изготовлении литейных форм, Прокладке железнодорожных рельс и т. д.
Теплопроводность — способность металлов передавать' Теплоту от более нагретых частей тела к менее нагретым. Среди металлических материалов лучшей теплопроводностью обладают серебро, медь, алюминий.
Электропроводность — способность металлов провопить электрический ток. Она оценивается на практике Величиной удельного электросопротивления р. Чем меньше электросопротивление, тем более электропроводен металлический материал. Высокой электропроводностью Обладают те металлы, которые хорошо проводят электрический ток (серебро, медь, алюминий).
Способность металлов намагничиваться под действием магнитного поля/называют магнитной проницаемостью. Сильно выраженными магнитными свойствами обладают железо, никель, кобальт и их сплавы. Эти металлы называют ферромагнитными
Механическими свойствамиметаллов называется совокупность свойств, характеризующих способность металлических материалов сопротивляться воздействию внешних усилий (нагрузок).
К механическим свойствам металлов. относятся:
прочность — способность материала сопротивляться действий внешних сил без разрушения; упругость — способность материала восстанавливать свою первоначальную форму и размеры после прекращения действия внешних сил, вызвавших деформацию;
пластичность — способность материала изменять свою форму и размеры под действием внешних сил, не разрушаясь, и сохранять полученные деформации после прекращения действия внешних сил;
твердость — способность материала оказывать сопротивление проникновению в него другого, более твердого тела;
вязкость — способность, металлических материалов оказывать сопротивление быстро возрастающим (ударным) нагрузкам; хрупкость — свойство, обратное вязкости;
1 ползучесть — свойство металлических материалов медленно и непрерывно пластически деформироваться при длительной нагрузке и высоких температурах; усталость — процесс постепенного накопления повреждений материала под действием повторно-переменных напряжений, приводящих к уменьшению долговечности, образованию трещин и разрушению. Способность металлических материалов противостоять усталости называется выносливостью.
Механические свойства являются основной характеристикой металлов и сплавов, поэтому на заводах созданы специальные лаборатории, где производятся различные испытания с целью определения этих свойств.
Механические испытания можно разделить на:
статические, при которых нагрузка, действующая на металлический образец или деталь, остается постоянной или возрастает крайне медленно;
динамические (ударные), при которых нагрузка возрастает быстро и действует в течение незначительного времени;
испытание при повторных или знакопеременных нагрузках — нагрузках, изменяющихся многократно по величине или по величине и направлению.
Рассмотрим основные виды испытаний металлов с целью определения их механических свойств.
Технологические свойства характеризуют способность металлов поддаваться различным видам технологической обработки для получения определенной формы, размеров и свойств: Они имеют большое значение при выборе металлических материалов для изготовления деталей машин и конструкций. Из технологических свойств наибольшее значение имеют обрабатываемость резанием, свариваемость, ковкость, прокаливаемость, литейные свойства.
Обрабатываемостью резанием называется способность металлов подвергаться обработке режущими инструментами для придания деталям определенной формы, размеров (с необходимой точностью) и чистоты поверхности. Обрабатываемость резанием определяется по скорости резания, усилию резания и по шероховатости обрабатываемой поверхности. При разных методах обработки (точении, сверлении, фрезеровании и т. д.) обрабатываемость одного и того же металла может быть различной. Для улучшения обрабатываемости сталей в них допускается повышенное содержание серы, а также вводятся свинец, селен и другие элементы.
Свариваемостью называется свойство металла или сплава образовывать при установленной технологии сварки соединения, отвечающие требованиям, обусловленным конструкцией и эксплуатацией изделия. Свариваемость углеродистых сталей ухудшается с по-вышением содержания в них углерода. Ковкостью называется способность металла без разрушения поддаваться обработке давлением (ковке, штамповке, прокатке и т. д.). Ковкость металла зависит от его пластичности. Чем металл более пластичен, тем лучше он поддается обработке давлением.
Металлы обладают ковкостью как в холодном, так и в нагретом состоянии. В холодном состоянии хорошо куются латуни и сплавы алюминия, сталь — в нагретом • состоянии. Чугун из-за повышенной хрупкости обработке давлением не подвергается.
Прокаливаемость— способность стали воспринимать закалку на определенную глубину от поверхности. Прокаливаемость стали определяется по виду излома, по измерению твердости в различных точках сечения образца, а также методом торцовой закалки.
Литейные свойства металлов определяются жидкоте-кучестью, усадкой и склонностью к ликвации. Жидкоте кучесть — это способность расплавленного металла заполнять форму и давать плотные отливки с точной конфигурацией. Усадка — сокращение объема расплавленного металла при затвердении и последующем охлаждении. Ликвация — неоднородность химического состава твердого металла в разных частях отливки. .
При выборе литейных материалов учитывают, что чугун обладает высокими литейными свойствами: хорошей жидкотекучестью, небольшой усадкой и незначительной склонностью к ликвации. Литейные свойства стали хуже, чем чугуна.
Химические свойства металлов
Химическим свойством называется способность металлов под действием окружающей среды превращаться в другие вещества и изменять свои свойства.
К химическим свойствам относится способность металлов корродировать, т. е. окисляться под действием кислорода воздуха и воды, разрушаться под действием кислот и щелочей, образовывать окалину при нагреве в окислительной среде.
Коррозии(лат. corrosia — разъедание) подвергаются почти все металлы. Например, железо на воздухе ржавеет, медь покрывается зеленым слоем окиси, алюминий — белым слоем окиси и т. д.
Металлы, не поддающиеся коррозии, называются благородными. К ним относятся золото и платина. Они разрушаются только в смеси соляной и азотной кислот, называемой «царской водкой».
Высокой коррозионной стойкостью обладают хром, никель и их сплавы, а титан и его сплавы по коррозионной стойкости приближаются к благородным металлам.
[Химическая коррозия возникает вследствие химического взаимодействия металла со средами, не являющимися проводниками электрического тока (сухие газы, нефть, бензин, керо-син, масла). При этом металлы вступают в химическое взаимодействие с активными веществами внешней среды, обычно с кислородом, в результате чего на поверхности металлов появляются окисные пленки и изделие начинает разрушаться.
Типичным примером химической коррозии является газовая коррозия, которая наблюдается при нагреве заготовок для ковки и термической обработки, деталей топок и дымоходов котлов, проточных частей газовых турбин, выхлопных труб двигателей и т. д. На судах химической коррозии подвергаются внутренние поверхности цистерн с керосином или бензином, танки с нефтью и другими подобными продуктами.
Электрохимическая коррозия возникает при взаимодействии металла с электролитом, т. е. со средами, проводящими электрический ток (щелочи, растворы солей и кислот, вода и воздух). Коррозию металлов в атмосфере воздуха обычно называют ржавлением.
Явления при электрохимической коррозии по своей природе не отличаются от тех, которые происходят в гальванических элементах. Известно, что при работе гальванического элемента положительно заряженные ионы анода переходят в раствор." При этом анод заряжается отрицательно, а раствор (электролит), приобретая эти ионы, заряжается положительно. Таким образом, возникает разность потенциалов. Чем она больше, тем быстрее переходят ионы с анода в раствор и, следовательно, тем быстрее анод разрушается.
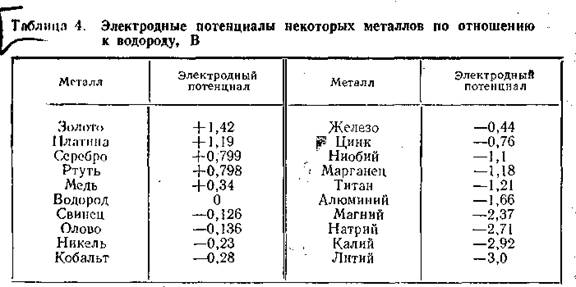
Разность потенциалов, возникающая на поверхности металла, соприкасающегося с электролитом, называется электродным потенциалом. Значения электродных потенциалов элементов измеряют по отношению к водороду, потенциал которого принят равным нулю (табл. 4). Металлы, расположенные выше водорода, электроположительны, а ниже — электроотрицательны.
Если построить гальванический элемент из двух разнородных металлов, то разрушаться будет тот, который в таблице расположен ниже. Так, если в электролит поместить пластинки цинка и железа, то разрушаться будет цинк. Каждый металл будет анодом по отношению к металлу, расположенному выше него в таблице, и катодом — ко всем нижерасположенным. Поэтому нельзя допускать в конструкциях, работающих в коррозионных средах, соединения металлов, разных по активности, например железа с алюминием или медью, меди с алюминием. Возникновению коррозии на металле способствует неоднородность их строения, наличие загрязнений и примесей.
Металлические изделия подвергаются коррозии как в процессе эксплуатации, так и хранения.
 |
По характеру воздействия на металл коррозию можно разделить на сплошную (равномерную), местную и межкристаллитиую.
Сплошная (равномерная) коррозия равномерно распространяется по всей поверхности металла.
Местная коррозия вызывает разрушение отдельных участков поверхности металла в виде язв, пятен и точек. Поэтому ее иногда называют язвенной, пятнистой, точечной. Она возникает обычно в местах дефектов металла: царапин, рисок, забоин, следов обработки и т. д.
Межкристалли тная коррозия развивается (возникает) по границам кристаллов, не вызывая заметных изменений поверхности металла. Этот вид коррозии наиболее опасный. Он приводит к мгновенной поломке деталей при эксплуатации
Интенсивность (скорость) коррозии зависит от химического состава и структуры металла, состояния его поверхности, наличия внутренних и наружных дефектов, окружающей среды (ее состава, температуры, скорости движения) и т. д. Металл с дефектами имеет более высокий электродный потенциал, чем чистый. Дефекты способствуют образованию гальванических микроэлементов и, следовательно, разрушению основного металла. Чем меньше металл имеет дефектов, тем выше его коррозионная стойкость, и наоборот.Химический состав металла значительно влияет на его коррозионную стойкость. При увеличении содержания углерода сопротивляемость металла коррозии уменьшается, и наоборот. Содержание в металлах таких элементов, как хром, никель, титан, медь, повышает их коррозионную стойкость. Ниобий и титан повышают стойкость металлов к межкристаллитной коррозии. Коррозия стали усиливается в кислых растворах и уменьшается в щелочных средах.
Часто одновременно с коррозией металлов происходит эрозия. Эрозией называется механическое разрушение поверхности металла ударами частиц твердых тел, воды, газа, пара, воздуха и т. д. Совместная коррозия и эрозия значительно быстрее разрушают металл.
Около 10 % всех наплавленных металлов, воплощенных в различные изделия, конструкции и машины, ежегодно разрушается от коррозии. Поэтому борьба с коррозией является важнейшей народнохозяйственной задачей. Знание химических свойств металлов позволяет правильно выбрать нужный для изготовления изделий или конструкций, работающих в коррозионных средах.
Коррозия судовых конструкций
Судовые конструкции работают в чрезвычайно неблагоприятных условиях. Детали двигателей внутреннего сгорания и газовых турбин, топки и дымоходы паровых котлов, нагреваемые при обработке судостроительные заготовки подвергаются газовой коррозии, судовые конструкции, соприкасающиеся с нефтью, бензином, керосином, маслами,— химической коррозии, судовые конструкции, находящиеся в воде и влажной атмосфере,— электрохимической коррозии. Многие судовые конструкции (корпус судна, гребные винты, рули, вращающиеся детали турбин и насосов, трубы большинства судовых систем и т. д.) подвергаются также эрозии. В результате потери металла от коррозии в судостроении довольно высоки.
Основной коррозионной средой судовых конструкций является морская вода, в которой содержатся растворы различных солей. Соленость океанов составляет примерно 35 промилле, морей — не более 25, рек и озер — не более 0,3 промилле. Чем выше концентрация солей в воде, тем выше электропроводность и, следовательно, тем выше ее коррозионная активность. Растворенные в морской воде кислород, йод, бром также способствуют ее коррозионной активности.
Наиболее подвержены коррозии в морской воде углеродистая сталь и чугун. Чем больше примесей (серы и фосфора) содержит металл, тем ниже его коррозионная стойкость. Нержавеющие стали и особенно сплавы на основе титана, циркония и тантала устойчивы против коррозии.
Коррозионная стойкость цветных металлов колеблется в широких пределах. Высокую коррозионную стойкость имеет медь и ее сплавы (латунь и бронза). Но простые латуни подвержены в морской воде обесцинкованию. Обесцинкование — это вид избирательной коррозии, при которой цинк растворяется, а медь выделяется на поверхности в виде рыхлых образований.
Алюминий и его сплавы устойчивы против коррозии в пресной воде, а сплавы алюминия с магнием устойчивы и в морской воде, если они имеют дополнительную защиту. Магний и его сплавы мало устойчивы против коррозии в морской воде, а титан и его сплавы — практически абсолютно устойчивы против коррозии, поэтому являются ценным материалом для изготов-ления судовых конструкций.
Увеличение скорости движения воды повышает электрохимическую коррозию, а при определенных условиях вызывает коррозионную эрозию, прежде всего судовых конструкций в кормовой части корпуса судна: гребных винтов, внутренних поверхностей судовых трубопроводов и др.
Коррозионная стойкость судовых конструкций зависит в значительной степени от чистоты их обработки. Бугорчатая поверхность сварных швов, выступающие головки заклепок и других крепежных деталей могут быть причинами интенсивной местной коррозии. Ускоряет коррозию наличие окалины на поверхности судовых конструкций, даже находящейся под слоем краски.
Особенно интенсивно происходит электрохимическая коррозия конструкций, в которых сочетаются различные металлы, например сталь с алюминиевыми или медными сплавами. Однако при постройке судов без таких материалов невозможно обойтись.
Подводная часть судов (обычно до грузовой ватерлинии) во время плавания и особенно стоянки обрастает различными животными или растительными организмами, которые повреждают покрытие корпуса судна, что способствует возникновению местной коррозии. В процессе жизнедеятельности эти организмы выделяют вредные химические соединения: сернистый водород, углекислый газ, различные кислоты и кислород, что также способствует повышению скорости коррозии.
При очистке подводной части крупнотоннажных судов в доках снимают до 200 т продуктов обрастания, которое не только способствует возникновению коррозии, но и снижению скорости движения судов, увеличению расхода топлива, ускорению сроков докования.
Дата добавления: 2018-04-05; просмотров: 7684; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
