Метод посева на чашку Петри (контроль соков и сокосодержащих напитков)
Расплавляют агаризованную питательную среду и поддерживают постоянную температуру 47±2 °С при помощи водяной бани. Затем помещают 2 мл исследуемого напитка в чашку Петри (диаметр 100 мм, высота 15-20 мм) и добавляют 16-18 см3 агаризованной среды, тщательно перемешивая образец со средой. Чашки Петри с застывшей средой переворачивают вверх дном и помещают в термостат с необходимой температурой для последующей инкубации, после которой подсчитывают количество колоний через соответствующие промежутки времени.
2.2. Определение бактерий группы кишечных палочек в пиве и квасе
БГКП в готовом пиве и квасе определяют методом посева в среду КОДА или Кесслер с лактозой (с поплавком). Для определения газообразования в среде КОДА можно использовать вату. Для этого пробирки стерилизуют вместе с небольшими рыхлыми комочками ваты, после чего в них разливают готовую среду КОДА.
Пиво и квас перед исследованием нейтрализуют стерильным 10% раствором двууглекислого натрия до слабощелочной реакции (pH 7,2 - 7,4). Реакцию среды проверяют с помощью pH-метра или универсальной индикаторной бумажки.
Для посева берут то количество пива, кваса, в котором предусматривается отсутствие БГКП, при этом соблюдают соотношение продукта и среды 1:10. При посеве 3 см3 пива можно использовать колбу с 27 см3 среды или высевать по 1 см3 пива в три пробирки с 9 см3 среды.
Посевы помещают в термостат при (37 +/- 0,5) °C на 24 ч. При отсутствии признаков роста (цвет среды не меняется, газ не образуется) дают заключение о соответствии исследованного образца нормативу, например: БГКП в 3 см3 отсутствует.
|
|
|
При наличии роста на среде КОДА происходит изменение цвета среды с фиолетового на зеленоватый, а комочки ваты покрываются пузырьками воздуха.
При наличии признаков роста на среде Кесслер - образование газа в поплавках. В случае обнаружения роста на среде КОДА или Кесслер необходимо сделать высев петлей (штрихами) на чашки Петри со средой Эндо. Посевной материал следует брать на петлю в минимальном количестве с таким расчетом, чтобы получить на чашках изолированные колонии. Чашки помещают в термостат с температурой (37 +/- 0,5) °C на 18-24 часа.
Из колоний, типичных для БГКП (темно-красные, часто с металлическим блеском или розовые), готовят мазки на предметных стеклах, окрашивают их по Граму и микроскопируют. Обнаружение грамотрицательных палочек указывает на наличие БГКП.
При обнаружении на среде Эндо мелких бесцветных колоний, характерных для возбудителей острых кишечных инфекций, микробиолог лаборатории немедленно передает чашки для идентификации в территориальную санэпидстанцию.
|
|
|
2.3. Определение коли-индекса газированных безалкогольных напитков
Перед анализом напиток, насыщенный двуокисью углерода, переносят в стерильную закрытую ватной пробкой коническую колбу или в другую посуду и подогревают при частом перемешивании круговыми движениями на водяной бане при температуре от 30 до 35 °C до тех пор, пока из него не перестанут выделяться пузырьки газа.
При анализе напитков мембранным методом, по окончании фильтрации, фильтр промывают стерильной питьевой водой от оставшейся кислоты и консерванта, после чего переносят на среду Эндо.
При анализе напитков бродильным методом проводят предварительную нейтрализацию напитка 10% раствором бикарбоната натрия до слабощелочной реакции (рН 7,2 - 7,4). Реакцию среды проверяют на рН-метре или универсальной индикаторной бумаге.
2.4. Методика и последовательность проведения санитарно-микробиологического анализа бутылочного и баночного пива
Готовое пиво в бутылках и банках анализируют после мембранной фильтрации и инкубации в питательной среде на предмет обнаружения дрожжей, бактерий и плесени.
Анализ пива с линии розлива, выполненный в день отбора проб, называется «0-дневным анализом» или «анализом гигиены розлива», так как с его помощью выявляют микроорганизмы, попавшие в пиво из тары, укупорочного материала, самого блока розлива, впрыскной воды и окружающего воздуха и являющиеся результатом вторичного инфицирования продукта.
|
|
|
Анализ пива, выполненный через 11±1 день после розлива, называется «10-дневным анализом» или «анализом гигиены продукта». В течение 10 дней хранения при комнатной температуре аэробные микроорганизмы подавляются углекислым газом, растворённым в пиве, и лучше развивается микрофлора, типичная для пива. Поэтому для «10-дневного анализа» наиболее важен результат анаэробного посева.
С линии розлива отбирают 6-10 укупоренных бутылок (банок)
пивом. Половину отобранного пива (3-5 упаковок) подвергают анализу в день отбора. Остальные 3-5 упаковок выдерживают в темном месте (шкафу) при температуре +25 °С или при комнатной температуре в течение 11±1 дней и после этого анализируют. Для «10-дневного анализа» наиболее важен результат анаэробного посева.
Наружная поверхность бутылки или банки нестерильна. Во избежание искажения результата анализа её необходимо обработать.
- Бутылочное пиво:горлышко укупоренной бутылки окунают в 70% этиловый спирт, после чего пробку открывают профламбированным ключом, а горлышко открытой бутылки фламбируют. (Ни в коем случае нельзя фламбировать горлышко укупоренной, бутылки во избежание её взрыва).
|
|
|
- Баночное пиво:верх банки опрыскивают 70% этиловым спиртом, фламбируют, дают банке остыть, после чего откупоривают, продев в кольцо профламбированный пинцет.
Проведение анализа
1. 100 см3 пива из каждой упаковки пропускают через мембранный фильтр с диаметром пор 0,45 нм.
2. Фильтр промывают примерно 20 см3 стерильной дистиллированной воды для удаления остатков пива.
3. Фильтр разрезают стерильным скальпелем на две половины.
4. Каждую из половинок фильтра аккуратно снимают профламбиро-ванным пинцетом и помещают на чашку Петри диаметром 5 см, предварительно залитую средой сусло-агар без актидиона или средой UBA (универсальный пивной агар).
5. Одну половинку фильтра инкубируют в аэробных условиях в течение трёх дней при температуре 25 °С.
6. Вторую половинку фильтра инкубируют в анаэробных условиях в течение 11±1 дней при 25 °С.
7. Выросшие колонии разделяют на бактерии, дрожжи и плесень.
8. Бактерии подвергают каталазному тесту для выявления лактобацилл и педиококков, учитываемых отдельно.
9. Результаты, полученные на каждой половинке фильтра, умножают на 2 для получения общего количества в 100 см3 пробы.
10. Для «10-дневного анализа» результаты аэробного и анаэробного посевов регистрируют отдельно. Учитывают наивысший из двух показателей.
Для «10-дневного анализа» наиболее важен результат анаэробного посева.
Контрольные вопросы
Какие продукты подлежат контролю в пивоваренном производстве?
Какие особенности микробиоценоза безалкогольных напитков и минеральных вод?
Какие существуют недостатки пива, и чем они обусловлены?
Какие приемы используют для улучшения качества пива?
Какие особенности производственного микробиологического контроля безалкогольной продукции?
Как осуществляется санитарно-микробиологический контроль минеральных вод?
Как осуществляется микробиологический контроль пивных дрожжей на производстве?
В чем сущность микробиологического контроля сусла?
Как осуществляется микробиологический контроль готового пива?
На чем основан метод мембранных фильтров?
Как определяют БГКП в пиве и квасе?
Какие особенности определения коли-индекса газированных безалкогольных напитков?
Какая последовательность проведения санитарно-микробиологического анализа бутилированного баночного пива?
Какой временной интервал между анализом гигиены разлива и анализом гигиены продукта пива?
Как осуществляется взятие проб пива из бутылок и банок?
ПРИЛОЖЕНИЕ К ЗАНЯТИЮ №10
1. Санитарно-микробиологический контроль пивоваренного и безалкогольного производства осуществляют в соответствии с нормативными документами. Микробиологический контроль на предприятиях проводят по технологическим участкам согласно схеме.
В пивоваренном производстве микробиологическому контролю подлежат:
- ячмень, солод, несоложенные материалы;
- вода;
- дрожжи пивные;
- сусло;
- пиво готовое;
- бутылки;
- укупорочные материалы.
Усиленный контроль ведут за качеством обработки посуды, оборудования, коммуникаций автоцистерн. Не реже 1 раза в месяц проверяют питьевую воду на соответствие требованиям нормативных документов по бактериологическим показателям.
2. Краткая характеристика безалкогольных и слабоалкогольных напитков
К безалкогольным напиткам относят искусственные или натуральные газированные и минеральные воды и другие напитки, в производстве которых используют процесс брожения. Напитки последней группы содержат некоторое количество этилового спирта и к безалкогольным относятся весьма условно, например, в квасе содержание спирта может достигать 1,5%, в мёде - ещё больше. По сути дела, это - слабоалкогольные напитки.
Искусственные газированные воды готовят из растворов солей или на искусственных сиропах с различными добавками. Натуральные безалкогольные напитки готовят либо на основе натуральных соков, либо на экстрактах из соответствующих плодов и ягод. Все напитки, в том числе и натуральные, насыщают углекислотой в специальных сатураторах, что значительно повышает их сохранность. В напитках, получаемых путём брожения, углекислый газ образуется в процессе их приготовления. Кислая реакция готового продукта тормозит рост микрофлоры. Тем не менее, такие патогенные микроорганизмы, как шигеллы, сальмонеллы, вибрионы и энтеропатогенные эшерихии способны довольно длительно сохраняться в пиве по сравнению с другими безалкогольными напитками (квас, лимонад и др.), чему весьма способствует более щелочная реакция пива (рН 5,0).
3.Технологические аспекты производства пива
Пиво - это пенящийся алкогольный напиток с содержанием этилового спирта 2-9%. Технология получения пива включает брожение крахмалистых веществ проросших зёрен ячменя (солода) или других злаков с добавлением воды, дрожжей, хмеля и различных ароматических веществ, но без перегонки.
В производстве пива используют только культурные расы пивных дрожжей, которые вызывают брожение пивного сусла. При температуре +6-10 °С возникает низовое брожение, а при +14-25 °С - верховое. В процессе брожения в пива накапливаются этиловый спирт, углекислый газ и другие биологически активные вещества.
Процесс пивоварения состоит из следующих этапов:
· производство солода;
· варка сусла;
· сбраживание пивного сусла;
· выдержка и созревание пива;
· осветление пива;
· розлив в тару.
Поскольку производство пива и безалкогольных напитков осуществляют в нестерильных условиях, на отдельных стадиях технологического процесса возможна контаминация продукта различными видами микроорганизмов. Для многих слабо- и безалкогольных напитков характерна своя сапрофитная микрофлора. Так, например, при изготовлении кваса сочетают 2 процесса - молочнокислое брожение, вызываемая соответствующими бактериями, и спиртовое брожение, обусловленное дрожжами. Кроме дрожжевых и молочнокислых бактерий, пиво и безалкогольные напитки могут содержать довольно большие количество кокков, сарцин, грамположительных бацилл. Сапрофитные микроорганизмы способны привести к порче напитков, поэтому их присутствие недопустимо.
4. Технологические дефекты и недостатки пива, и микроорганизмы их обуславливающие
При несоблюдении стандартов и технических условий пиво приобретает дефекты, снижающие его качество:
1. В напитках с высоким содержанием сахара могут размножаться иобразовывать слизь бактерии рода Leiconostoc, в частности, L. mesenteroides. Эти ароматические бактерии, представляющие собой грамположительные кокки удлинённой формы, располагающиеся попарно или короткими цепочками, хорошо развиваются в присутствии дрожжей. На МПА сглюкозой растут в виде слизистых прозрачных колоний. Контаминируют пиво через добавляемые углеводы (глюкоза, сахароза и др.).
2. Прогорклый масляный запах и вкус пиву придают бактерии рода Pedicoccus (P. cerevisial, P. visiscous) за счёт образования диацетила. Это грамположительные кокки, которые могут контаминировать пиво при прохождении его по трубопроводам.
3. Шелковистая муть в пиве образуется вследствие образования диацетила, уксусной и молочной кислот бактериями рода Lactobacillus. В данном случае источники инфицирования пива - пивные дрожжи, технологическое оборудование и трубопроводы.
4. Так называемые дикие дрожжи существенно влияют на вкус и запах пива, давая осадок и плёнку. Они образуют этилацетат, амилацетат, изобутанол и амиловый спирт. Потребляя спирты и кислоты в присутствии кислорода, «дикие» дрожжи изменяют кислую реакцию среды на щелочную. «Дикие» сахаромицеты, в частности, S. distaticus, S. bayanus, S. cerevisiae, снижают содержание экстракта в пиве, придавая ему как бы «пустой» вкус, образуют ацетальдегид, изобутанол, изоаминол и этилкаприлат.
5. Кислый вкус и неприятный запах придают пиву представители семейства Enterobacteriaceae:
- Obesumbacterium spp. (О. proteus) - сообщают готовому продукту фруктовый вкус и запах за счёт образования диметилсульфида, изобутанола и др.;
- Enterobacter spp. - чаще инфицируют ячмень и солод, придают пиву молочный или сернистый привкус;
- бактерии рода Klebsiella, инфицирующие сырьё и воду, придают пиву привкус фенола за счёт дезаминирования тирозина;
- бактерии рода Citrobacter размножаются в самом начале процесса брожения, могут контаминировать воду. Они сообщают пиву сернистый привкус за счёт образования диметилсульфида, пируватов, лактатов и сукцинатов.
6. Наиболее опасными для пива в микробиологическом плане следует считать бактерии рода Zymomonas (Z. anaerobia). Они вызывают порчу пива в процессе верхового брожения, придавая ему привкус гнилых яблок. При этом основными метаболитами выступают этанол, углекислый газ, ацетальдегид, уксусная и молочная кислоты.
7. Плесневые грибы родов Aspergillus, Penicillum, Fusarium, размножаясь на стенах и потолках сырых помещений, в трубопроводах и сырье (ячмень, солод), также обусловливают порчу пива.
5. Для улучшения качества пива используют ряд приёмов:
· пастеризацию, существенно снижающую количество микроорганизмов в готовом пиве;
· фильтрацию, освобождающую пиво только от наиболее крупных микробных клеток и дрожжей;
· обработку пива стабилизаторами;
· добавление в периоды дображивания или осветления протеолитических ферментов;
· обработку готового пива полиамидами (с целью повышения коллоидной стойкости напитка).
6. Технологические особенности безалкогольных напитков
В группу безалкогольных напитков входят:
· газированная вода;
· газированные прохладительные напитки (лимонады);
· напитки типа «кола»;
· тонизирующие напитки;
· натуральные соки, морсы, сиропы, экстракты;
· шипучие напитки и др.
В производстве безалкогольных напитков специфическую микрофлору не применяют. Санитарно-гигиенические нарушения, использование контаминированных сырья, питьевой воды, розлив в недостаточно вымытые ёмкости приводят к развитию попавшей извне микрофлоры, которая вызывает помутнение напитков, выпадение осадка в виде хлопьев, появление бродильного привкуса. В напитках не должно быть патогенных микроорганизмов, а санитарно-бактериологические показатели должны соответствовать нормативам.
Натуральные соки производят осветлённые и с мякотью, обязательно из доброкачественных плодов, в противном случае в них могут развиться дрожжи, плесневые грибы и молочнокислые бактерии. Для предупреждения порчи соков их подвергают пастеризации при температуре 70 °С в течение 10 мин. Такая обработка губительно действует на споровые и вегетативные формы микроорганизмов. При изготовлении сиропов соки уваривают до концентрации сахара 60%.
Пастеризация и рецептурный состав напитков типа «кола» (кока-кола, пепси-кола) позволяют гарантировать их качество в течение 6 мес при условии хранения в охлаждённом состоянии и без доступа света.
7. Особенности производственного микробиологического контроля безалкогольной продукции
При производственном микробиологическом контроле обращают внимание на качество питьевой воды (соответствие нормативным документам), сахара-песка - допускается содержание не более 103 микроорганизмов в 1 г. В соках, содержащих этиловый спирт, разрешается содержание не более 300 клеток дрожжей в 1 см3. При превышении норматива проводят дополнительное сепарирование или фильтрацию через фильтр-картон. В концентрированных соках не допускается наличие дрожжей в 1 см3, другие микроорганизмы регламентированы в количестве единичных клеток. Дрожжи должны отсутствовать в 3 см3 концентратов плодово-ягодных напитков. В красителях (колер и др.) в 1 см3 возможно присутствие единичных клеток, дрожжей быть не должно. В купажных сиропах без консерванта допускается не более 300 клеток дрожжей в 1 см3, а с консервантом - единичные клетки, в готовых напитках без консерванта - не более 100 в 1 см3, с консервантом (настои и ароматизаторы) - не более 10, в соках - не более 50 в 1 см3.
По коли-индексу напитки должны соответствовать требованиям ГОСТа. При контроле аппаратуры и оборудования допускается в укупорочном материале не более 100 клеток на 1 пробку, а в смывных водах после мойки оборудования - не более 100 клеток в 1 см3. Стойкость напитков, приготовленных на фруктово-ягодных соках, при стабильных микробиологических показателях составляет не менее 7 сут, на настоях и эссенциях - 15 сут, с консервантом - 1 мес.
8. Особенности санитарно-микробиологического контроля
минеральных вод
Минеральные воды могут быть натуральными (природными) и искусственными, негазированными и газированными. В зависимости от степени минерализации природные воды делятся на питьевые (столовые) лечебно-столовые и лечебные. Искусственные минеральные воды получают путём добавления некоторых солей в очищенную питьевую воду. Срок хранения минеральных вод при условии соблюдения всех правил
требований, изложенных в ГОСТах, составляет один год, за исключением железистых вод, срок хранения которых ограничен 4 мес.
Объектами санитарно-бактериологического контроля на предприятиях, выпускающих минеральные воды, служат питьевая и минеральная вода, готовая продукция, кронен-пробки, бутылки и другие ёмкости, а также оборудование.
При показателе коли-индекса более 3 минеральную воду выдерживают на карантине. Затем периодически (через 3, 5, 10 и 30 дней) проводят повторные санитарно-бактериологические анализы. Если при этом получают неудовлетворительные результаты, запрещают реализацию воды. Особое внимание уделяют контролю питьевой воды при производстве искусственных минеральных вод. Обнаружение бактериального обсеменения, превышающего допустимые нормы, при контроле кронен-пробок, бутылок и оборудования, служит основанием для повторной санитарной обработки, дезинфекции и изменения режима мойки посуды.
З А Н Я Т И Е 11
Дата ______________
Тема: Санитарно-микробиологический контроль качества хлеба
И хлебобулочных изделий.
План занятия:
1. Разбор методов отбора проб муки и отрубей, основные понятия и термины.
2. Определение картофельной палочки в муке и хлебе.
3.Определение заражённости муки картофельной палочкой методом
пробной лабораторной выпечки хлеба.
4. Микробиологическая оценка качества дрожжевой культуры и выявление посторонних дрожжей и бактерий.
Методические указания
1. Разбор методов отбора проб муки и отрубей,
основные понятия и термины
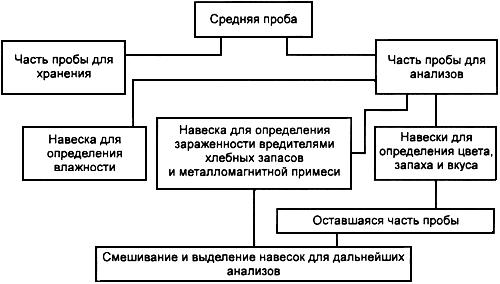
Точечная проба - небольшое количество муки и отрубей, отобранное из одного места за один прием, в определенный момент или промежуток времени, предназначенное для составления объединенной пробы. Масса одной точечной пробы должна быть 200-300 г. Масса всех отобранных точечных проб должна быть не менее 2,0 кг.
Объединенная проба - совокупность всех точечных проб, отобранных из партии муки и отрубей. Если масса объединенной пробы не превышает 2,0 кг, то она одновременно является и средней пробой.
Средняя проба - часть объединенной пробы, выделенная для определения качества партии. Масса средней пробы должна быть не менее 2,0 кг.
Навеска - часть средней пробы, выделенная для определения отдельных показателей качества муки и отрубей.
Выборка - определенное количество штучной продукции, отобранное для контроля из партии продукции.
2. Определение картофельной палочки в муке и хлебе
В стерильной воде готовят 10% эмульсию из муки и хлеба и засевают по 1 см3 в пробирки с 10 см3 мясопептонного бульона в разведении 1:100 и 1:1000. Через 2 сут содержания в термостате при температуре 37 °С делают высев. Для этого используют ломтики пшеничного хлеба из муки высшего сорта, простерилизованные при давлении 1,5 атм. в течение 20 мин.
В стерильные чашки Петри помещают стерильные ломтики белого хлеба и на них наносят по 10 см3 мясопептонного бульона из пробирок с эмульсией. Чашки помещают в эксикатор, на дно которого вносят немного стерильной воды и после 2-3-суточного инкубирования при температуре 37 °С просматривают, отмечая характерные признаки картофельной болезни. По степени разведения засеянной эмульсии рассчитывают количество картофельной палочки в образцах.
3.Определение заражённости муки картофельной палочкой методом
пробной лабораторной выпечки хлеба
Сущность метода состоит в том, что из муки выпекают три хлебца массой по 500 г. Хлебцы заворачивают в чистое, влажное полотенце и помещают в термостат при температуре 37 °С. Первый хлебец исследуют на признаки картофельной болезни через сутки содержания в термостате, второй - через двое суток, третий - через трое суток. Если признаки картофельной болезни обнаружены в первом хлебце, считают, что мука сильно заражена, если болезнь обнаружена только во втором хлебце, то муку считают средней степени заражённости, наконец, если признаки болезни обнаружены только в третьем хлебце - слабо заражённой картофельной палочкой.
4. Микробиологическая оценка качества дрожжевой культуры и выявление посторонних дрожжей и бактерий
Данный метод включает микроскопирование и определение наличия посторонних микроорганизмов путем посева в плотные питательные среды.
Микроскопированию подвергают односуточную культуру из жидкого солодового сусла. Одну каплю взвеси с помощью стерильной пипетки наносят на чистое предметное стекло и накрывают покровным стеклом (оба стекла предварительно протирают спиртом). Подготовленный препарат помещают на предметный столик микроскопа и просматривают десять полей зрения при увеличении в 600-800 раз. При просмотре не должно быть обнаружено ни посторонних дрожжевых грибков, ни бактерий.
При посеве в плотные питательные среды и чашки Петри одну петлю агаровой культуры вносят в пробирку со стерильной водой. После тщательного размешивания 1-2 капли взвеси наносят на поверхность твердой питательной среды (агар-сусло с мелом) и размазывают шпателем Дригальского. Затем этот шпатель переносят во вторую чашку с такой же средой и размазывают остатки на шпателе - посев с переносом или истощающий посев. Одну петлю культуры со скошенного агара вносят в пробирку с ацетатной средой.
Чашки с посевами ставят в термостат при 30 °С крышкой вниз и выдерживают там в течение 48 ч, после чего подсчитывают выросшие колонии дрожжей и бактерий. Подсчитывают отдельно колонии основной культуры (сахаромицетов), посторонних дрожжевых грибков и бактерий и вычисляют процентное соотношение их.
Внешний вид колоний всех этих микроорганизмов различен:
· сахаромицеты образуют колонии белого или слегка желтоватого цвета, выпуклые, с гладкой блестящей поверхностью и ровным краем;
· посторонние грибки (несахаромицеты) образуют колонии, различные по внешнему виду в зависимости от рода и вида этих грибков: плоские или слегка выпуклые, сероватого цвета или белые, с поверхностью слегка складчатой или матовой, ворсинчатой, с ровным, фестончатым или ворсинчатым краем;
· из бактерий чаще всего присутствуют кислотообразующие бактерии (лейконосток, агглютинирующие бактерии), спорообразующие бактерии и кокковые формы (сарцины или педиококки):
- кислотообразующие и агглютинирующие бактерии образуют колонии, по внешнему виду похожие между собой: круглые, полупрозрачные, слегка опалесцирующие, просветляющие мел и образующие различной интенсивности и ширины зону просветления вокруг своих колоний, диаметр колоний от 0,5 до 1 мм.
- спорообразующие бактерии образуют довольно крупные колонии диаметром 3-10 мм, сухие или слизистые, с ровным или фестончатым краем.
- педиококки или сарцины образуют желтые, реже белые, складчатые или гладкие колонии разного размера.
Для выявления бактериальной инфекции используется среда с нистатином, методика посева та же. На всех чашках не должно быть обнаружено колоний посторонних микроорганизмов (дрожжей и бактерий). При посеве на элективную (ацетатную) среду выявляются в исследуемом материале даже единичные клетки посторонних дрожжевых грибков.
Засеянную пробирку с ацетатной средой помещают в термостат при температуре 30 °С и ведут за ней ежедневные наблюдения в течение не менее чем 5-6 дней. Появление пленки на поверхности среды или помутнение ее указывают на наличие в культуре посторонних дрожжевых грибов. О степени загрязненности этими микроорганизмами судят по срокам появления пленки или мути. Культура считается чистой, если в течение всего периода наблюдения пленка или муть не появились.
Контрольные вопросы
Дайте определение понятиям точечная, объединённая, средняя пробы, навеска, выборка?
В чем сущность метода определения картофельной палочки в муке и хлебе?
Как можно определить зараженность муки картофельной палочкой?
Как осуществляется микробиологическая оценка качества дрожжевой культуры?
Какими способами можно выявить посторонних дрожжей и бактерий?
Какая среда используется для выявления бактериальных инфекций хлеба?
Какие существуют возбудители болезней хлеба?
В чем заключаются характеристика и особенности картофельной болезни хлеба?
Какие существуют рекомендации по борьбе с картофельной болезнью хлеба?
Какие приемы лечения и профилактики картофельной болезни хлеба существуют в настоящее время?
ПРИЛОЖЕНИЕ К ЗАНЯТИЮ №11
1. Классификация возбудителей болезней хлеба
Во время уборки урожая, при размоле зерна с пылью в муку попадают микроорганизмы, в том числе и опасные для здоровья человека, которые приводят к порче хлебобулочных изделий, употребление которых ведёт к пищевым отравлениям:
· бактерии: В. mesentericus, В. mycoides, В. megatherium, вызывающие картофельную болезнь хлеба:
· Serratia marcescens, вызывающие «кровавую» болезнь хлеба, проявляющуюся образованием налёта красного цвета на поверхности хлеба за счёт пигмента микроорганизма;
· грибы:Monilia variabilis, Endomyces fibuliger, вызывающие меловую порчу хлеба, возникает как результат наличия в мякише колоний грибка в виде образований белого цвета, напоминающих мел;
· грибы - продуценты микотоксинов:
- Aspergillus flavus (афлатоксины);
- Penicillium viridicatum (охратоксины);
- Fusarium nivale, roseum, solani и другие, вызывающие микотоксикозы у людей и плесневение хлеба.
2. Характеристика и особенности картофельной болезни хлеба
Споры В. mesentericus (картофельной палочки) попадают в муку при
размоле зерна, которое заражается, как правило, в процессе уборки. Это
споры выдерживают нагревание до температуры 120 °С в течение 1 ч,
температура в мякише при выпечке хлеба не превышает 100 °С, поэтому
споры не погибают. Температура хранения около +40 °С, высокая влажность - оптимальные условия для развития спор.
Кислая среда угнетает развитие картофельной палочки, и в ржаном хлебе, имеющем большую кислотность, чем пшеничный, картофельная болезнь не возникает. При нарушении санитарно-технического режима хранения зерна, муки, выпечки и реализации хлеба создаются условия для размножения картофельной палочки. Болезнь вызывают штаммы картофельной палочки, обладающие высокой протеолитической и амилолитической активностью. Под действием высокоактивных ферментов - амилаз в хлебе увеличивается количество декстринов, придающих мякишу хлеба излишнюю липкость. Продукты распада белков, образующиеся в результате действия протеолитических ферментов, обладают резким специфическим запахом. Внешне картофельная болезнь хлеба характеризуется очаговым, влажным ослизнением мякиша с желтовато-коричневым цветом и гнилостным запахом. При разламывании хлеба видны тонкие тягучие нити. Употребление такого хлеба может привести к пищевому отравлению.
3. Схема лабораторного анализа проб муки и отрубей
4. Признаки, характерные для картофельной палочки:
• образование спор;
• положительная окраска по Граму;
• рост на срезе картофеля в виде складчатого налета;
• рост на поверхности мясопептонного бульона в виде морщинистой пленки;
• разжижение желатина;
• ферментация глюкозы и сахарозы до кислоты без газа;
• отсутствие ферментации лактозы.
5. Рекомендации по борьбе с картофельной болезнью хлеба:
1. Из заражённой муки выпекать хлебобулочные изделия весом не более 0,2 кг.
2. Повышать кислотность хлеба на 1 градус.
3. Хлеб после выпечки подвергать немедленному охлаждению до 18 °С и реализовывать в течение 24 ч.
4. Хранить хлеб при температуре не более 15 °С в светлом, хорошо вентилируемом помещении. Неохлаждённый хлеб не отпускать.
5. Готовить ржано-пшеничные смеси для выпечки хлеба, так как в ржаном хлебе картофельная палочка не развивается.
6. Все производственные помещения хлебопекарни и инвентарь обязательно очистить и продезинфицировать 1% соляной или 3% уксусной кислотой.
7. Хлеб, поражённый картофельной болезнью, не возвращают на хлебозавод из-за опасности заражения помещений хлебозавода картофельной палочкой. Пораженный хлеб уничтожают на месте.
В последнее время широкую популярность приобрело использование хлебопекарного улучшителя «МАЖИМИКС светло-зеленый» (Франция). Этот улучшитель подавляет развитие картофельной палочки и используется как для профилактики, так и для «лечения» уже выявленной болезни. В состав улучшителя входят аскорбиновая кислота, лимонная кислота, соли кальция и ряд других добавок.
З А Н Я Т И Е 12
Дата ______________
Тема: Методы санитарно-бактериологического контроля на объектах питания (определение СПМ методом смывов и методом отпечатков).
План занятия:
1. Правила и техника взятия смывов для санитарно-бактериологических
исследований на объектах питания.
2. Методика посева смывов на бактерии группы кишечных палочек.
3. Методика посева смывов на общую бактериальную обсемененность.
4. Методика посева смывов на S. aureus.
5. Метод отпечатков на «Бактотест» со средой Эндо при санитарно-бактериологическом контроле на объектах питания.
Методические указания
1. Правила и техника взятия смывов для санитарно-бактериологических исследований на объектах питания
Взятие смывов производится с помощью стерильных увлажненных ватных тампонов. Стерильные ватные тампоны на стеклянных, металлических или деревянных палочках, вмонтированных в пробирки с ватными пробками, заготавливают заранее в лаборатории. В день взятия смывов в каждую пробирку с тампоном наливается (в условиях бокса над горелкой) по 5 мл стерильного 0,1% водного раствора пептона или изотонического раствора хлорида натрия таким образом, чтобы ватный тампон не касался жидкости. Непосредственно перед взятием смыва тампон увлажняют наклонением пробирки или опусканием тампона в жидкость. В процессе отбора смывов рекомендуется неоднократное смачивание тампонов.
При взятии смывов необходимо пользоваться следующими рекомендациями:
1) Из оборудования следует обращать внимание на разделочные доски, мясорубки, производственные столы для готовой пищи, особенно в цехе приготовления холодных закусок.
2) Смывы с рук, с санитарной одежды, полотенец берутся в основном у работников, имеющих дело с продукцией, не подвергающейся в дальнейшем тепловой обработке (персонал кухни, холодного цеха, раздатчицы, буфетчицы, официанты, продавцы).
3) Смывы с крупного оборудования и инвентаря берут с поверхности в 100 см2, для ограничения поверхностей используют шаблон (трафарет), сделанный из проволоки, металлической пластинки. Трафарет имеет площадь 25 см2, чтобы взять смывы с площади в 100 см2, его накладывают 4 раза в разных местах поверхности контролируемого объекта.
4) При взятии смывов с мелких инструментов обтирается вся поверхность предмета, при заборе смывов с тарелок протирают всю внутреннюю поверхность. При взятии смывов с мелких предметов одним тампоном протирают три одноименных объекта - три тарелки, три ложки и т.п. У столовых приборов протирают их рабочую часть.
5) При исследовании стаканов протирают внутреннюю поверхность и верхний наружный край стакана на 2 см вниз.
6) При взятии смывов с рук протирают тампоном ладонные поверхности обеих рук, проводя не менее 5 раз по каждой ладони и пальцам, затем протирают межпальцевые пространства, ногти и подногтевые пространства.
7) При взятии смывов с санитарной одежды протирают 4 площадки по 25 см2 - нижнюю часть каждого рукава и 2 площадки с верхней и средней частей передних пол спецовки. С различных мест полотенца берут 4 площадки по 25 см2.
После проведения смыва тампон вкладывают в ту же пробирку, погружая в жидкость. На каждой пробирке отмечают порядковый номер. Под тем же номером записывают в протокол наименование объекта, с которого взят смыв. При взятии смывов с рук и санитарной одежды записывают фамилию, имя и отчество сотрудника, выполняемую работу (профессия, участок работы). Смывы доставляют в бактериологическую лабораторию в течение 2 ч. Допускается их хранение и транспортирование не более 6 ч при температуре +1-10 °С.
2. Методика посева смывов на бактерии группы кишечных палочек
При плановых санитарно-гигиенических обследованиях для выявления БГКП производят посевы смывов на среды Кесслер с лактозой или КОДА, при этом в пробирку со средой опускают тампон и переносят оставшуюся смывную жидкость. Посевы инкубируют при 37 °C, через 18-24 часа со среды Кесслер производят высев на плотную дифференциальную среду Эндо, со среды КОДА высев производят только в случае изменения окраски среды или ее помутнения. Чашки помещают в термостат с температурой 37 °C на 18-20 часов. Посевы просматривают. Из колоний, подозрительных или типичных для БГКП, готовят мазки, окрашивают по Граму и микроскопируют. Обнаружение грамотрицательных палочек указывает на наличие БГКП.
При оценке результатов санитарно-микробиологического обследования исходят из правила, гласящего, что в смывах, взятых с объектов продовольственного назначения, БГКП должны отсутствовать. Обнаружение БГКП в смывах с поверхностей чистых, подготовленных к работе предметов, инвентаря, оборудования, рук и специальной одежды персонала свидетельствует о нарушении санитарного режима.
3. Методика посева смывов на общую бактериальную обсемененность
Общую бактериальную обсемененность определяют для установления эффективности санитарной обработки посуды в посудомоечных машинах, а также при оценке новых моющих и дезинфицирующих средств. Для этого перед посевом в пробирку с тампоном (смыв) добавляют 5 мл 0,1% пептонной воды или изотонического раствора хлорида натрия. Тампон тщательно отмывают, после чего 1,0 мл смывной жидкости помещают в чашку Петри и заливают расплавленным МПА. Чашки помещают в термостат при 30 °C. Предварительный подсчет выросших колоний производят через 48 часов, окончательный - через 72 часа. Количество колоний, выросших на чашке, умножают на 10 для определения общего количества бактерий, содержащихся на поверхности исследуемого предмета.
4. Методика посева смывов на S. aureus
Исследование смывов на стафилококки проводят при обследовании кремово-кондитерских цехов, столовых и ресторанов, молочных кухонь и других пищеблоков, обращая особое внимание на контроль рук персонала. Для выявления S. aureus посев смывов производят на чашки с МСА или ЖСА, непосредственно втирая посевной материал тампоном, затем последний погружают в пробирку с 6,5% солевым бульоном. Посевы инкубируют при 37 °C в течение 18-24 часов, чашки с плотными средами оставляют еще на сутки при комнатной температуре. После инкубации просматривают посевы на МСА или ЖСА, при этом стоит отметить, что на средах, содержащих желток, стафилококк, выделенный от человека, образует у 60-70% выделенных культур венчик вокруг колонии (положительная лецитовителлазная реакция). Стафилококки животного происхождения дают положительную лецитовителлазную реакцию в 5-10% культур. На МСА стафилококки образуют пигмент: золотистый, кремовый, эмалево-белый и др. Изолированные колонии, подозрительные на стафилококк, изучают, микроскопируют с окраской по Граму и высевают на скошенный МПА или на сектора чашки с молочным агаром. Из пробирки с 6,5% солевым бульоном производят высевы на сектора чашки с молочным агаром. Все посевы инкубируют при 37 °C в течение 18-24 часов. Выделенную чистую культуру с секторов на чашках с молочным или из пробирок со скошенным МПА подвергают микроскопии с окраской по Граму. При наличии мелких грамположительных кокков ставят реакцию плазмокоагуляции по общепринятой методике.
5. Метод отпечатков на «Бактотест» со средой Эндо при санитарно-бактериологическом контроле на объектах питания
Данный метод рекомендуется использовать для контроля эффективности санитарной обработки рабочих поверхностей, кухонного инвентаря, посуды, спецодежды и рук обслуживающего персонала.
«Бактотесты» представляют собой круглые ванночки площадью 10 см2 с крышками, выпускаемые стерильными, упакованными по 24 штуки в герметизированные пеналы и предназначенные для разового использования. Перед началом исследования необходимо приготовить среду Эндо в соответствии с наставлением по ее применению, открыть пенал с «Бактотестами», вынуть их из пенала и снять крышки; расположить «Бактотесты» на горизонтальной поверхности; прокипяченную и слегка остуженную среду Эндо разлить по 2 мл в каждую ванночку; после застывания и охлаждения среды Эндо ванночки закрыть крышками и упаковать в пеналы. Подготовленные к работе «Бактотесты» можно хранить при комнатной температуре в течение 4-х суток в сухом и защищенном от света месте.
Взятие отпечатков проводят готовыми (заправленными) «Бактотестами» путем легкого прижатия средой Эндо к обследуемой поверхности. При этом на один «Бактотест» берут 10 отпечатков (обследуемая площадь 100 см2) с поверхности больших предметов: разделочные доски, столы, весы, кастрюли, котлы, разделочные ножи, разливные ложки, тарелки, спецодежда обслуживающего персонала; один «Бактотест» используют для обследования трех мелких предметов: стаканы, чашки, столовые и чайные ложки, вилки, столовые ножи; при обследовании рук обслуживающего персонала на один «Бактотест» делают отпечатки со всех пальцев. Использованные «Бактотесты» маркируют восковым карандашом и упаковывают в пенал, закрыв крышками. После взятия отпечатков проводят инкубацию «Бактотестов» со средой Эндо в термостате при 37 °С в течение 18-24 часов. Выросшие колонии, подозрительные на бактерии группы кишечной палочки по внешнему виду и по морфологии мазков, окрашенных по Граму, высевают на среду Гисса с глюкозой в пробирки с поплавками с последующей инкубацией в термостате при 37 °С в течение 18-24 часов. Заключение о наличии микробов группы кишечной палочки на обследованных объектах делается на основании образования кислоты и газа в пробирках со средой Гисса.
Контрольные вопросы
Как осуществляется санитарно-микробиологический контроль на объектах питания?
С помощью каких приспособлений производится взятие смывов?
Какие существуют рекомендации при взятии смывов?
В течение какого времени после взятия смывов следует проводить их анализ?
В чем заключается методика посевов смывов на БГКП?
Какие среды используются для выявления БГКП?
В чем заключается методика посева смывов на общую бактериальную обсемененность?
При обследовании каких объектов проводят исследование смывов на стафилококк?
Как осуществляется санитарно-бактериологический контроль методом отпечатков?
Что представляет собой «Бактотест»?
В каких случаях проводятся санитарно-бактериологические исследования на объектах питания?
Что служит объектами санитарно-бактериологических обследований в местах общественного питания?
Что входит в состав питательных сред Кесслер и КОДА?
Какие микроорганизмы являются индикаторами санитарного неблагополучия на пищевых предприятиях?
Какие методы отбора проб с предметов обихода вы знаете?
ПРИЛОЖЕНИЕ К ЗАНЯТИЮ №12
1. Принципы оценки результатов санитарно-бактериологического контроля:
- критерием высокого качества санитарной обработки оборудования, посуды, инвентаря и др. служит отсутствие на поверхности обработанных предметов санитарно-показательных, а также патогенных микроорганизмов;
- обнаружение значительной микробной обсемененности готовых продуктов сапрофитной микрофлорой должно расцениваться как показатель санитарного неблагополучия объекта;
- выявление высокой обсемененности готовых продуктов санитарно-показательными микроорганизмами следует расценивать как указание на возможность заражения этих продуктов патогенными микроорганизмами;
- обнаружение патогенных микроорганизмов в готовых выпускаемых или реализуемых продуктах (в определенных количествах продукта) расценивается как показатель эпидемического неблагополучия объекта;
- результаты санитарно-бактериологических исследований следует сравнивать с показателями стандартов или рекомендаций по допустимому уровню обсемененности продуктов микроорганизмами.
2. Санитарно-бактериологические исследования проводятся:
а) при плановых санитарных обследованиях объектов общественного питания и торговли, осуществляемых в порядке текущего санитарного надзора;
б) при обследованиях объектов в порядке предупредительного санитарного надзора с целью гигиенической оценки технологической линии производства новых видов пищевых продуктов (блюд); новых типов технологического и торгового оборудования, а также при вводе в эксплуатацию новых или реконструированных предприятий;
в) при контроле качества дезинфекции;
г) по санитарно-эпидемиологическим показаниям;
д) внеплановые.
3. Объекты санитарно-бактериологического обследования:
а) готовые блюда, кулинарные изделия, скоропортящиеся и особо скоропортящиеся пищевые продукты в предприятиях общественного питания и торговли;
б) в отдельных случаях сырье и полуфабрикаты (по ходу технологического процесса - по эпидпоказаниям, при высокой бактериальной обсемененности готовых продуктов, блюд и др.);
в) оборудование, инвентарь, посуда и др. с целью проверки эффективности санитарной обработки;
г) смывы с рук, санитарной одежды, личных полотенец (с целью проверки соблюдения правил личной гигиены персоналом);
д) вода центрального водоснабжения и особенно - местных источников водоснабжения (места водозабора и краны).
Особое внимание следует уделять контролю оборудования, инвентаря, посуды, которые используются по ходу технологического процесса в приготовлении, реализации продуктов и готовых блюд, прошедших термическую обработку или употребляемых в пищу без термической обработки (салаты, винегреты, гастрономические продукты, некоторые овощи, фрукты и др.).
4. Рецепты питательных сред.
Среда Кесслер с лактозой.
К 1 л водопроводной воды прибавляют 10 г пептона и 50 мл желчи крупного рогатого скота, кипятят смесь при помешивании 20-30 мин в водяной бане и фильтруют через вату. В полученном фильтрате растворяют 2,5 г лактозы и доводят объем до 1 л, устанавливают реакцию среды (pH 7,4 - 7,6), после чего добавляют 2 мл 1% водного раствора кристаллического фиолетового, разливают в пробирки по 5,0 мл, 10,0 мл и во флаконы по 50 мл. Готовая среда должна иметь темно-фиолетовый цвет. Среду стерилизуют при 1 атм. 10 мин., предварительно опустив в пробирки поплавки.
Состав среды КОДА: пептон сухой ферментативный, натрий хлористый, сульфанол порошок, бромтимоловый синий водорастворимый, сахар молочный (лактоза), натрий углекислый, солевой бульон.
З А Н Я Т И Е 13
Дата ______________
Тема: Микробиологическая диагностика пищевых токсикоинфекций и интоксикаций различной этиологии.
План занятия:
1. Микробиологическая диагностика пищевых токсикоинфекций.
1.1. Изучение морфологических, культуральных и биохимических свойств сальмонелл.
1.2. Исследование пищевых продуктов на наличие возбудителей пищевыхтоксикоинфекций: посев на среды обогащения и дифференциально-диагностические среды.
2. Методы микробиологической диагностики пищевых токсикоинфекций, вызываемых сальмонеллами и условно патогенными бактериями кишечной группы.
3. Методы микробиологической диагностики пищевых отравлений, вызываемых стафилококками.
4. Бактериологическая диагностика пищевой токсикоинфекции, вызванной B. cereus
Методические указания
1. Микробиологическая диагностика пищевых токсикоинфекций
1.1. Приготовить препараты-мазки из культур сальмонелл и кишечной палочки, окрасить по Граму, промикроскопировать и сравнить морфологию бактерий во всех препаратах. Препараты зарисовать. Изучить рост на жидких и плотных средах и биохимические свойства сальмонелл по готовым демонстрационным наборам сред "пестрого ряда".
1.2. Приготовить взвесь в физиологическом растворе кусочка пищевого продукта, зараженного сальмонеллами, и произвести посев взвеси на среду обогащения и на дифференциально-диагностическую среду Плоскирева или Эндо.
2.Методы микробиологической диагностики пищевых токсикоинфекций, вызываемых сальмонеллами и условно патогенными бактериями кишечной группы
Материалом для исследования служат испражнения, рвотные массы, кровь, промывные воды желудка, моча, послужившие причиной отравления продукты.
Особенности бактериологической диагностики сальмонеллезов:
1) использование сред обогащения (селенитовой, магниевой), в особенности при исследовании испражнений;
2) для обнаружения сальмонелл пробы следует брать из последней, более жидкой, части испражнений (верхнего отдела тонкого кишечника);
3) соблюдать соотношение 1:5 (одна часть испражнений на 5 частей среды);
4) в связи с тем, что S. arizonae и S. diarizonae ферментируют лактозу, использовать в качестве дифференциально-диагностической не только среду Эндо, но и висмут-сульфит-агар, на котором колонии сальмонелл приобретают черный (некоторые - зеленоватый) цвет;
5) для посева крови использовать среду Рапопорт;
6) использование для предварительной идентификации колоний О1-сальмонеллезного фага, к которому чувствительны до 98 % сальмонелл;
7) для окончательной идентификации выделенных культур вначале используют поливалентные адсорбированные О- и Н-сыворотки, а затем - соответствующие моновалентные О- и Н-сыворотки.
| Escherichia coli | Salmonella enteritidis |
| S. typhimurium | S. choleraesuis |
Особенности иммунологической диагностики сальмонеллезов.
1. Применение реакции иммунофлуоресценции как экспресс-метода для обнаружения сальмонелл.
2. Реакция агглютинации для выявления антител с парными сыворотками больного по типу реакции Видаля. Для реакции используют диагностикум, живые лабораторные культуры и аутоштаммы.
3. Применение реакции пассивной гемагглютинации с использованием О-эритроцитарного диагностикума для обнаружения антител и реакции Кумбса для обнаружения неполных антител.
3. Методы микробиологической диагностики пищевых отравлений,
вызываемых стафилококками
А. Бактериологический
| Материал: остатки пищи, рвотные массы, промывные воды, испражнения, смывы с предметов | ||
   МПБ с 6,5% и 10% хлористого натрия и МПБ с 1% глюкозы
МПБ с 6,5% и 10% хлористого натрия и МПБ с 1% глюкозы
| Кровяной МПА | Молочно-солевой агар |
 Ферментация маннита
Ферментация маннита
| МПА   МПБ МПБ
|  Микроскопия
Микроскопия
|
  Проба на
плазмокоагуляцию
Проба на
плазмокоагуляцию
| Определение фаготипа | Биологическая проба на кошках |
Б. Обнаружение стафилококковых энтеротоксинов: непрямой бактериологический, серологический и биологический методы.
В. Энтеротоксин на кошках определяют внутривенным введением материала. Полученный центрифугат или фильтрат стафилококковой культуры прогревают в кипящей водяной бане в течение 30 минут и вводят кошкам в вену уха или бедренную вену в количестве 0,5 мл на 1 кг веса. Наличие рвоты и поноса или только рвоты, наступившей в сроки от 30 минут до 3 часов, указывает на присутствие энтеротоксина.
4. Бактериологическая диагностика пищевой токсикоинфекции,
вызванной B. cereus
Первый этап:бактериоскопия исходного материала (рвотные массы, промывные воды, фекалии, пищевые продукты) и посев исследуемого материала на плотные питательные среды для выделения возбудителя и определения его количества. Для этого пищевые продукты титруют на децепроцентной (0,1%) пептонной воде до 10-7, фекалии, рвотные массы, промывные воды от 102 до 104. Затем по 0,1 см3 засевают на плотные питательные среды: Пивоварова (ЖСА с полимиксином и ТТХ), Никодемуса (желточно-спиртовой агар) или Чистовича (ЖСА). Температура инкубации составляет 37 °С, но лучше 30 °С. На среде Пивоварова учёт проводят через 48 ч, на средах Никодемуса и ЖСА - через 72 ч. Затем вычисляют индекс возбудителя.
Второй этап:изучение характера роста. На среде Пивоварова колонии розовые (могут быть красные) за счёт редукции ТТХ, окружённые зоной лецитиназной активности. На средах Никодемуса и Чистовича колонии цвета среды с зоной лецитиназного венчика вокруг колонии. После оценки роста 3-5 колоний пересевают на скошенный агар и параллельно на мясопептонный бульон, инкубируют при температуре 37 °С в течение 24 ч.
ИдентификацияВ. cereus.
1. Подвижность в раздавленной капле (+).
2. На среде Гисса с маннитом (-).
3. На среде Кларка за 48 часов образует ацетоин (реакция Фогеса-Проскауэра) (+).
4. На кровяном агаре гемолиз (+).
5. Окисление, ферментация глюкозы (++).
6. Каталаза (+).
Для доказательства идентичности выделенной культуры из различных материалов определяют метки.
Определение биоварана среде Гисса:
- лактоза (+/-);
- сахароза(+/_);
- глицерин (+/-),
- галактоза(+/-);
- дульцит (+/-);
- арабиноза (+/-).
Определение вирулентности:500 КОЕ вводят внутрибрюшинно двум белым мышам массой 10-15 г. На 1-4 сутки мыши погибают, и в органах обнаруживается В. cereus.
Этиологическую роль В. cereus при пищевых отравлениях можно признать (при отсутствии патогенных микроорганизмов) в следующих случаях, когда В. cereus:
1. Обнаружен в пищевых продуктах в количествах 105/г (см3) или более.
2. Обнаружен одновременно в рвотных массах, промывных водах, испражнениях в количестве 100 КОЕ/г (см3) и более.
3. Выделен из фекалий у большинства пострадавших.
4. Выделен из фекалий больного только в остром периоде болезни в количестве 100-1000 КОЕ/г и более с последующим исчезновением микроорганизма после выздоровления.
Контрольные вопросы:
В чем суть иммунофлуоресцентного метода диагностики брюшного тифа?
Какие микроорганизмы чаще всего вызывают пищевые токсикоинфекции?
Какие условия способствуют возникновению пищевых токсикоинфекций?
Какие сальмонеллы чаще всего оказываются возбудителями пищевых токсикоинфекций?
Каковы морфологические,тинкториальные, культуральные и биохимические свойства сальмонелл - возбудителей пищевых токсикоинфекций?
Каковы особенности патогенеза пищевых токсикоинфекций?
Какие микробиологические методы используются для диагностики пищевых токсикоинфекций?
Что подлежит исследованию при пищевых токсикоинфекциях?
На какие питательные среды следует сеять материал при пищевых токсикоинфекциях?
Как производится идентификация сальмонелл - возбудителей пищевых токсикоинфекций?
Как производится исследование пищевых продуктов на наличие условно патогенных микробов кишечной группы?
Как производится исследование пищевых продуктов на наличие стафилококка?
Как обнаруживается стафилококковый энтеротоксин?
Какие формы сальмонеллезов бывают у животных?
Каковы эпидемиологические особенности пищевых токсикоинфекций?
Каковы меры предупреждения пищевых токсикоинфекций?
Что такое спорадический сальмонеллез и каковы особенности его эпидемиологии?
ПРИЛОЖЕНИЕ К ЗАНЯТИЮ №13
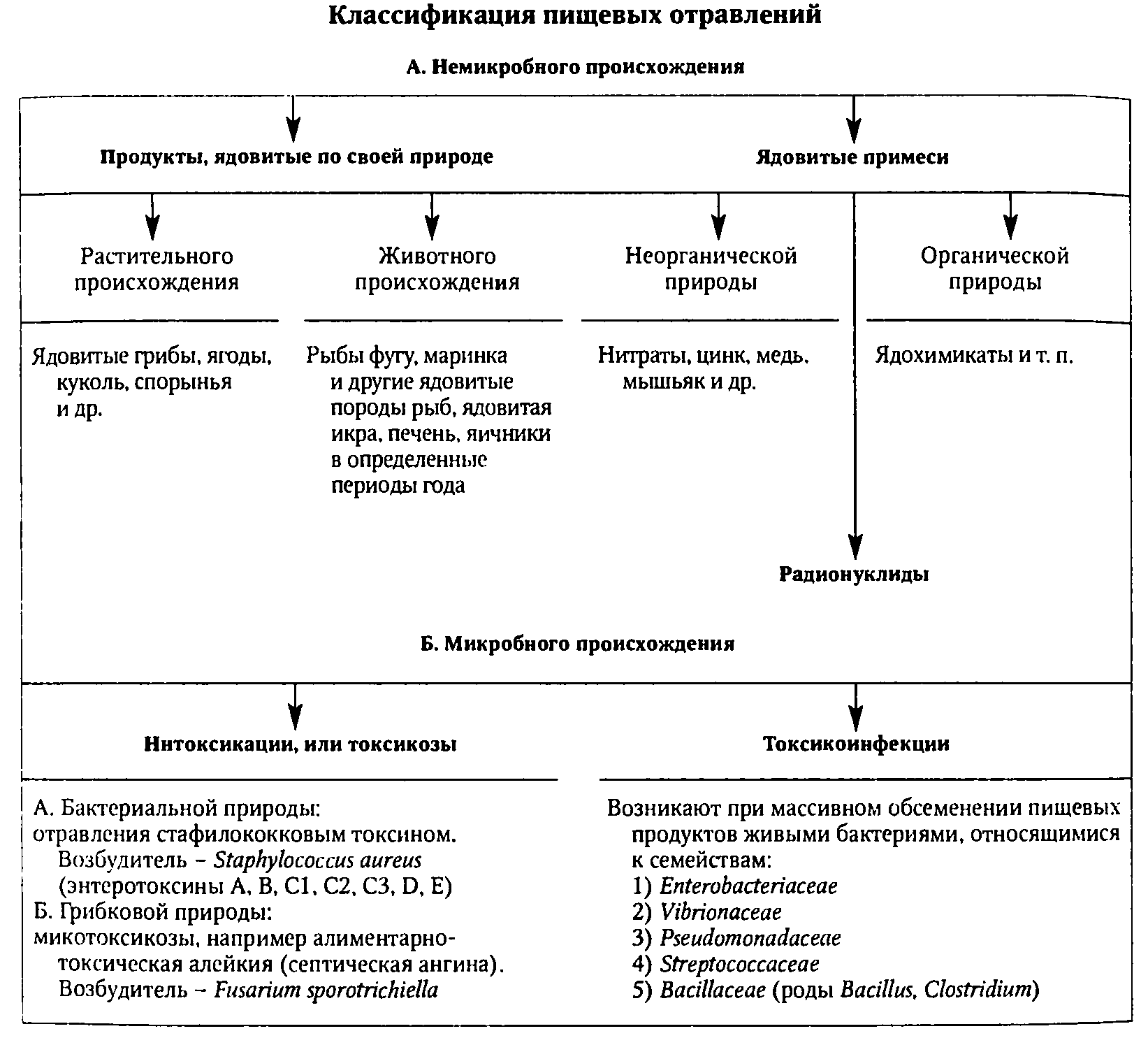
1. Классификация пищевых отравлений
2. Особенности пищевого отравления, вызванного В. cereus
Для В. cereus характерно наличие гемотоксина, лецитиназы, протеазы, гиалуронидазы. Вырабатываемый микробом энтеротоксин, белковой природы (термолабильный, чувствительный к трипсину), вызывает воспаление слизистой оболочки кишечника. Микроорганизм относят к условно-патогенным.
Различные продукты могут служить причиной пищевых отравлений, вызванных В. cereus при индексе обсеменённости их 104/г. В чернозёмной почве микроорганизм обнаруживают в 100% случаев, в фекалиях людей - в 0,5% случаев в концентрации 10/г, в водопроводной воде - в 15% проб.
Инкубационный период пищевого отравления, вызванного В. cereus, составляет 10-14 ч, начинается внезапно и быстро заканчивается. Отмечается тошнота, рвота, коликообразные боли в животе, жидкий водянистый стул с тенезмами; в тяжёлых случаях повышается температура, но летальность низкая. Из фекалий больных возбудителя выделяют редко, не более чем в 14% случаев.
З А Н Я Т И Е 14
Дата ______________
Тема: Алгоритм бактериологического расследования пищевых отравлений (решение ситуационных задач)
План занятия:
1. Порядок действий при расследовании пищевых отравлений.
2. Отбор проб для бактериологического исследования.
3. Алгоритм бактериологических исследований при пищевых отравлениях.
3.1. Порядок бактериологического исследования материалов от пострадавших.
3.2. Порядок бактериологического исследования пищевых продуктов.
Методические указания
1. Порядок действий при расследовании пищевых отравлений
Расследование пищевых отравлений- это совокупность мероприятий, направленных на выявление этиологии заболевания и факторов, способствующих его возникновению, с целью осуществления лечения и предупреждения пищевых отравлений. Обязательному расследованию и учету подлежит каждый случай пищевого отравления.
Расследование пищевых отравлений производится немедленно (в первые 24 часа) после получения экстренного извещения. Врасследовании отравления могут принимать участие врач-гигиенист отдела гигиены питания регионального центра гигиены, эпидемиологии и общественного здоровья или главный санитарный врач этого центра, а также по поручению главного врача другие специалисты центра.
Первоочередная цель при проведении расследования пищевого отравления – прервать вспышку и обосновать диагноз заболевания.
Участковый врач или средний медицинский работник, которые оказали медицинскую помощь пострадавшим, а также установили или заподозрили пищевое отравление, обязаны:
1) немедленно известить о пищевом отравлении по телефону, телеграфу или с нарочным местный ЦГ и Э. Направить в ЦГ и Э экстренное извещение по установленной форме; срок отправки в сельской местности – 24 часа; в городе – 12 часов;
2) изъять из употребления остатки подозреваемой пищи и немедленно запретить дальнейшую реализацию этих продуктов;
3) взять образцы подозреваемой пищи, собрать рвотные и каловые массы заболевших, промывные воды желудка и мочу, для бактериологического анализа, при наличии показаний - взять кровь из локтевой вены для посева на гемокультуру (в случае оказания помощи врачом) и направить на исследование в бактериологическую лабораторию ЦГЭ.
Дата добавления: 2018-04-05; просмотров: 1269; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
