Определение ферментации лактозы
З А Н Я Т И Е 1 Дата ______________ Тема: Прямые и косвенные методы санитарно-микробиологических
Исследований. Свойства СПМО I, II и III групп, методы выделения СПМО.
План занятия:
1. Разбор понятия «санитарно-показательные микроорганизмы (СПМО)», знакомство с основными требованиями для СПМО.
2. Разбор прямых и косвенных методов, применяемых для санитарной оценки объектов внешней среды.
3. Общее микробное число и методы его определения.
4. Знакомство с основными группами санитарно-показательных микроорганизмов, разбор свойств и методов их выделения. Микроскопия готовых препаратов.
4.1. Первая группа СПМО.
4.2. Вторая группа СПМО.
4.3. Третья группа СПМО.
Методические указания
1.Разбор понятия «санитарно-показательные микроорганизмы (СПМО)», знакомство с основными требованиями для СПМО
Санитарно-показательными называют микроорганизмы, являющиеся постоянными обитателями естественных полостей тела человека и животных, которые способны постоянно выделяться во внешнюю среду.
Санитарно-показательные микроорганизмы должны соответствовать следующим требованиям.
1. Постоянное обитание в естественных полостях человека и животных и постоянное выделение во внешнюю среду.
2. Отсутствие размножения во внешней среде.
3. Длительность выживания и устойчивость во внешней среде не меньше или даже выше, чем у патогенных микроорганизмов.
|
|
|
4. Отсутствие «двойников», с которыми СПМО можно перепутать.
5. Относительно низкая изменчивость во внешней среде.
6. Наличие простых в исполнении и надёжных методов индикации.
2.Разбор прямых и косвенных методов, применяемых для
санитарной оценки объектов внешней среды
Для определения санитарно-эпидемиологического состояния внешней среды в санитарной микробиологии применяется два метода – прямое обнаружение микроорганизмов и косвенная индикация возможного их присутствия.
Прямой методявляется более надёжным, но и вместе с тем трудоёмким и недостаточно чувствительным. Трудности выделения патогенных микроорганизмов из внешней среды обусловлены их незначительной концентрацией, неравномерностью распределения, конкуренцией между патогенными микроорганизмами и сапрофитной микрофлорой. Огромное значение имеет изменчивость возбудителя во внешней среде. Необходимо вести исследования в широком диапазоне, в том числе и по обнаружению условно-патогенных микроорганизмов, так как выделение одного вида возбудителя не свидетельствует об отсутствии других. Поэтому прямое выделение патогенных микроорганизмов проводят только по эпидемиологическим показаниям.
|
|
|
Косвенный методиндикацииво внешней среде более прост и доступен. Данный метод располагает двумя показателями-критериями, которые позволяют определить санитарно-эпидемиологическую ситуацию. К ним относят общее микробное число и концентрацию СПМО.
3. Общее микробное число и методы его определения
Общее микробное число(ОМЧ) – число всех микроорганизмов в 1 мл или в 1 г субстрата.
При этом учитывают, что чем больше микроорганизмов обнаружено во внешней среде, тем вероятнее загрязнение патогенными микроорганизмами. В связи с этим ОМЧ даёт представление об эпидемиологической обстановке.
Существуют три метода определения ОМЧ.
1. Оптический метод прямого подсчёта бактерий под микроскопом в камере Горяева.
2. Бактериологический метод (менее точный).
3. Измерение биомассы.
Оптический методобычно используют на водопроводных станциях при оценке эффективности работы очистных сооружений, но он не позволяет отличить живые бактерии от мёртвых. Исследование можно выполнить в течение 1 ч, поэтому метод незаменим в аварийных ситуациях. Метод позволяет судить о состоянии процессов самоочищения воды. В начальной стадии процесса самоочищения грамотрицательных бактерий больше, чем грамположительных, а палочковидных форм больше, чем кокковых. На завершающей стадии соотношение меняется на обратное.
|
|
|
Бактериологическим методомвыявляют определённую физиологическую группу бактерий, растущих при данных условиях. Например, обнаружение вегетативных форм микроорганизмов в прошедшем термическую обработку пищевом продукте свидетельствует о повторном заражении продукта после термической обработки или же о неэффективности последней. Обнаружение спор подтверждает удовлетворительное качество термической обработки.
Измерение биомассыосуществимо только в специализированных лабораториях путём взвешивания остатков бактериальной массы, определения показателей клеточного обмена и др. В практике этот метод не применяют.
ОМЧ определяют в следующих случаях:
· контроль качества очистки воды (в том числе колодезной);
· проверка эффективности мойки посуды;
· контроль чистоты воздуха в закрытых помещениях;
· определение свежести скоропортящихся продуктов;
· выбор места для строительства жилых объектов (исследование почвы);
· определение характера микрофлоры
4. Знакомство с основными группами санитарно-показательных микроорганизмов, разбор свойств и методов их выделения. Микроскопия готовых препаратов.
|
|
|
СПМО подразделяются на три группы.
4.1. Первая группа СПМО
Индикаторы фекального загрязнения – представители микрофлоры кишечника человека и животных:
· бактерии группы кишечных палочек (БГКП);
· энтерококки;
· протей;
· сульфитредуцирующие клостридии;
· термофилы, кишечные бактериофаги, сальмонеллы;
· бактероиды, бифидо- и лактобактерии;
· синегнойная палочка;
· грибы рода Candida;
· ацинетобактер.
Группа кишечных палочек представлена микроорганизмами родов Escherichia, Citrobacter, Enterobacter, Serratia, Klebsiella, экологические особенности которых определяют их индикаторную значимость.
Escherichia. Показатель свежего фекального загрязнения, возможная причина пищевых токсикоинфекций. Для идентификации используют биохимические тесты, учитывая способность к ферментации лактозы при температуре 44±0,5 °С и отсутствие роста на цитратсодержащих средах.
Представителей рода, находящихся в воде, трактуют как термотолерантные колиформные бактерии, в лечебных грязях – как фекальные колиформные бактерии, в пищевых продуктах - как Е. coli.
Необходимо отметить, что кишечная палочка не является идеальным СПМО.
Недостатки кишечной палочки в качестве СПМО:
1. Обилие аналогов во внешней среде.
2. Изменчивость во внешней среде.
3. Недостаточная устойчивость к неблагоприятным воздействия.
4. Недостаточно длительное выживание в продуктах по сравнению с шигеллами Зонне, сальмонеллами, энтеровирусами.
5. Способность к размножению в воде.
6. Нечёткий индикатор даже в отношении присутствия сальмонелл.
Citrobacter. Этиологическая роль бактерий рода Citrobacter доказана при эпидемических вспышках, клинически протекающих с явлениями диспепсии, гастроэнтероколита, пищевой токсикоинфекций.
Пищевые токсикоинфекций, обусловленные этими микроорганизмами, возникают при употреблении в пищу продуктов, в которых возбудители размножались в течение какого-то времени и накопились в достаточно большом количестве. Источниками инфекции обычно служат больные или бактерионосители. Заболевание чаще возникает после употребления заражённых пищевых продуктов (мясных, молочных).
Enterococcus.На роль СПМО были предложены в 1910 г. (Enterococcus faecalis и Enterococcus faecium).
Преимущества энтерококка как СПМО.
1. Постоянно находится в кишечнике человека и постоянно выделяется во внешнюю среду.
При этом Е. faecalis в основном обитает кишечнике человека, поэтому обнаружение его свидетельствует загрязнении фекалиями людей. В меньшей степени у человека встречается E. faecium. Последний в основном обнаруживается в кишечнике животных, хотя сравнительно редко также отмечается и Е. faecalis.
2. Не способен размножаться во внешней среде, в основном размножается E. faecium, но он имеет меньшее эпидемиологическое значение.
3. Не изменяет своих свойств во внешней среде.
4. Не имеет аналогов во внешней среде.
5. Устойчив к неблагоприятным воздействиям внешней среды.
Энтерококк в 4 раза устойчивее к хлору по сравнению с кишечной палочкой. Это главное его достоинство. Благодаря этому признак энтерококк используют при проверке качества хлорирования воды, а также как индикатор качества дезинфекции. Выдерживает температуру 60 °С, что позволяет применять его как показатель качеств пастеризации. Устойчив к концентрациям поваренной соли 6,5-17%. поэтому может быть использован в качестве индикатора при исследовании солёных продуктов, морской воды, в которых кишечная палочка гибнет или становится атипичной. Устойчив к рН в диапазоне 3-12, что делает его индикатором фекального загрязнения при исследовании кислых продуктов.
6. Для индикации энтерококков разработаны высокоселективные среды.
При обнаружении в воде атипичных кишечных палочек присутствие энтерококков становится главным показателем свежего фекального загрязнения.
В открытых водоёмах определяют соотношение ФКП/ФЭ, где ФКП - фекальная кишечная палочка, а ФЭ - фекальные энтерококки. При значении ФКП/ФЭ ≥ 10 подозревают сброс в водоём нехлорированных сточных вод. Если показатель находится в пределах 0,1-1, хлорирование сточных вод достаточное, так как ФЭ в 4 раза устойчивее к хлору, чем кишечная палочка.
Бактерии рода Proteus встречаются в 98% случаев в выделениях кишечника человека и животных, из них в 82% случаев – P. mirabilis. Обнаружение протея в воде и продуктах указывает на загрязнение объектов разлагающимися субстратами и свидетельствует о крайнем санитарном неблагополучии. При обнаружении протея в пищевых продуктах их бракуют, а воду не разрешают употреблять для питья.
Clostridium perfringensв качестве СПМО также имеет достоинства и недостатки:
· непостоянно обнаруживается в кишечнике человека;
· длительно сохраняется во внешней среде за счёт спорообразования, поэтому не свидетельствует о свежем фекальном загрязнении;
· на эти бактерии губительно действует сопутствующая микрофлора;
· споры устойчивы к концентрациям активного хлора 1,2-1,7 мг/л воды;
· С. perfringens может служить косвенным показателем наличия в воде энтеровирусов.
Определение С. perfringens проводят в воде открытых водоёмов, почве, лечебных грязях, мясных продуктах.
Термофилы. Это целая группа СПМО, в основном споровых, растущих при температуре 55-60 °С. Обитают во внешней среде и служат показателем загрязнения навозом и компостом. При гниении навоза или компоста температура поднимается более 60 °С, и термофилы бурно размножаются. О степени загрязнения судят по количеству термофилов. В России их определяют при исследовании почвы, а также в консервах как индикатор термической обработки, особенно при хранении в условиях жаркого климата.
Бактериофаги. В качестве СПМО используют бактериофаги кишечной палочки – коли-фаги, фаги сальмонелл и шигелл. Их обнаруживают там, где есть соответствующие бактерии, к которым эти фаги адаптированы. Фаги выживают во внешней среде более 9 мес. Они ценны как показатель фекального загрязнения, особенно энтеровирусами, так как фаги выделяются из сточных вод с той же частотой, что и энтеровирусы. По устойчивости к хлору фаги сравнимы с энтеровирусами.
Необходимо помнить:
1. О массивности свежего фекального загрязнения судят по количеству БГКП и энтерококков.
2. О давности фекального загрязнения судят по соотношению БГКП, энтерококков и клостридий.
3. О характере загрязнения судят по соотношению фекальных бактерий и термофилов.
Salmonella.В 30-х г. XX века У. Вильсон и Э. Блер предложили сальмонелл в качестве СПМО.
Преимущества сальмонелл как СПМО.
1. Сальмонеллы – наиболее распространенные микроорганизмы, вызывающие острые кишечные заболевания (ОКЗ), могут служить индикатором других ОКЗ с аналогичными патогенезом и эпидемиологией. Количество носителей сальмонелл среди людей и животных значительное. Их довольно часто обнаруживают даже в сточных водах.
2. Поступают во внешнюю среду только с фекалиями человека и животных.
3. Размножаются в почве при наличии в ней большого количества органических веществ, однако могут размножаться даже в чистой воде.
При определении сальмонелл в воде следует вычислять не только процент положительных обнаружений, но и НВЧ. По этому показателю можно оценить эпидемиологическую ситуацию.
Бактероиды. Вопрос о бактероидах окончательно ещё не решён. Бактероиды обнаруживают в 1 г фекалий в концентрациях 107-1011. Это грамотрицательные палочки, строгие анаэробы, подвижные и неподвижные, образуют мелкие колонии, требовательны к питательным средам. Они – постоянные обитатели кишечника человека, их количество значительно превышает все другие СПМО.
Преимущества бактероидов как СПМО.
1. Бактероидов много, они в больших количествах выделяются во внешнюю среду.
2. Не имеют двойников.
3. Не размножаются во внешней среде.
4. Отмирают во внешней среде быстрее, чем кишечные палочки, поэтому служат показателями свежего фекального загрязнения.
Однако имеются определённые трудности с их выращиванием, так как необходимы специальные питательные среды и особые условия культивирования.
Синегнойная палочка (Pseudomonas aeruginosa). Недостатки синегнойной палочки как СПМО.
1. Обнаруживается в фекалиях здоровых людей в 11%, а у животных в 7% (т.е. непостоянно).
2. Способна размножаться во внешней среде.
3. Методы индикации просты, но только в отношении пигментных форм, а во внешней среде преобладают беспигментные формы, которые распознать трудно.
4. Обнаруживается в 90% случаев в сточных водах, больничных палатах. Наличие синегнойной палочки свидетельствует о неблагополучном санитарном состоянии лечебного учреждения.
Роль её выросла в связи с распространением антибиотикорезистентных штаммов и появлением большого количества носителей.
Грибы рода Candida. В последнее время предпринимаются попытки использовать эти грибковые микроорганизмы как санитарно-показательные, так как они постоянно присутствуют в организме человека: в фекалиях в 10-90% случаев, в слизи верхних дыхательных путей – в 15-50%, на коже – в 1-100%. Они обнаруживаются везде, где есть сахаросодержащие вещества. Первоисточником в природе служат человек и животные. Грибы кандида очень устойчивы к неблагоприятным воздействиям внешней среды, даже более, чем патогенные бактерии. Их можно использовать в качестве индикаторов эффективности дезинфекции.
| Escherichia coli | Enterococcus faecalis | Proteus mirabilis |
| Clostridium perfringens | Candida albicans | Бактероиды |
4.2. Вторая группа СПМО.
Индикаторы воздушно-капельного загрязнения - комменсалы верхних дыхательных путей:
· стрептококки;
· стафилококки.
Представителей этой группы СПМО определяют в воздухе, молочных продуктах, воде. К ним относится зеленящий стрептококк (S. salivarius). У него есть двойники, так как S. lactis, S. bovis, S. equinus, S. cremoris. Но эти двойники редко обнаруживаются в жилых помещениях. Зеленящими могут быть и энтерококки, но они сами являются СПМО.
Другой санитарно-показательный стрептококк – β-гемолитический стрептококк. Его обнаруживают в 80% у людей, страдающих в основное воспалительными заболеваниями верхних дыхательных путей. Он обладает гемолитическими свойствами.
Показателем санитарного неблагополучия считается и золотистый стафилококк. Именно этот вид стафилококка связан с присутствием людей и некоторых животных. В среднем у здоровых людей золотистый стафилококк обнаруживают в 30% случаев, а у медицинского персонала до 96%. Этот вид стафилококка отличается длительностью выживания и устойчивостью во внешней среде. Он может быть косвенным индикатором загрязнения воздуха вирусами. Использование золотистого стафилококка, как наиболее информативного СПМО, рекомендовано при исследовании воздуха жилых помещений, жилых отсеков космических кораблей, подводных лодок, лечебно-профилактических учреждений.
На роль СПМО выдвигаются также антибиотикорезистентные стафилококки и микрококки, 5-6-кратное превышение указанных СПМО в воздухе больничных помещений по сравнению с воздухом внебольничных помещений следует оценивать как плохой прогностический признак.
| Staphylococcus aureus | Streptococcus salivarius |
4.3. Третья группа СПМО
Индикаторы процессов самоочищения – обитатели внешней среды:
· протеолиты;
· аммонификаторы и нитрификаторы;
· аэромоносы и бделловибрионы;
· споровые микроорганизмы;
· грибы и актиномицеты;
· целлюлозобактерии.
Бделловибрионы предложены в качестве СПМО в 1962 г. Это аэробные грамотрицательные палочки, размером 0,25-1,2 мкм, подвижные, имеют жгутики, по отношению к другим бактериям – хищники, поражающие только грамотрицательные палочки. На одном из полюсов бделловибрионов есть полость, где скапливаются экзотоксин и липолитический фермент, который растворяет клеточную стенку бактерий. Отличают их друг от друга по литической активности: одни лизируют только псевдомонады, а другие только аэромонады. Бделловибрионы применяют для биологической очистки воды (искусственно выпускают в воду плавательных бассейнов), используют и как СПМО по загрязнению воды. В местах сброса сточных вод количество бделловибрионов достигает 3000 КОЕ/см3, в отдалении от сброса - 10 КОЕ/см3. Выделяют бделловибрионы по методу Грация, но для постановки пробы необходим индикаторный штамм Е. coli К-12. Количество их выражают в бляшкообразующих единицах (БОЕ/см3).
Аэромонады. В 1969 г. предложено использовать в качестве СПМО аэромонады. Они в больших количествах содержатся в сточных водах и обладают большой энергией размножения. Служат показателем нагрузки сточных вод на водоём и имеют такое же значение, как ОМЧ. При большой концентрации аэромонад в воде может наступить пищевое отравление.
| Бделловибрионы | Аэромонады |
Контрольные вопросы
Что служит объектами изучения санитарной микробиологии?
Какие микроорганизмы называют санитарно-показательными?
Назовите основные требования, которым должны отвечать СПМО?
В чем сущность прямого метода санитарной оценки объектов внешней среды?
Какие существуют показатели-критерии косвенного метода индикации микроорганизмов внешней среды?
Что такое ОМЧ?
Какие методы определения ОМЧ вы знаете?
Какие микроорганизмы относятся к первой группе СПМО?
Какие бактерии называют колиформными?
Какими ферментативными свойствами обладают ОКБ?
Почему кишечная палочка не является идеальным СПМО?
Какие преимущества энтерококков в качестве СПМО вы знаете?
Какие колонии образуют на среде Эндо типичные лактозоположительные бактерии?
Какие микроорганизмы относятся ко второй группе СПМО?
Какие заболевания вызывают стафилококки?
Какие микробиологические методы используют для диагностики заболеваний, вызываемых гноеродными кокками?
Как производят бактериологическое исследование при различных стрептококковых заболеваниях?
Какие микроорганизмы являются индикаторами самоочищения внешней среды?
Что такое титр СПМО?
Что такое индекс СПМО?
Что такое наиболее вероятное число?
ПРИЛОЖЕНИЕ К ЗАНЯТИЮ №1.
Объектами санитарно-микробиологического исследования служат вода, воздух, почва, объекты окружающей среды, а также пищевые продукты, оборудование пищеблоков, больничная среда, фармацевтические объекты.
Биологические загрязнения:
• загрязнения патогенными и условно-патогенными микроорганизмами, цианобактериями, микроорганизмами, предназначенными для борьбы с насекомыми, микроорганизмами-продуцентами токсических веществ;
• загрязнения различными веществами - антибиотиками, белками, ферментами, витаминами.
По размеру наносимого ущерба к наиболее значимым биологическим загрязнителям относят:
· хозяйственно-бытовые и сточные воды;
· отходы животноводческих комплексов;
· отходы промышленных предприятий по производству антибиотиков, вакцин, сывороток, белков, витаминов, ферментов и т.п.;
· сине-зеленые водоросли, массово развивающиеся в открытых водоёмах.
Для каждого вида загрязнения должны быть определены предельные допустимые концентрации (ПДК), которые:
· не влияют отрицательно на процессы самоочищения внешней среды;
· не подавляют развитие санитарно-показательных микроорганизмов (СПМО) и не усиливают их патогенных свойств;
· не удлиняют сроков выживания микроорганизмов
· не способствуют ухудшению здоровья людей.
Чем выше концентрация СПМО, тем больше вероятность присутствия патогенных микроорганизмов. Их количество выражают в титрах и индексах.
Тump – минимальное количество субстрата (в кубических сантиметрах или граммах), в котором ещё обнаруживают СПМО.
Индекс – количество СПМО, которое содержится в 1 л воды или в 1см3 другого субстрата.
Наиболее вероятное число (НВЧ)– количество СПМО в 1 л воды или в 1 г (см3) другого субстрата. Это более точный показатель, так как он имеет доверительные границы, в пределах которых может колебаться
с вероятностью 95%.
З А Н Я Т И Е 2
Дата ______________
Тема: Санитарно-микробиологическое исследование воды централизованного хозяйственно-питьевого водоснабжения.
План занятия
1. Знакомство с правилами отбора, хранения и транспортировки проб воды.
2. Санитарно-бактериологическое исследование воды питьевой:
а) определение ОМЧ (разбор схемы).
б) титрационный метод (разбор схемы);
в) метод мембранной фильтрации (разбор схемы).
3. Определение спор сульфитредуцирующих клостридий методом прямого посева.
4. Определение коли-фагов.
Методические указания
1. Знакомство с правилами отбора, хранения и
транспортировки проб воды
Демонстрация посуды и емкостей, разбор правил отбора, хранения и транспортирования проб воды для микробиологического исследования.
2. Определение общего числа микроорганизмов (ОМЧ)
Разбор нормируемых микробиологических показателей качества воды: общее микробное число (ОМЧ), общие колиформные бактерии (ОКБ), термотолерантные колиформные бактерии (ТКБ), коли-фаги.
а) Определение ОМЧ (разбор схемы)
Для определения ОМЧ воды чаще всего используют метод 10-кратных разведений, когда концентрация микроорганизмов каждого последующего разведения в 10 раз меньше предыдущего, затем разведения высевают на питательные среды. В пустые стерильные чашки Петри, соблюдая правила асептики, стерильной пипеткой вносят 1 см3 из заранее приготовленного разведения. Чашки предварительно маркируют (со стороны донышка, а не крышки!), чтобы исключить случайную замену их при падении, сдвиге и др.
Разведения выбирают с таким расчётом, чтобы на чашке выросло от 30 до 300 колоний. Из каждой пробы засевают два разведения. Не позднее чем через 15 мин после внесения материала (разведения) в чашку наливают расплавленного и остуженного до 45+5 °С 10-12 см3 питательного агара (питательную среду), толщина слоя которого должна быть 4-5 мм. Расплавленную среду и посевной материал незамедлительно тщательно перемешивают круговыми движениями, чтобы микроорганизмы равномерно распределились в массе среды. Чашки Петри оставляют на холодной горизонтальной поверхности на 10-15 мин для охлаждения и застывания среды, после чего посевы помещают в термостат и инкубируют при заданной температуре и экспозиции.
Для дальнейшей работы выбирают чашки, на которых выросло от 30 до 300 колоний, а при посеве нативного материала - от 1 до 300 колоний. Количество колоний на поверхности и в глубине агара подсчитывают визуально или при помощи лупы с 2-5-кратным увеличением.
б) Определение ОКБ и ТКБ титрационным методом
Метод основан на накоплении бактерий после посева определенных объемов воды в жидкие питательные среды, с последующим пересевом на дифференциальную плотную среду с лактозой и идентификации колоний по культуральным и биохимическим тестам. При исследовании питьевой воды качественным методом (текущий санэпиднадзор) засевают три объема по 100 см3. При исследовании воды с целью количественного определения ОКБ и ТКБ (повторный анализ) засевают соответственно 100, 10 и 1 см3 - по три объема каждой серии.
Посевы 10 и 100 см3 воды проводят соответственно в 1 и 10 см3 среды накопления - концентрированной ЛПС без индикатора. Посев 1 см3 пробы проводят в 10 см3 ЛПС обычной концентрации. Посевы инкубируют при температуре 37 °С в течение 48 ч. Через 24 ч проводят предварительную оценку посевов в среде накопления. Из ёмкостей, где отмечено наличие роста (помутнение) и образование газа, материал высевают бактериологической петлёй на сектора среды Эндо для получения изолированных колоний. Ёмкости без видимых признаков роста и образования газа оставляют в термостате до 48 ч и ещё раз просматривают для окончательной оценки.
Результаты посевов без признаков роста считают отрицательными, и дальнейшему изучению они не подлежат. Из ёмкостей, где отмечены помутнение и образование газа (или только помутнение), делают высев на сектора среды Эндо. Посевы на среде Эндо инкубируют при температуре 37 °С 18-20 ч. При появлении помутнения, образовании газа в среде накопления и росте на среде Эндо колоний, типичных для лактозоположительных бактерий (тёмно-красных или красных, с металлическим блеском или без него, выпуклых с красным центром и отпечатком на питательной среде), дают положительное заключение о присутствии ОКБ в данном объёме пробы.
Наличие ОКБ необходимо подтвердить в следующих случаях:
· в среде накопления отмечено только помутнение;
· принадлежность к лактозоположительным колониям вызывает сомнение.
Для подтверждения присутствия ОКБ выполняют следующие действия:
· проверяют наличие отпечатка на среде Эндо после снятия петлёй подозрительной колонии;
· выполняют оксидазный тест;
· проверяют принадлежность к группе по Граму;
· подтверждают способность к газообразованию при посеве 1-2 изолированных колоний всех типов с каждого сектора в среду подтверждения (ЛПС с индикатором) с последующей инкубацией посевов при температуре 37 °С в течение 24-48 ч.
При отсутствии изолированных колоний проводят рассев на среду Эндо общепринятыми бактериологическими методами. Отрицательное заключение дают, если:
· в среде накопления нет признаков роста;
· на секторах среды Эндо нет роста;
· на секторах среды Эндо выросли нехарактерные для колиформных бактерий колонии (прозрачные, с неровными краями, расплывчатые);
· все колонии оказались оксидазоположительными;
· все колонии оказались грамположительными;
· в подтверждающем тесте на среде ЛПС с индикатором не отмечено газообразования.
Для определения ТКБ работают с секторами среды Эндо, где выросли типичные лактозоположительные колонии. Делают посев двух-трёх изолированных колоний каждого типа из каждого сектора в пробирки с любой из лактозных сред накопления, инкубируют при температуре +44 °С течение 24 ч. При образовании газа в лактозной среде накопления, росте на среде Эндо лактозоположительных бактерий и выявлении способности к ферментации лактозы до кислоты и газа в подтверждающих лактозных средах при температуре 44 °С в течение 24 ч дают положительное заключение о наличии в этом объёме воды ТКБ. Во всех остальных случаях дают отрицательное заключение.
в) Определение ОКБ и ТКБ методом мембранных фильтров
Метод основан на фильтровании определенных объемов воды через мембранные фильтры. Для этих целей используют фильтры с диаметром пор 0,45 мкм и размером 35 или 47 мм в диаметре (отечественные фильтры «Владипор» МФАС–С–1, МФАС–С–2, МФАС–МА (№ 4-6) или зарубежные – ISO 9000 или EN 29000). При исследовании воды неизвестного качества для получения изолированных колоний фильтруют следующие объёмы воды: 10, 40, 100 и 150 см3 соответственно на 4 фильтра. Далее фильтры помещают на чашки со средой Эндо и инкубируют при 37°С или 44°С в течение 24 ч. Если на фильтрах нет роста колоний или отмечен рост плёнчатых, губчатых, плесневых, прозрачных или расплывчатых колоний, то выдаётся отрицательный ответ.
При наличии подозрительных колоний (S- или R- тип, лактозоположительные) ставят тест на оксидазу, окрашивают по Граму, проводят посев на жидкую лактозо-пептонную среду (ЛПС).
Постановка оксидазного теста
Полоску фильтровальной бумаги помещают в чистую чашку Петри и наносят 2-3 капли реактива для оксидазного теста (1% спиртовой раствор α-нафтола и 1% водный раствор фенилендиаминового соединения, перед постановкой теста к 3 частям α-нафтола добавляют 7 частей фенилендиаминового соединения). Возможно использование тест-систем СИБ-оксидаза. Реактивы и тест-системы периодически проверяют на тест-культурах: P. aeruginosa - оксидазоположительной и E.coli - оксидазоотрицательной. Часть изолированной колонии изучаемой культуры стеклянной палочкой наносят на пропитанную реактивом фильтровальную бумагу. Если в течение 1 мин появляется фиолетово-коричневое окрашивание, культура считается оксидазоположительной и дальнейшему изучению не подлежит. Если реакция на оксидазу отрицательная (цвет на месте нанесения культуры не меняется), культура подлежит дальнейшему исследованию. Из оксидазоотрицательной колонии делают мазок, окрашивают по Граму и микроскопируют. Грамотрицательные бактерии окрашиваются в красный или розовый цвет.
Определение ферментации лактозы
Оставшуюся часть оксидазоотрицательной грамотрицательной колонии засевают в две пробирки с полужидкой лактозной средой и жидкой лактозо-пептонной средой (ЛПС).
В состав жидкой лактозо-пептонной среды(ЛПС) входят 10 г пептона, 5 г натрия хлорида и 5 г лактозы, которые растворяют при нагревании
в 1 л дистиллированной воды. После растворения всех ингредиентов
доводят рН до 7,4-7,6, разливают по 10 см3 в пробирки с поплавками,
стерилизуют 12 мин при температуре 112 °С.
Для приготовления среды накопления(концентрированной ЛПС), используя титрационный метод, увеличивают количество всех ингредиентов (кроме воды) в 10 раз и разливают по 10 см3 во флаконы с поплавками.
Перед стерилизацией в ЛПС, используемую для подтверждения способности бактерий к ферментации лактозы до кислоты и газа, добавляют 1,6% спиртовой раствор бриллиантового синего из расчёта 1 см3 красителя на 1 л ЛПС (при образовании кислоты зелёный цвет ЛПС изменяется на жёлтый). Для работы мембранным методом готовую ЛПС разливают по 3-5 см3 в пробирки с поплавками.
Для обнаружения ОКБ посевы в ЛПС с индикатором инкубируют при температуре 37 °С в течение 48 ч. Для обнаружения ТКБ посевы инкубируют при температуре 44 °С в течение 24 ч. При обнаружении кислоты и газа результат исследования считают положительным. При отсутствии кислоты и газа или при наличии только кислоты через 24 ч пробирки оставляют в термостате до 48 ч.
При положительных результатах КОЕ ОКБ и ТКБ подсчитывают на всех фильтрах и выражают результат анализа КОЕ в 100 см3 воды. Вычисления проводят по формуле:
Х= а×100/v,
где Х – число колоний в 100 см3;
а – число подсчитанных на фильтрах колоний в сумме;
v – объем воды, профильтрованный через фильтры.
Окончательный результат выдают в следующем формате: количество КОЕ ОКБ в 100 см3, из них – количество КОЕ ТКБ в 100 см3.
3. Определение спор сульфитредуцирующих клостридий
методом прямого посева
Метод основан на выращивании посевов в железо-сульфитном агаре в условиях, приближённых к анаэробным, и подсчёте числа чёрных колоний. На первом этапе исследования пробу воды объёмом 20 см3 прогревают на водяной бане в пробирках при температуре 75 °С в течение 15 мин для уничтожения вегетативных форм микроорганизмов. Затем в 4 стерильные пробирки объёмом не менее 15 см3 вносят по 5 см3 подготовленной пробы воды и заливают горячим, расплавленным на водяной бане (не кипятить!) железо-сульфитным агаром по 10 см3 в каждую пробирку. Среду заливают по стенке пробирки, избегая образования пузырьков воздуха. После этого пробирку быстро охлаждают в ёмкости с холодной водой для создания анаэробных условий. Посевы инкубируют при температуре 44 °С в течение 16-18 ч.
Количественному учёту подлежат те посевы, где получены изолированные чёрные колонии в толще питательной среды. Результат выражают числом КОЕ спор сульфитредуцирующих клостридий в 20 см3 воды. В случае сильного роста результат оценивают качественно и в протоколе отмечают: «Обнаружено в 20 см3 воды». При отсутствии роста чёрных колоний дают ответ: «Не обнаружено в 20 см3 воды».
| опыт | контроль |
Заключение _________________________________________________
4. Определение коли-фагов
Метод определения коли-фагов в питьевой воде заключается в предварительном накоплении их в среде обогащения на культуре Е. coli и последующем выявлением зон лизиса (просветления) газона Е. coli на питательном агаре. Метод предназначен дли проведения текущего контроля качества питьевой воды.
На всех этапах исследования используют бактериальную взвесь, при-готовленную следующим образом: эталонную тест-культуру Е. coli К-12 F+ Smr засевают в пробирку со скошенным питательным агаром. Через 18 ч инкубации при температуре 37 °С проводят смыв бактерий с косого агара 5см3 0,9% раствором натрия хлорида и по стандарту мутности готовят взвесь Е. coli в концентрации 109 бактериальных клеток в 1см3. Можно использовать 4-часовую бульонную культуру Е. coli, 2 см3 такой культуры содержат 109 бактериальных клеток.
В начале исследования 100 см3 исследуемой пробы воды разливают на 6 объёмов: один флакон 50 см3 и 5 пробирок по 10 см3. В 50 см3 пробы воды добавляют 5 см3 питательного бульона 10-кратной концентрации (готовят путём увеличения в 10 раз навески сухого препарата, указанной на этикетке) и 0,5 см3 смыва (или 1 см3 4-часовой бульонной культуры) бактерий Е. coli.
Дли контроля культуры 0,1 см3 смыва бактерий (или 0,2 см3 4-часовой бульонной культуры) Е. coli помешают в чашку Петри и заливают ни питательным агаром. Посевы переносят в термостат и выдерживают при температуре 37 °С в течение 18 ч.
После инкубации из объёма 50 см3 отмеряют 10 см3 в пробирку. Во все пробирки (6 объёмов пробы воды по 10 см3) добавляют по 1 см3 хлороформа. Пробирки закрывают стерильными резиновыми пробками, встряхивают для равномерного распределения хлороформа по объёму воды и оставляют на 15 мин при комнатной температуре (Е. coli погибают, остаются только коли-фаги).
В 100 см3 расплавленного и остуженного до температуры 45 °С питательного агара добавляют 1 см3 смыва суточной агаровой культуры Е. coli (в концентрации 109/см2 смыва) или 2 см3 4-часовой бульонной культуры Е. coli. Приготовленную смесь разливают в чашки Петри: одну чашку для контроля культуры Е. coli на лизогенность и по одной чашке на каждую исследуемую пробу воды. После застывания агара чашки, предназначенные для посева пробы, делят на 6 секторов, маркируют каждый сектор в соответствии с исследуемыми объёмами и на каждый сектор наносят пастеровской пипеткой по 1 капле надосадочной жидкости (без хлороформа) из 6 пробирок с пробой. После подсыхания капель чашки с исследуемыми пробами и контрольную чашку помещают в термостат при температуре 37 °С на 18 ч.
Просмотр результатов осуществляют в проходящем свете. Учитывают зоны лизиса в виде отдельного пятна или отдельной бляшки. Пробу считают положительной при наличии зоны лизиса хотя бы на одном секторе при отсутствии зон лизиса на контрольной чашке. Оценку проводят по таблице НВЧ БОЕ.
В протоколе анализа указывают НВЧ коли-фагов в 100 см3 воды и диапазон возможных колебаний: НВЧ БОЕ коли-фагов в 100 см3. Результат полуколичественный. При наличии зон лизиса в контрольной чашке результат считают недействительным.
Контрольные вопросы
По каким показателям определяется безопасность питьевой воды в эпидемическом отношении?
Какие санитарно-показательные микроорганизмы используют для оценки качества питьевой воды?
Какие микробиологические показатели определяют при оценке качества питьевой воды централизованного водоснабжения?
Как определяют ОМЧ воды?
Что такое ОКБ?
Что такое ТКБ?
Каким способом подтверждают наличие ОКБ в пробе воды?
Как определяют ТКБ воды?
В чем сущность метода мембранных фильтров при определении ОКБ и ТКБ воды?
Какие фильтры используют при исследовании воды?
Как осуществляется постановка оксидазного теста?
Как определяется ферментация лактозы?
Какой состав жидкой ЛПС?
Как проводят определение спор сульфитредуцирующих клостридий при оценке качества питьевой воды централизованного водоснабжения?
В чем заключается метод определения коли-фагов?
Какой состав железо-сульфитного агара?
Какие основные правила отбора проб воды?
В течение какого промежутка времени проба питьевой воды должна быть доставлена на анализ?
Для каких возбудителей инфекционных заболеваний вода может служить фактором передачи?
Назовите с эпидемиологической точки зрения наиболее опасные для человека вирусы, загрязняющие водоемы?
Назовите единицы измерения, в которых выражают количество коли-фагов в воде?
Какие методы обнаружения микроорганизмов в воде вы знаете?
Что такое гомогенизация и десорбция?
ПРИЛОЖЕНИЕ К ЗАНЯТИЮ №2
1. Правила отбора проб воды:
1. Для отбора проб воды используют специально предназначенную для этих целей одноразовую посуду или емкости многократного применения, изготовленные из материалов, не влияющих на жизнедеятельность микроорганизмов. Емкости должны быть оснащены плотно закрывающимися пробками (силиконовыми, резиновыми или из других материалов) и защитным колпачком (из алюминиевой фольги, плотной бумаги). Многоразовая посуда, в т.ч. пробки, должна выдерживать стерилизацию сухим жаром или автоклавированием.
2. Для нейтрализации присутствующих в воде хлорсодержащих дезинфектантов в ёмкость (до стерилизации) вносят серноватисто-кислый натрий из расчёта 10 мг на каждые 0,5 объёма исследуемой воды. Если вода гиперхлорированная, то количество нейтрализатора увеличивают: при концентрации остаточного хлора 2 мг/л добавляют 20 мг нейтрализатора, 3 мг/л - 30 мг и так далее.
3. Стерильную емкость открывают непосредственно перед отбором, удаляя пробку вместе со стерильным колпачком. Во время отбора пробка и края емкости не должны чего-либо касаться.
4. При исследовании воды из распределительных сетей отбор проб из крана производят после предварительной его стерилизации обжиганием и последующего спуска воды не менее 10 мин при полностью открытом кране. При отборе пробы напор воды может быть уменьшен. Пробу отбирают непосредственно из крана без резиновых шлангов, водораспределительных сеток и других насадок.
5. При заполнении емкостей должно оставаться пространство между пробкой и поверхностью воды, чтобы пробка не смачивалась при транспортировании. После наполнения емкость закрывают стерильной пробкой и колпачком.
6. Отобранную пробу маркируют и сопровождают документом отбора проб воды с указанием места, даты, времени забора, фамилии специалиста, отбиравшего пробу, и другой информации.
2. Хранение и транспортирование проб воды
1. Доставку проб питьевой воды осуществляют в контейнерах-холодильниках при температуре (4-10) °С.
2. В холодный период года контейнеры должны быть снабжены термоизолирующими прокладками, обеспечивающими предохранение проб от промерзания. При соблюдении указанных условий срок начала исследований от момента отбора проб не должен превышать 6 ч.
3. Если пробы нельзя охладить, их анализ следует провести в течение 2 ч после забора.
4. Если не может быть соблюдено время доставки пробы и температура хранения, анализ пробы проводить не следует.
3. Методы обнаружения микроорганизмов в воде.
Для обнаружения микроорганизмом в воде и других биосубстратах и определения их количества могут быть использованы бактериологическийи микроскопическийметоды.
Основные этапы бактериологического исследования: гомогенизация образца, десорбция микроорганизмов с плотных частиц, приготовление разведений, посев на питательные среды, идентификация выделенных культур.
Гомогенизациюобразца проводят для равномерного распределения бактерий в анализируемом объекте. При исследовании жидких, плотных, сыпучих продуктов, в зависимости от характеристик испытуемого материала, используют перемешивание простым встряхиванием или специальные приборы.
Десорбциябактерий с плотных частиц необходима для анализа объектов твёрдой консистенции. Для этого материал суспензируют в жидкости или с поверхности объекта берут смывы и отпечатки. При суспензировании к навеске образца массой 10 г добавляют 90 см3 воды и интенсивно перемешивают (вручную или в гомогенизаторе). В дальнейшем условно принимают 1 см3 полученной суспензии эквивалентным 0,1 г исходного материала.
4. Термины и определения
Общие колиформные бактерии – грамотрицательные, оксидазонегативные, не образующие спор палочки, способные расти на дифференциальных лактозных средах, ферментирующие лактозу до кислоты, альдегида и газа при температуре +37 °С в течение 24-48 ч.
Термотолерантные колиформные бактерии – входят в состав ОКБ и обладают всеми их признаками, но ферментируют лактозу до кислоты, альдегида и газа при температуре +44 °С в течение 24 ч.
Сульфитредуцирующие клостридии- спорообразующие анаэробные палочковидные микроорганизмы, восстанавливающие сульфит натрия в условиях культивирования на железо-сульфитном агаре при температуре 44 °С в течение 16-18 ч.
Коли-фаги– бактериальные вирусы, способные лизировать Е. coli и формировать при температуре 37 °С через 18 ч зоны лизиса бактериального газона (бляшки) на питательном агаре.
5. Пропись железо-сульфитного агара
К 1 л стерильного расплавленного питательного агара добавляют 10 г глюкозы, нагревают до растворения, разливают количественно во флаконы, автоклавируют при температуре 112 °С в течение 12 мин (основная среда).
20% раствор натрия сульфита (Na2S03) и 8% раствор железа (II) сульфата (FeS04) или железа (II) хлорида (FeCl2) готовят непосредственно перед использованием в стерильной посуде на стерильной дистиллированной воде. Раствор натрия сульфита нагревают до полного растворения реагента. Перед выполнением анализа в 100 см3 расплавленной основной среды вносят 5 см3 20% раствора натрия сульфита, перемешивают, затем вносят 1 см3 8% раствора железа сульфата, перемешивают и в стерильных условиях разливают в пробирки высоким столбиком по 10-12 см3.
Таблица1. Санитарно-показательные микроорганизмы в воде централизованного хозяйственно-питьевого водоснабжения
| № | Показатель | Единица измерения | Норматив |
| 1 | Термотолерантные коли-формные бактерии (ТКБ) | Число бактерий в 100 см3 | Отсутствует |
| 2 | Общие колиформные бактерии (ОКБ) | Число бактерий в 100 см3 | Отсутствует |
| 3 | ОМЧ | Колониеобразующие единицы (КОЕ) в 1 см3 | ≤50 |
| 4 | Коли-фаги | Бляшкообразующие единицы (БОЕ) в 100 см3 | Отсутствует |
| 5 | Споры сульфитредуциру-ющих клостридий | Число спор в 20 см3 | Отсутствует |
З А Н Я Т И Е 3
Дата ______________
Тема: Санитарно-микробиологическое исследование воды децентрализованного хозяйственно-питьевого водоснабжения.
План занятия
1. Разбор микробиологических показателей, применяемых к питьевой воде источников децентрализованного водоснабжения.
2. Определение бактерий группы кишечных палочек по ГОСТу 18963-73.
2.1. Метод мембранных фильтров.
2.2. Титрационный метод.
3. Определение бактерий группы кишечных палочек по ГОСТу 24849-81.
Методические указания
1. Разбор микробиологических показателей, применяемых к питьевой воде источников децентрализованного водоснабжения
В соответствии с СанПиН 2.1.4.1175-02 устанавливаются гигиенические требования к качеству воды, выбору места расположения, оборудованию и содержанию водозаборных сооружений и прилегающей к ним территории.
В питьевой воде источников децентрализованного водоснабжения без разводящей сети труб из микробиологических показателей нормируются:
- ОМЧ – не более 100 КОЕ/см3
- ОКБ – отсутствие в 100 см3
- ТКБ - отсутствие в 100 см3
- коли-фаги - отсутствие в 10 см3
- исследование на ТКБ и коли-фаги проводят при неблагополучной эпидемиологической обстановке территории.
ОМЧ, ОКБ, ТКБ, коли-фаги для воды децентрализованного водопользования определяются по тем же методикам, что и для воды централизованного водопользования. БГКП определяют согласно ГОСТ 18963-73.
2. Определение бактерий группы кишечных палочек
по ГОСТу 18963-73
2.1. Метод мембранных фильтров
Этап подготовки и проведения анализа проходит, как при исследовании на ОКБ по МУК 2.1.4.1074-01 (см. выше Занятие №2). На втором этапе идентификации лактозонегативные колонии по ГОСТу 18963-73 (в отличие от МУК 2.1.4.1074-01) отправляют на дальнейшее исследование на способность ферментировать глюкозосодержащую среду до кислоты и газа при температуре 37 °С.
2.2. Титрационный метод
Производят посев объёмов пробы воды в ГПС: 100 и 10 см3 пробы – флакон и пробирку со 100 и 10 см3 концентрированной ГПС соответственно, 1 и 0,1 см3 пробы – в пробирки с 10 см3 ГПС нормальной концентрации. Инкубируют при температуре 37 °С в течение 24 ч. При изменения цвета, образовании газа и помутнении ГПС делают высев на секторы среды Эндо. Дальнейшее исследование проводят, как описано в методе мембранных фильтров. Результаты учитывают по табл. 1.
3. Определение бактерий группы кишечных палочек
по ГОСТу 24849-81
Для экстремальных ситуаций и в полевых условиях определённый интерес представляет исследование питьевой воды на БГКП по ГОСТу 24849-81 «Вода питьевая. Полевые методы санитарно-микробиологического анализа». В нём представлена методика исследования воды титрационно-сигнальным методом, как одним из самых доступных вариантов.
Пробы воды объёмом 100, 10, 1,0, 0,1 и 0,01 см3 сеют на среду КОДА, которую готовят из готовой сухой смеси. Пробы воды объёмом 100 и 10 см3 вливают во флаконы или пробирки со 100 и 10 см3 концентрированной среды КОДА соответственно (для её приготовления берут удвоенную навеску сухой среды); 1 см3 воды и 0,1 см3 из разбавлений - в пробирке с 10 см3 среды нормальной концентрации. Посевы инкубируют при температуре 37 °С в течение 48 ч.
Предварительный учёт проводят через 24 ч, окончательный – через 48 ч. Положительным результатом теста считают появление мути и изменение цвета индикатора. Коли-индекс (индекс БГКП) вычисляют по табл. 1.
Контрольные вопросы
Что называется нецентрализованным водоснабжением?
Что служит источниками нецентрализованного водоснабжения?
По каким показателям определяется безопасность питьевой воды децентрализованного водоснабжения в эпидемическом отношении?
Какие нормативные документы регламентируют исследование воды нецентрализованного водоснабжения?
Какие приборы используются для отбора проб воды с глубины?
Как определяют ОМЧ воды?
Что такое ОКБ?
Какие питательные среды используют при определении колиформных бактерий в питьевой воде?
Какая среда используется для первичного посева при определении колиформных бактерий в питьевой воде методом мембранных фильтров?
Что такое ТКБ?
Какой метод оценки качества питьевой воды применяется в полевых условиях?
ПРИЛОЖЕНИЕ К ЗАНЯТИЮ №3
Нецентрализованным водоснабжением является использование для питьевых и хозяйственных нужд населения воды подземных источников, забираемой с помощью различных сооружений и устройств, открытых для общего пользования или находящихся в индивидуальном пользовании, без подачи ее к месту расходования.
Источниками нецентрализованного водоснабжения являются подземные воды, захват которых осуществляется путем устройства и специального оборудования водозаборных сооружений (шахтные и трубчатые колодцы, каптажи родников) общего и индивидуального пользования.
Таблица 1. Расчет индекса бактерий группы кишечной палочки
| Объем исследуемой воды, см3 | Коли-индекс | Коли-титр | |||
| 100 | 10 | 1 | 0,1 | ||
| - | - | - | - | ≤9 | ≥111 |
| - | - | + | - | 9 | 111 |
| - | + | - | - | 10 | 105 |
| + | - | - | - | 23 | 43 |
| + | - | + | - | 94 | 10 |
| + | + | - | - | 230 | 4 |
| + | + | - | + | 960 | 1 |
| + | + | + | - | 2380 | 0,4 |
| + | + | + | + | ≥2380 | ≥0,4 |
З А Н Я Т И Е 4
Дата ______________
Тема: Санитарно-микробиологическое исследование почвы
План занятия:
1. Отбор и предварительная обработка образцов почвы.
2. Определение общего количества бактерий в почве.
3. Определение бактерий группы кишечных палочек.
3.1. Бродильный (титрационный) метод.
3.2. Метод мембранных фильтров
3.3. Прямой поверхностный посев на плотные питательные среды
4. Определение перфрингенс-титра.
4.1. Посев почвенных разведений в среду Вильсона-Блера.
4.2. Использование сред накопления для определения клостридий в почве.
5. Определение термофильных бактерий.
6. Определение нитрифицирующих бактерий
Методические указания
1. Отбор и предварительная обработка образцов почвы
При определении степени загрязнения почвы промышленными источниками места для отбора проб располагают на площади трёхкратной величины санитарно-защитной зоны вдоль вектора розы ветров на расстоянии 100, 200, 300, 1000, 5000 м и более от источника загрязнения (ГОСТ 17.4.4.02-84).
При контроле состояния почв в районе точечных источников загрязнения пробные площадки размером 5x5 м закладывают на разном расстоянии от источника и в относительно чистом месте (контроль). На каждой из выбранных площадок пробы отбирают «по правилу конверта» (четыре пробы по углам участка и одну в центре). В месте отбора пробы выкапывают шурф размером 0,3x0,3 м и глубиной 20 см. Для этой цели используют почвенный бур Некрасова. Поверхность одной из стенок шурфа зачищают стерильным ножом и вырезают из этой стенки почвенный образец массой 200 г, что обычно составляет пласт размером 20x3x3 см.
При определении степени загрязнения почв химическими веществами, пробы отбирают поверхностно (0-1 см) стерильным инструментом (ножом, шпателем) в количестве 0,3-0,5 кг.
При оценке почв сельхоз территорий пробы отбираются два раза в год (весной и осенью) с глубины 0-25 см. На каждые 0-15 га закладывают не менее одной площадки размером 100-200 м2 в зависимости от рельефа местности и условий землепользования. Применяемые для работы инструменты перед взятием каждого нового образца стерилизуют.
Все отобранные образцы собирают в отдельные промаркированные пакеты, изготовленные из специальной бумаги «Крафт» или стерильные емкости, которые после заполнения закрывают пробками с бумагой и немедленно доставляют в лабораторию для анализа. Допускается хранение образцов до начала исследования при температуре 4-5 °С не более 24 ч.
В лаборатории из 5 точечных проб почвы, взятых с одного участка, готовят усреднённую пробу массой около 500 г, тщательно перемешивая и растирая образцы в стерильной фарфоровой чашке резиновым пестиком в течение 5 мин. Посторонние примеси (корни растений, камни, щепки) удаляют путём просеивания почвы через сито, которое предварительно протирают ватным тампоном, смоченным 96% этиловым спиртом.
Из усреднённой пробы отбирают навески (от 1 до 50-55 г в зависимости от определяемых показателей) и готовят суспензию 1:10 на стерильной водопроводной воде (10 г почвы на 90 см3 воды). Для десорбции микроорганизмов с поверхности почвенных частиц приготовленную почвенную суспензию встряхивают в течение 3 мин на мешалке механического диспергатора. После отстаивания суспензии в течение 30с готовят последовательные 10-кратные разведения почвы до концентрации 10-4-10-5 г/см3.
2. Определение общего количества бактерий в почве
Посев проводят в 1,5% МПА – не менее двух различных разведений пробы в зависимости от степени предполагаемого загрязнения исследуемой почвы. Перед посевом каждое разведение тщательно перемешивают стерильной пипеткой, забирают 1 см3 суспензии и переносят на дно стерильной чашки Петри. Из каждого разведения посев проводят минимум в две параллельные чашки. После этого в чашки вливают 15-20 см3 предварительно расплавленного и остуженного до температуры 45 °С питательного агара, тщательно перемешивают с почвенной суспензией и оставляют до застывания в строго горизонтальном положении. После застывания агара чашки с посевами помещают в термостат в перевёрнутом виде (крышкой вниз) при температуре 37 °С на 24 ч. После инкубации подсчитывают выросшие колонии и проводят пересчёт на 1 г почвы.
3. Определение бактерий группы кишечных палочек
3.1. Бродильный (титрационный) метод
При анализе почвы с невысокой степенью фекального загрязнения рекомендуют проводить определение БГКП титрационным методом с использованием среды Кесслер или лактозного бульона с трифенилтетразолием хлорида (ТТХ). 10 см3 почвенной суспензии первого разведения (1:10) засевают во флакон с 50 см3 среды, что соответствует посеву 1 г почвы. Последующие разведения высевают по 1 см3 в пробирки с 9 см3 той же среды. Перед посевом в каждую пробирку с лактозным бульоном добавляют 0,3 см3 2% водного раствора ТТХ, а в каждый флакон – по 1,5 мл.
Методика посева с использованием ТТХ основана на способности кишечной палочки восстанавливать бесцветное соединение ТТХ в трифенилформазан, выпадающий в осадок, придающий среде коричнево-красный цвет. Кишечная палочка устойчива к действию формазана, в то время как развитие другой микрофлоры подавляется. Посевы на среде Кесслер-Свенертона инкубируют 48 ч при температуре 43 или 37 °С. Отсутствие через 48 ч газообразования и помутнения в бродильных сосудах позволяет дать отрицательное заключение о наличии БГКП. Отрицательное заключение при использовании лактозного бульона с ТТХ дают через 24 ч в том случае, если в пробирках и флаконах цвет среды не изменился. При наличии признаков бактериального роста проводят высев на среду Эндо или розоловый агар. Чашки с посевами инкубируют при температуре 37 °С 24 ч. В случае отсутствия признаков роста на чашках дают отрицательное заключение. Красные, розовые с металлическим блеском, жёлтые и оранжевые колонии на розоловой среде типичны для кишечных палочек.
На заключительном этапе исследования проводят идентификацию выросших на агаризованных средах характерных колоний (аналогично анализу БГКП в воде). Результаты анализа выражают коли-титром.
3.2. Метод мембранных фильтров
Данный метод используют в качестве ускоренного метода анализа слабозагрязнённых почв. Через стерильные мембранные фильтры № 3 с помощью фильтровального аппарата Зейтца пропускают 5–10 см3 почвенной суспензии первого разведения, которую предварительно центрифугируют при 2000 об./мин в течение 5 мин. Дальнейшее исследование проводят аналогично анализу БГКП в воде методом мембранных фильтров.
3.3. Прямой поверхностный посев на плотные питательные среды
Этот метод применяют для исследования почвы из мест интенсивного фекального загрязнения. Проводят прямой поверхностный посев почвенной суспензии в количестве 0,1 или 0,05 см3на среды Эндо. При анализе сравнительно чистых почв посев проводят из разведений 1:10-1:100, для загрязнённых почв используют разведение 1:106. Посевы инкубируют в термостате при температуре 37 °С в течение 24 ч. На следующем этапе исследования идентифицируют выделенные бактерии (аналогично определению БГКП в воде).
Результаты двух последних методов исследований выражают коли-титром или коли-индексом.
4. Определение перфрингенс-титра
4.1. Посев почвенных разведений в среду Вильсона-Блера
Из всех почвенных разведений (до 1:106) образцы по 1 см3 переносят в 2 параллельных ряда пробирок. Один ряд пробирок прогревают при температуре 80 °С в течение 15 мин и/или при 90 °С – 10 мин. Затем во все пробирки добавляют по 9-10 см3 свежеприготовленной среды Вильсона-Блера. Инкубацию посевов проводят при температуре 37 или 43 0С в течение 24 ч. Учёт можно проводить и несколько раньше, так как санитарно-показательные клостридии, преимущественно С. perfringens, через несколько часов образуют колонии чёрного цвета. Обнаружение в мазках колоний характерных грамположительных палочек указывает на наличие С. perfringens. Общепринятая методика определения С. perfringens на среде Вильсона-Блера имеет существенный недостаток – питательная среда в определённой степени ингибирует рост микроорганизма. Для устранения этого явления предложена модификация методики.
4.2. Использование сред накопления для определения
клостридий в почве
По 1 см3 прогретых и нативных почвенных разведений засевают в про-бирки с полужидкими и жидкими питательными средами, предварительно регенерированными кипячением (Клодницкого, Китт-Тароцци, бульона Мартена с ватой и др.). После инкубации посевов в течение 18-20 ч при температуре 37 °С проводят высев 0,5-1 см3 материала из помутневших пробирок в среду Вильсона-Блера или сульфит-полимиксин-неомициновую среду. Посев, инкубацию и учёт при этом проводят аналогично первому способу.
5. Определение термофильных бактерий
Учёт термофильных сапрофитных микроорганизмов производят на МПА, который разливают толстым слоем. Посев проводят из разведений 1:10-1:106 в 2-3 параллельные чашки Петри. Учёт проводят после инкубации в течение 24 ч при температуре 60 °С аналогично, как при определении общего количества бактерий в почве.
6. Определение нитрифицирующих бактерий
Для определения нитрифицирующих бактерий сеют почвенные разведения во флаконы с минеральной средой Виноградского, разлитой тонким слоем. В ходе эксперимента два флакона со средой оставляют незасеянными в качестве контроля чистоты среды. Посевы инкубируют при температуре 28 °С в течение 14-15 сут. При развитии нитрифицирующих бактерий в среде образуются азотистая и азотная кислоты, которые определяют на 5-7 сутки после посева и вторично – на 14-15. Титр нитрифицирующих бактерий определяют качественной реакцией с дифениламином, который в присутствии азотистой и азотной кислот даёт синее окрашивание. Пастеровской пипеткой несколько капель среды из каждого флакона, не взмучивая осадок, переносят на стеклянную или фарфоровую пластинку, добавляют несколько капель дефениламина, разведённого концентрированной серной кислоте. Синее окрашивание указывает на присутствие в среде продуктов метаболизма нитрифицирующих бактерий. Среда контрольных флаконов должна оставаться без изменения окраски.
Заключение _________________________________________________
Контрольные вопросы
Как отбирают образцы почвы для исследований?
Как формируется усредненная проба образцов почвы?
Как определяется ОКБ в почве?
Какие методы используются для определения БГКП в почве?
В чем сущность бродильного метода определения БГКП?
В каких случаях используется прямой поверхностный посев почвы на плотные питательные среды?
Что такое перфрингенс-титр?
Какими методами определяется перфрингенс-титр?
Какие питательные среды используют для определения перфрингенс-титра?
Какие среды накопления используют для определения клостридий в почве?
Какие микроорганизмы называют термофильными?
Каким образом определяют термофильные бактерии в почве?
Какую питательную среду используют для определения нитрифицирующих бактерий?
Какие СПМО почвы вы знаете?
Какие микроорганизмы попадают в почву с выделениями человека и животных и дольше всех в ней сохраняются?
Какие показатели определяют при санитарном анализе почвы?
Какую роль в почве выполняют аммонификаторы и нитрификаторы?
ПРИЛОЖЕНИЕ К ЗАНЯТИЮ №4
При выборе объектов в первую очередь обследуют почвы территорий, наиболее значимых для здоровья населения. При проведении текущего санитарного надзора за состоянием почвы ограничиваются кратким санитарно-микробиологическим анализом, указывающим на наличие и степень фекального загрязнения, а также характеризуют процессы самоочищения почвы от загрязнителей органической природы и энтеробактерий.
Полный санитарно-микробиологический анализ почвы проводят в форме предупредительного санитарного надзора. Для изучения воздействия химических поллютантов на биогеоценоз необходимо исследование их бактерицидного действия на почвенную микробиоту, заключающегося в изменении состава сообщества почвенных микроорганизмов и ферментативной активности почвы. По эпидемическим показаниям проводят индикацию патогенной микробиоты.
1. Результаты исследования почвы используют для:
· определения степени опасности для здоровья людей в населённых пунктах (по эпидемиологическим показаниям);
· профилактики инфекционных и неинфекционных заболеваний (предупредительный санитарный надзор);
· текущего санитарного контроля за объектами, прямо или косвенно воздействующими на окружающую среду.
2. Санитарно-показательные микроорганизмы, характеризующие
загрязнение почвы
Общее количество бактерий - количество микроорганизмов, образующих колонии на МПА при температуре 37 °С в течение 24 ч, - суммарный показатель микробиологического загрязнения почвы микрофлорой преимущественно фекального происхождения.
Термофильные микроорганизмы - микроорганизмы, образующие колонии на МПА при температуре 60 °С в течение 24 ч, - показатель загрязнения почвы компостом или навозом. Почвы, показывающие высокое содержание кишечных палочек и низкое - термофилов, считают фекально загрязнёнными.
БГКП- грамотрицательные не образующие спор короткие палочки, ферментирующие лактозу и глюкозу до кислоты и газа при температуре 37°С в течение 24-48 ч, не обладающие оксидазной активностью.
Перфрингенс-титр - титр грамположительных облигатно-анаэробных спорообразующих палочек, восстанавливающих сульфиты. Присутствие Clostridium perfringens (споровых форм) свидетельствует о давнем фекальном загрязнении.
Аммонификаторы - микроорганизмы, превращающие азот в катионы аммония. Аммонификация (гниение) белков - результат деятельности гнилостной микробиоты (актиномицеты, грибы, анаэробные бациллы). Высокое содержание в почве этой микробиоты свидетельствует о присутствии органических веществ.
Нитрификаторы - микроорганизмы, окисляющие азот из солей аммония в нитраты и нитриты. К этой группе относятся представители родов Nitrosococcus, Nitrosolobus, Nitrosobacter. Их присутствие свидетельствует о наличии органического загрязнения и активно идущих процессах самоочищения.
Аэробные целлюлозоразрушающие микроорганизмы - почвенная микробиота, использующая целлюлозу в качестве источника углерода. В этой группе велика роль неспоровых бактерий, базидиальных, дрожжеподобных и несовершенных грибов.
Общая численность сапрофитов - количество микроорганизмов образующих колонии на МПА при температуре 28-30 °С в течение 72 ч. Высокая численность сапрофитной микробиоты свидетельствует об органическом загрязнении почвы.
Патогенные микроорганизмы - сальмонеллы (Salmonella spp.), патогенные клостридии (С. tetani, С. botulinum), возбудитель сибирской язвы (Bacillus anthracis), вирусы.
3. Основные нормируемые микробиологические показатели почвы
· ОМЧ
· БГКП
· Перфрингенс-титр
· Определение термофильных бактерий
· Аммонификаторы
· Нитрификаторы
· Аэробные целлюлозоразрушающие микроорганизмы
· Общая численность сапрофитов
· Патогенные микроорганизмы (сальмонеллы, C. tetani, C. botulinum, B. anthracis, вирусы)
4. Критерии оценки санитарного состояния почвы по микробиологическим показателям
Таблица 1. Характеристика загрязнения различных объектов внешней среды по санитарно-показательным микроорганизмам
| Типы загрязнения | Санитарно-показательные микроорганизмы | |||
| БГКП | Энтерококки | Клостридии | Термофилы | |
| Свежее фекальное загрязнение | +++ | +++ | +++ | -/+ |
| Давнее фекальное загрязнение | - | - | ++ | -/+ |
| Свежее загрязнение навозом, компостом | +++ | + | ++ | +++ |
| Давнее загрязнение навозом, компостом | - | - | ++ | +++ |
Примечание: +++ очень много данного СПМО; ++ много СПМО; + присутствуют СПМО; - отсутствуют СПМО.
З А Н Я Т И Е 5
Дата ______________
Тема: Санитарно-микробиологическое исследование воздуха.
План занятия:
1. Микробиологическое исследование воздуха, показания к проведению,
объекты исследования, микробиологические показатели.
2. Санитарно-бактериологическое исследование воздуха:
а) посев воздуха седиментационным методом Р. Коха;
б) аспирационный метод.
Методические указания
1. Микробиологическое исследование воздуха, показания к проведению,
объекты исследования, микробиологические показатели
Микробиологическое исследование воздуха проводится в плановом порядке (кратность определяется официальными документами) и по эпидемиологическим показаниям (при возникновении массовых инфекционных заболеваний). При плановых обследованиях проводят исследования только на СПМО, а при обследовании по эпидемиологическим показаниям – на патогенные и условно-патогенные микроорганизмы. Идентификация выделенных микроорганизмов осуществляется в соответствии с действующими нормативными документами.
Исследованию подлежат следующие помещения ЛПУ:
• операционные блоки, перевязочные и процедурные кабинеты,
• асептические палаты (боксы),
• палаты отделения анестезиологии и реанимации,
• палаты и коридоры лечебных отделений,
• помещения аптек, стерилизационных и акушерско-гинекологических отделений и
• станций (отделений) переливания крови.
Микробиологическое исследование воздуха предусматривает определение ОМЧ (общего микробного числа) и патогенных стафилококков (золотистый стафилококк) в 1 м3 воздуха при плановом контроле. В отдельных случаях дополнительно определяют наличие грамотрицательных бактерий, плесневых и дрожжевых грибов. При исследовании по эпидемиологическим показаниям спектр возбудителей существенно расширяется.
Для определения ОМЧ воздуха и санитарно-показательных микроорганизмов (золотистого стафилококка) производят посев аспирационным и седиментационным методом.
2. Санитарно-бактериологическое исследование воздуха
а) посев воздуха седиментационным методом Р. Коха
Седиментационный методКоха прост, не требует специальной аппаратуры. Суть метода: чашка с питательной средой ставится на рабочем столе, открывается на 10 мин, закрывается и ставится в термостат, где выдерживается двое суток при температуре 37 °С, а затем двое суток при комнатной температуре. После этого проводится подсчет выросших колоний по формуле Омелянского.
Для выявления грибов в воздухе посев проводится на среду Сабуро, и чашка выдерживается при 22-25 °С до 5 суток. Для выявления патогенных бактерий посевы проводят на дифференциально-диагностические среды: для золотистого стафилококка – на желточно-солевой агар, для энтеробактерий – на среду Эндо с добавлением генцианвиолетта (для торможения роста сапрофитов), для псевдомонад – на среду № 9. Чашки выдерживают в открытом виде 1 час, после чего ставят в термостат для культивирования при 37 °С на двое суток с последующим выдерживанием при комнатной температуре в течение 2 суток.
Расчет по модифицированной формуле Омелянского ведется на 1 м2 поверхности:
X = n.104 / p.r2.t ,
где X - ОМЧ воздуха обследуемого помещения (КОЕ); п - количество колоний на чашке (КОЕ); t - время экспозиции чашки (мин); p.r2 - площадь чашки Петри (см2); 104 - пересчет м2 в см2.
Формула Омелянского, даже модифицированная, имеет ряд существенных недостатков:
1) нельзя определить точный объем воздуха, из которого микробы оседают на чашку;
2) мелкодисперсная фаза аэрозоля (а с ним и микробы) практически не оседает и токами воздуха постоянно поддерживается во взвешенном состоянии.
Результаты, получаемые с помощью этого метода, позволяют сравнить, сопоставитьстепень микробной обсемененности разных помещений и ориентироваться при разработке мероприятий по очищению воздушной среды.
б) аспирационный метод
Аспирационный методизучения микрофлоры воздуха основан на использовании ударной струи воздуха, получаемый с помощью аппарата Кротова или других подобных ему аппаратов: (импактеры (ПУ-1Б), импинджеры (ПОВ-1), система HiAirPetriTM (последняя позволяет пропускать до 1000 л воздуха за 200 сек).
Достоинства этого метода:
- точно учитывается объем воздуха, пропускаемого через чашку с питательной средой, установленную в аппарате;
- принцип ударной струи воздуха способствует фиксации на влажной поверхности питательной среде всех взвешенных частиц аэрозоля.
Для определения санитарно-показательных микроорганизмов используют чашки с ЖСА, а для определения ОМЧ – МПА. Чашку с питательной средой помещают на вращающийся столик аппарата Кротова. Забирают 100л (ОМЧ) и 250л (СПМО) воздуха. Количество микроорганизмов определяют по формуле:
V=v*t, где
V - объем забираемого воздуха;
v - скорость просасывания воздуха - 25 л /мин;
t - продолжительность забора воздуха - 10 минут.
Посевы инкубируют в течение 20-24 часов при температуре 37 °С, а затем их оставляют еще на 24-48 часов при комнатной температуре (ЖСА).
Таким образом, удается фиксировать на поверхности плотной питательной среды максимальное количество микроорганизмов, обитающих в воздухе. Используя различные виды элективных и дифференциально-диагностических питательных сред, можно выявлять в воздухе все основные группы патогенных и условно-патогенных микроорганизмов.
Контрольные вопросы
Какие помещения ЛПУ подлежат исследованию воздуха?
Какие микробиологические показатели определяются при исследовании воздуха?
Что такое резидентная микрофлора воздуха?
Что такое транзиторная микрофлора воздуха?
Какие санитарно-показательные микроорганизмами при исследовании воздуха в закрытых помещениях вы знаете?
При каких заболеваниях воздух является основным фактором передачи?
На каком принципе основан метод Коха при санитарно-микробиологическом исследовании воздуха?
Какие недостатки имеет метод Коха?
Как можно использовать результаты, полученные при исследовании воздуха методом Коха?
В чем сущность аспирационного метода изучения микрофлоры воздуха?
Какие приборы для отбора проб воздуха вы знаете?
Какие достоинства имеет аспирационный метод исследования воздуха?
Какая питательная среда используется для определения золотистого стафилококка?
Что такое общая бактериальная обсемененность воздуха?
ПРИЛОЖЕНИЕ К ЗАНЯТИЮ №5
1. Понятия резидентной и транзиторной микрофлоры воздуха.
Резидентная микрофлора – сапрофитные бактерии с липохромным пигментом (сарцины, микрококки, сапрофитный стафилококк и др.); бациллы (сенная палочка, микоидные бациллы и др.); плесневые, дрожжевые, дрожжеподобные грибы.
Все эти микроорганизмы имеют структуры или механизмы, защищающие их от губительного действия ультрафиолетовых лучей, отсутствия влаги, питательных веществ.
Транзиторная микрофлора – патогенные и условно-патогенные бактерии, вирусы. Они являются возбудителями воздушно-капельной инфекции, раневой инфекции, гнойно-воспалительных заболеваний и др.
К ним относятся золотистый и эпидермальный стафилококк, дифтерийная, туберкулезная, синегнойная палочки, энтеробактерий (клебсиелла, протей, серрация и др.); вирусы кори, гриппа и др.
В неочищенном воздухе во взвешенном состоянии находятся инородные включения различных размеров:
· 0,03-0,30 мкм – вирусы, бактерии;
· 10,0-100,0 мкм – частицы пыли;
· 30,0-200 мкм – волокна, волосы.
Бактерии находятся в воздухе в виде аэрозоля, который по размерам частиц делится на фазы:
· крупнокапельная, быстро оседающая фаза – капли диаметром более 100 мкм;
· мелкоядерная фаза – капли и частицы диаметром менее 10 мкм. Они длительно находятся во взвешенном состоянии, и часть из них испаряется раньше, чем оседает («бактериальная пыль»).
Человек постоянно выделяет аэрозольные частицы, число которых колеблется от 1 тысячи до 30 миллионов в минуту, в зависимости от характера производимых им движений, состояния верхних дыхательных путей, интенсивности разговора. Капельки слюны, слизи при чихании, разговоре, кашле вместе с микробами попадают в воздух и с током воздуха могут разноситься далеко от источника. Бактерии могут оседать на пылевые частицы и «путешествовать» вместе с ними. Мелкодисперсные аэрозольные частицы практически не оседают и постоянно находятся во взвешенном состоянии. До 90% микробов, попадающих в воздух, погибают в течение 1 часа.
З А Н Я Т И Е 6
Дата ______________
Тема: Санитарно-микробиологическое исследование мяса
И мясных продуктов.
План занятия:
1. Разбор основных правил отбора и пересылки проб мяса и мясных продуктов для исследования.
2. Проведение микроскопического исследование мяса путем определения
количества бактерий в мазках-отпечатках.
3. Микробиологическое исследование мяса и мясных продуктов на наличие санитарно-показательных и патогенных микроорганизмов.
3.1. Подготовка проб к исследованию.
3.2. Определение количества мезофильных аэробных и факультативно-анаэробных микроорганизмов.
3.3. Определение количества бактерий группы кишечных палочек.
3.4. Методы обнаружения сальмонелл.
3.5. Методы выявления и определения количества Staphylococcus aureusв колбасных изделиях и продуктах из мяса
3.6. Определение количества сульфитредуцирующих клостридий.
3.7. Методы выявления Listeria monocytogenes.
Методические указания
1. Разбор основных правил отбора и пересылки проб мяса и мясных
продуктов для исследования
Для проведения микробиологических исследований мяса с целью выделения и идентификации микроорганизмов отбирают:
· мышечную ткань;
· лимфатические узлы;
· паренхиматозные органы.
Для бактериологических исследований скоропортящихся мясных продуктов (студни, зельцы, ливерные колбасы, кровяные изделия, паштеты) пробы отбирают с помощью стерильного ножа или других стерильных инструментов. Из выбранных единиц продукции берут разовые пробы и из них составляют общую пробу, а именно:
• от колбасных изделий - не менее двух разовых проб, ломтики по 15 см толщиной от края батона;
• от сосисок и сарделек - из разных мест, не нарушая целостности единиц продукции;
• от языков - с двух единиц продукции;
• от продуктов из свинины, баранины, говядины и мяса других видов убойных животных и птиц - пробы по всей толщине, ломтики шириной не менее 10 см от двух единиц продукции;
• от окороков - срез по всей толщине, отбирают образцы шириной не менее 10 см;
• от изделий без оболочки (студней, паштетов и др.) - разовые пробы не менее, чем от трёх единиц изделий массой 200-250 г каждая.
Отбор проводят стерильными приспособлениями в стерильную посуду с соблюдением правил асептики и антисептики. Образцы массой не менее 200 г упаковывают в пергамент, целлюлозную или пищевую полиэтиленовую плёнку и помещают в бумажный пакет. Затем пробы пломбируют и снабжают сопроводительной документацией, в которой указывают дату и время отбора пробы, номер и размер партии, номер образца, наименование и сорт продукта, объём необходимых исследований, должность и фамилию лица, проводившего отбор проб, и направившего должностного лица. Транспортируют образцы в кратчайший срок, при этом целесообразно использовать сумки-холодильники.
К исследованиям приступают не позднее, чем через 4 ч. Если это невозможно, отмечают причину задержки, а пробы хранят до анализа при температуре +4 °С (замороженные продукты - не выше -2 °С).
2. Проведение микроскопического исследование мяса путем определения
количества бактерий в мазках-отпечатках
Микроскопическое исследование мяса основано на определении
количества бактерий в мазках-отпечатках и степени распада мышечной ткани. Поверхность исследуемой мышечной ткани стерилизуют раскалённым шпателем или обжигают тампоном, смоченным в спирте. Вырезают стерильными ножницами кусочки размером 2,0x1,5x2,5 см поверхностями срезов прикладывают к предметному стеклу (по три отпечатка на двух предметных стёклах). Мазки-отпечатки высушивают на воздухе, фиксируют, окрашивают по Граму и микроскопируют (на одном предметном стекле исследуют 25 полей зрения).
|
| ||
| Стафилококк Staphylococcus | Микрофлора мазка-отпечатка Окраска по Граму | Кишечная палочка Escherichia coli |
3. Микробиологическое исследование мяса и мясных продуктов на наличие санитарно-показательных и патогенных микроорганизмов
3.1. Подготовка проб к исследованию
Каждый образец (мышцы, лимфатические узлы, паренхиматозные органы) перед посевом освобождают от видимой жировой и соединительной ткани, погружают на 2-3 мин в этиловый спирт-ректификат и два раза обжигают с поверхности. Затем стерильными ножницами из каждого образца (с различной глубины) вырезают кусочки размерами 2,0 х1,5м2, 5 см. Лимфатические узлы разрезают пополам. Все вырезанные кусочки измельчают стерильными ножницами.
Для последующих исследований готовят две пробы по 15 г каждая. Одна проба состоит из кусочков мышц и лимфатических узлов, а вторая - из кусочков паренхиматозных органов (печени, почек, селезёнки). Каждую пробу помещают в стерильный стакан (колбу) гомогенизатора, добавляют по 1,5 см3 0,9% раствора натрия хлорида и готовят взвеси в течение 2-5 мин. Полученные взвеси отстаивают 10 мин, и для исследований берут надосадочную жидкость.
При бактериологическом исследовании мясных продуктов в лаборатории из каждой общей пробы готовят средние образцы массой примерно 20 г. Навески помещают в стерильные стаканы (колбы), добавляют 0,9% раствор натрия хлорида и гомогенизируют не более 2,5 мин. При отсутствии гомогенизатора допустимо приготовление взвеси растиранием 20 г продукта в стерильной фарфоровой ступке с 2-3 стерильного кварцевого песка, постепенно приливая 80 см3 стерильного 0,9% раствора натрия хлорида или стерильной воды. Приготовленные взвеси отстаивают в течение 15 мин и для дальнейших исследований берут надосадочную жидкость, 1 см3 которой содержит 4,2 г продукта.
3.2. Определение количества мезофильных аэробных и факультативно-анаэробных микроорганизмов
Количество МАМ и ФАнМ в 1 г (см3) продукта определяют по числу колоний мезофильных аэробных и факультативно-анаэробных микроорганизмов, выросших на поверхности и в глубине плотных питательных сред при температуре 30±1 °С в течение 72 ч.
Для определения количества микроорганизмов в стерильные чашки Петри вносят по 1 см3 разных разведений из каждой пробы, заливая их 10-15 см3 расплавленного и охлаждённого до температуры 45 °С агара. Разведения выбирают в соответствии со стандартом (техническими условиями) на данный продукт.
Для подсчёта колоний используют лупу с 4-10-кратным увеличением или счётчик колоний. Для удобства каждую подсчитанную колонию отмечают со стороны дна маркером по стеклу. При значительном росте микробов дно чашки делят карандашом на секторы, подсчитывая число колоний отдельно в каждом секторе, а затем полученные числа складывают и умножают на степень разведения.
Количество микроорганизмов (N) в 1 г (см3) пробы вычисляют, как средневзвешенное значение из подсчётов на двух последовательных разведениях по формуле:
N=ΣC/V×(n1+0,1n2)×d,
где ΣС - сумма колоний, подсчитанных на всех чашках в двух последовательных разведениях, из которых хотя бы одна чашка содержит не менее 15 колоний;
V- объём посевного материала, внесённого в каждую чашку, см3;
n1 - количество отобранных для подсчёта чашек в первом разведении;
n2 - количество отобранных для подсчёта чашек во втором разведении;
d- коэффициент разбавления, соответствующий первому разведению.
Результат вычисления округляют до двух значащих цифр. Для получения достоверных результатов при подсчёте необходимо, чтобы хотя бы в одной чашке содержалось не менее 15 колоний. В противном случае указывают приближённое количество микроорганизмов в 1 см3, рассчитанное по среднему арифметическому колоний, выросших на двух чашках.
3.3. Определение количества бактерий группы кишечных палочек
Навеску анализируемого продукта (1,0-0,001 г по СанПиН 2.3.2.1078-01), в которой не должно быть БГКП, смешивают с 9 частями жидкой питательной среды (чаще всего используют среду Кесслер, содержащую в своём составе генцианвиолет, угнетающий рост грамположительных бактерий). Из пробирок с забродившей средой (помутнение, наличие газа в поплавках) делают посевы на чашки со средой Эндо. Посевы выдерживают в термостате при температуре 37 °С в течение 18-24 ч. Из колоний, типичных для БГКП (красных, с металлическим блеском, розовых, бледно-розовых), готовят мазки и окрашивают их по Граму.
3.4. Методы обнаружения сальмонелл
Пробу мяса или мясного продукта дважды пропускают через мясорубку, перемешивают, взвешивают 25 г, затем помещают в стерильную банку смесителя с 225 см3 буферной пептонной водой и гомогенизируют. Далее в асептических условиях переносят содержимое смесительной банки в стерильную колбу вместимостью 500 см3. Колбу выдерживают в термостате при температуре (37±1) °С не менее 16 и не более 20 ч, после чего приступают к анализу.
Выявление сальмонелл проводится в четыре последовательных этапа: первичный (прямой) посев, обогащение, посев со среды обогащения и подтверждение.
Первичный посев производится путем посева взвеси исследуемого материала на плотные элективные среды. Эти среды выдерживают в термостате при температуре 37 °С и исследуют на присутствие колоний, которые являются типичными или подозрительными на сальмонеллы.
На элективных средах сальмонеллы растут, образуя характерные колонии:
- на фуксин-сульфитном агаре (агаре Эндо) сальмонеллы растут в виде круглых, бесцветных или слегка розоватых прозрачных, или полупрозрачных колоний;
- на эозин-метиленовом синем агаре (агаре Левина) сальмонеллы растут в виде прозрачных, бледных, нежно-розовых или розовато-фиолетовых колоний.
Обогащение проводят путем посева на жидкие селективные среды (среды Мюллера, Кауфмана и Киллиана, селенитовый Ф-бульона и хлористо-магниевая среды "М"). Эти среды выдерживают в термостате при температуре 37 °С. На селенитовом бульоне лучшей температурой для накопления сальмонелл является 43 °С.
В случае отсутствия роста бактерий сальмонелл при первичном (прямом) посеве на элективных средах, через 12-24 ч проводят высев на селективные среды со сред обогащения. Предварительно содержимое флаконов перед пересевом тщательно перемешивают и высевают штрихом петлей диаметром 2,5-3 мм на чашку с висмут-сульфитным агаром, бактоагаром Плоскирева или агаром Эндо. Посевы помещают в термостат на 18-24 ч при температуре 37 °С, а посевы на висмут-сульфитном агаре - на 48 ч.
На селективных средах сальмонеллы растут, образуя характерные колонии:
- на бактоагаре Плоскирева сальмонеллы растут в виде бесцветных колоний, но колонии более плотные и несколько меньшего размера, чем на среде Эндо;
- на висмут-сульфитном агаре сальмонеллы растут в виде черных или коричневых колоний с характерным металлическим блеском.
Далее проводят подтверждение - пересев подозрительных на сальмонеллы колоний и определение их биохимических и серологических характеристик. В соответствии с нормативами санитарно-биологических показателей для мяса и мясных продуктов содержание сальмонелл в 25 г исследованного продукта не допустимо.
3.5. Методы выявления и определения количества Staphylococcus aureus в колбасных изделиях и продуктах из мяса
Сущность метода заключается в определении морфологии, характера роста на питательных средах и в способности отдельных стафилококков продуцировать лецитиназу и коагулировать цитратную плазму крови кролика под воздействием фермента коагулазы.
Методика проведения анализа заключается в следующем. Из разведения анализируемой взвеси продукта (1:10) проводят посевы на молочно-солевой агар, содержащий 65 г/дм3 хлористого натрия, для выявления пигмента или желточно-солевой агар, содержащий 65 г/дм3 хлористого натрия, для выявления лецитиназной активности. Взвесь наносят на поверхность агара в количестве 0,2 см3 и равномерно растирают по всей поверхности агаровой среды. Посевы термостатируют в течение 24 ч при температуре 37 °С и 24 ч выдерживают при комнатной температуре.
На поверхности питательной среды колонии стафилококка имеют вид плоских или слегка выпуклых блестящих колоний с ровным краем. При этом на молочно-солевом агаре лучше выявляется пигмент (эмалево-белый или золотистый), а на желточно-солевом агаре колонии стафилококков могут образовывать «радужный венчик», что является одним из признаков их патогенности.
Из подозрительных колоний готовят препараты, которые окрашивают по Граму. При наличии стафилококков в препарате обнаруживаются грамположительные мелкие кокки, располагающиеся неправильными гроздьями.
Для подтверждения признаков патогенности стафилококков ставят реакцию плазмокоагуляции. В прибор с 0,5 см3 цитратной плазмы крови кролика, разведенной физиологическим раствором в соотношении 1:4, вносят петлю чистой суточной культуры стафилококка и ставят в термостат при температуре 37 °С. Реакцию плазмокоагуляции учитывают через 3-4 ч (не встряхивая пробирку) и оставляют в термостате на сутки для окончательного учета через 24 ч.
Тест на коагулазу считают положительным, если культура показала, по крайней мере, 3+ - оценку коагулазной реакции, отмеченной на рисунке 1. Реакцию на 1+ или 2+ оценивают как промежуточную.
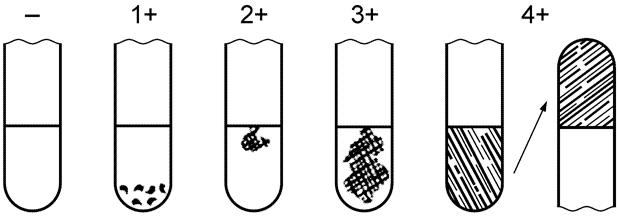
Рис. 1. Результаты коагулазного теста
- отрицательная оценка: не отмечено образования фибрина;
1+ положительная оценка: небольшие несформировавшиеся комочки;
2+ положительная оценка: небольшой сформировавшийся комок;
3+ положительная оценка: большой сформировавшийся комок;
4+ все содержимое пробирки скоагулировано и не меняет своего положения при переворачивании пробирки.
Для определения количества стафилококков учитывают колонии стафилококков, давшие положительную реакцию плазмокоагуляции.
Количество S. aureus в 1 см3 или 1 г продукта определяют исходя из количества коагулазоположительных стафилококков, принадлежность которых к S. aureus подтверждена по образованию ацетоина, определению ферментации в аэробных условиях мальтозы и, при необходимости, определению термостабильной нуклеазы и гемолитической активности. При расчете на 1 г продукта количество подсчитанных колоний умножают на степень разведения и делят на количество посевного материала.
3.6. Определение количества сульфитредуцирующих клостридий
Для определения количества этих бактерий в продукте используют количественный посев в глубину плотной питательной среды
Сущность метода заключается в специфическом росте сульфитвосстанавливающих клостридий в среде Вильсон-Блера, на которой в результате восстановления сернистокислого натрия в сернокислый натрий происходит взаимодействие с хлористым железом и образуется почернение среды за счет сернистого железа.
В пробирки, содержащие по 9 см3 расплавленной и охлажденной до температуры 45 °С среды Вильсон-Блера, вносят стерильной пипеткой по 1 см3 десятикратных разведений (от 10-1 до 10-7) взвеси испытуемого продукта. Посевной материал и среду тщательно перемешивают. Посевы помещают в термостат с температурой 46 °С на 8-12 ч или 37 °С на 20 ч. Появление в среде черных колоний или почернение всей среды указывает на присутствие сульфит-восстанавливающих клостридий.
Почернение среды Вильсон-Блера могут вызвать многие энтеробактерии. Для подтверждения роста сульфитвосстанавливающих клостридий используют пересев в пробирки со средой Китта-Тароцци, предварительно прогретой в течение 25 мин в кипящей водяной бане и быстро охлажденной до 45 °С. Термостатирование посевов проводят при (37±0,5) °С, ежедневно в течение 5 сут, проверяя в них помутнение среды, выделение газа, появление постороннего запаха, иногда разложение кусочков печени. Сразу после появления признаков роста готовят микроскопический препарат. Материал для этого берут пастеровской пипеткой со дна пробирки. При микроскопировании отмечают грамположительные палочки, образующие овальные споры.
У спорообразующих грамположительных микроорганизмов выявляют каталазную активность с помощью раствора перекиси водорода 30 г/дм3. Отсутствие пузырьков газа при добавлении к капле культуральной жидкости такого же количества перекиси водорода позволяет считать, что в посевах присутствуют микроорганизмы из рода клостридий.
В случае отсутствия спор в микроскопическом препарате положительной пробы на каталазу, присутствия в посевах смешанной микрофлоры, 1-2 капли накопительной среды переносят в стерильную чашку Петри, заливают расплавленной и охлажденной до 45 °С средой Вильсон-Блера. Застывшую поверхность плотной среды заливают холодным агаром. Посевы термостатируют 24-48 ч при (37±0,5) °С. Появление в нижнем слое агара черных или коричневых колоний свидетельствует о присутствии в посевах сульфитвосстанавливающих клостридий.
За положительный титр клостридий (сульфит-восстановителей) принимают то максимальное разведение суспензий, в посеве которого произошло почернение среды. Например, если характерные изменения наблюдаются в пробирках с разведением 10-2, то считают, что в исследуемом продукте будет 10 (или 1×101) клеток в 1 г; если характерные изменения наблюдаются в пробирках с разведением 10-2, то считают, что в исследуемом продукте - 100 (или 1×102) микробных клеток в 1 г.
3.7. Методы выявления Listeria monocytogenes
Из изменённых органов и тканей готовят мазки-отпечатки, которые красят по Граму и микроскопируют. В мазках листерии имеют вид мелких, часто полиморфных грамположительных палочек, расположенных одиночно или под углом в виде римской цифры V и в виде частокола. При посеве материала учитывают очаговую локализацию возбудителя в органах и тканях и используют изменённые участки, из которых готовят суспензию на 0,9% растворе натрия хлорида в соотношении 1:5 и из неё делают посевы, которые инкубируют в термостате при температуре 37 °С и ежедневно просматривают в первые 3-4 сут. При отсутствии роста наблюдение за посевами проводят в течение 2 нед.
На МПА листерии растут в виде мелких, круглых, прозрачных колоний при просмотре в проходящем свете (похожи на колонии возбудителя рожи). Через несколько дней колонии мутнеют. В мазке из агаровой культуры листерии выглядят как прямые короткие (0,3- 0,5x1-2 мкм) овоидные палочки, иногда - почти как кокки, располагающиеся одиночно или кучками. На МПА с 1% глюкозы и 2% глицерина, а также на печёночных средах рост напоминает колонии БГКП. На кровяном агаре листерии вызывают β-гемолиз.
Листерии вызывают равномерное помутнение МПБ, при встряхивании которого можно наблюдать муаровые волны, но более грубые, чем при росте рожистых бактерий. На 8-10 сут инкубации образуется осадок, который при встряхивании поднимается вверх в виде косички. В молодых культурах (6-24 ч) листерии подвижны; подвижность их лучше видна после культивирования при комнатной температуре; они сбраживают салицин, глюкозу, лактозу и глицерин с образованием кислоты без газа, не ферментируют маннит, дульцит; не разжижают желатин, не коагулируют молоко, редуцируют метиленовую синь.
Для дифференциации листерии от возбудителя рожи свиней проводят каталазную пробу. В пробирку с исследуемой культурой (растущей 12-24 ч на МПБ) прибавляют 1 см3 10% раствора перекиси водорода. При наличии каталазы жидкость вспенивается, бактерии рожи свиней каталазу не образуют.
Надёжным тестом для отличия листерии от рожистой палочки служит глазная проба: в конъюнктивальный мешок морской свинки вводят 1-2 капли смыва 0,9% раствором натрия хлорида суточной культуры, выросшей на МПА, и тщательно втирают в слизистую оболочку века. Обычно через 24 ч появляется отек века, гиперемия, слезотечение; через 36-72 ч веки припухают, и из глаза выделяется гнойный экссудат.
Для ускоренной дифференциации возбудителя листериоза от возбудителя рожи свиней используют индикаторные среды с лакмусом, нейтральротом в смеси с метиленовой синью, метилротом, конгоротом и амидо-чёрным. Листерии обесцвечивают среду с лакмусом и среду с нейтральротом в смеси с метиленовой синью до цвета МПБ в течение 3-6 ч, лишь у поверхности на границе с воздухом остаётся окрашенный ободок. При встряхивании цвет частично восстанавливается, поэтому посевы просматривают, не встряхивая пробирок. Среда с метилротом обесцвечивается листериями через 3-6 ч, но восстановление цвета среды не происходит. Обесцвечивание сред с конгоротом и с амидо-чёрным происходит в более поздние сроки - через 6-48 ч, после обесцвечивания среды исходный цвет не восстанавливается. Возбудитель рожи свиней не обесцвечивает ни одну из вышеуказанных сред с индикаторами.
Для серологической идентификации выделенных листерий применяют РА с поливалентной и групповыми листериозными сыворотками. Исследуемую культуру признают листериями при получении положительных результатов РА с листериозной сывороткой и отрицательной РА в контроле с 0,9% раствором натрия хлорида. Для идентификации возбудителя листериоза используют также листериозные бактериофаги (2А, 3А и 4А).
Контрольные вопросы
Как отбираются пробы мяса и мясных продуктов для микробиологических исследований?
Как осуществляется степень свежести мяса методом отпечатков?
Каким образом пробы мяса и мясных продуктов подготавливают к исследованиям?
Как определяют МАМ и ФАнМ?
Как определяют количество БГКП?
Какие этапы выявления сальмонелл вы знаете?
Что такое элективные и селективные питательные среды?
Какие характерные колонии образуют сальмонеллы на элективных средах?
Какие среды обогащения вы знаете?
Какие характерные колонии образуют сальмонеллы на селективных средах?
Что является ведущим свойством при установлении патогенности стафилококков?
В чем сущность реакции плазмокоагуляции?
Как оцениваются результаты коагулазного теста?
В чем сущность метода определения сульфитредуцирующих клостридий?
Что принимают за положительный титр клостридий?
Какие методы выявления листерий вы знаете?
Как проводится серологическая идентификация выделенных листерий?
Какие показания к отбору проб мяса вы знаете?
Как проводится оценка степени свежести мяса?
Какие санитарно-показательные микроорганизмы продуктов питания вы знаете?
ПРИЛОЖЕНИЕ К ЗАНЯТИЮ №6
1. Категории микроорганизмов в продуктах питания согласно СанПиН 2.3.2.1078-01 «Гигиенические требования к безопасности и пищевой ценности пищевых продуктов»:
• санитарно-показательные,к которым относят количество мезо-фильных аэробных и факультативно-анаэробных микроорганизмов (МАМ и ФАнМ), БГКП (коли-формы), бактерии семейства Enterobacteriaceae, энтерококки;
• условно-патогенныемикроорганизмы, к которым относят Е. coli, S. aureus, бактерии рода Proteus, В. cereus и сульфитредуцирующие клостридии, Vibrio parahaemolyticus;
• патогенныемикроорганизмы, в том числе сальмонеллы и Listeria monocytogenes, бактерии рода Yersinia;
• микроорганизмы порчи- дрожжи и плесневые грибы, молочнокислые микроорганизмы;
• микроорганизмы заквасочной микрофлорыи пробиотические микроорганизмы:молочно- и пропионовокислые микроорганизмы, дрожжи, бифидобактерии, ацидофильные бактерии и другие (в продуктах с нормируемым уровнем пробиотической микрофлоры и в пробиотических продуктах).
2. Показания к отбору проб мяса:
• вынужденный убой животных, независимо от причин, в том числе при отравлении или подозрении на отравление животных ядами;
• задержка удаления кишечника из туши более чем на 2 ч после убоя животного (птицы);
• недостаточное обескровливание туши;
• затруднения в определении пригодности мяса в пищу по данным санитарного анамнеза и осмотра на месте;
• расхождение результатов органолептической оценки и химических исследований;
• подозрение на то, что мясо или субпродукты послужили источниками пищевых отравлений.
3. Оценка степени свежести мяса.
1. Органолептические показания.
2. Проба варкой.
3. Количество бактерий и степень распада мышечной ткани путем микроскопирования окрашенных по Граму мазков-отпечатков.
Таблица №1.Оценка степени свежести мяса бактериоскопической пробой
| Степень свежести мяса | Показатели бактериоскопической пробы (в поле зрения микроскопа) |
| Свежее | Микроорганизмы не обнаружены или найдены лишь единичные (до 10 клеток) кокки и палочки. Следов распада мышечной ткани нет |
| Сомнительной свежести | Обнаружено не более 30 кокков или палочек, а также следы распада мышечной ткани: ядра мышечных волокон в состоянии распада, исчерченность волокон слабо различима |
| Несвежее | Обнаружено свыше 30 кокков или палочек. Распад мышечной ткани значительный: почти полное отсутствие ядер и полное исчезновение исчерченности мышечных волокон |
4. Краткая характеристика основных санитарно-показательных микроорганизмов продуктов питания.
1. Под БГКП понимают грамотрицательные, не образующие спор палочки, сбраживающие лактозу при температуре 36±1 °С с образованием кислоты и газа. При этом учитывают как цитратположительные, так и цитратотрицательные разновидности микроорганизмов.
2. Энтерококки- грамположительные кокки, располагающиеся парами, короткими или длинными цепочками, каталазоотрицательные. Типовой вид - Enterococcus faecalis. Согласно СанПиН 2.3.2.1078-01, количество энтерококков регламентировано в ряде быстрозамороженных готовых блюд:
· в блюдах из мяса животных и птиц - не более 1000 КОЕ/г;
· в блюдах из рубленого мяса животных и птиц, а также в блинчиках с мясом - не более 2000 КОЕ/г.
3.Сальмонеллы вызывают первичные инфекции у животных и человека, заканчивающиеся нередко летальным исходом, а также осложняют течение заболеваний вирусной и бактериальной этиологии. У переболевших животных длительное время отмечается бессимптомное сальмо-неллоносительство. При употреблении инфицированных продуктов животного происхождения (мяса, молока, яиц) сальмонеллы вызывают у человека пищевые отравления (токсикоинфекции).
4. Сульфитредуцирующие клостридии - крупные неподвижные бациллы длиной 4-8 мкм и шириной 1-1,5 мкм, в живом организме образуют капсулы, а в окружающей среде - центральные или субтерминальные овальные споры. Типовой представитель - Clostridium perfringens.
5. Стафилококки- бактерии, имеющие сферическую форму и размер 0,5-1,5 мкм, в результате деления более чем в одной плоскости образуют гроздевидные скопления, неподвижные, грамположительные. Типовой вид - S. aureus. Образуют внеклеточные ферменты и токсины и при определённых условиях могут стать причиной пищевых интоксикаций.
6. Бактерии родаProteus - полиморфные грамотрицательные палочки размерами 1-3 мкм в длину и 0,4 мкм в ширину. Располагаются попарно или цепочками, спор и капсул не образуют, подвижны. К роду относятся два вида микроорганизмов - P. mirabilis и P. vulgaris. Присутствие в пищевых продуктах микроорганизмов этой группы - признак начала гнилостных изменений. Указанные бактерии также могут быть причиной пищевых токсикоинфекций.
7. Listeria monocytogenes- подвижная, грамположительная, микроаэ-рофильная, не образующая спор палочка, патогенная для человека, животных и птиц. Заболевание характеризуется септическими явлениями, поражением центральной нервной системы. Наряду с тяжёлыми клиническими проявлениями встречаются лёгкие формы заболевания и носительство. Листерии длительно сохраняются (в высушенном состоянии - до 7 лет) и могут даже размножаться в пищевых продуктах при низких температурах хранения. Как факторы передачи листериоза наибольшую опасность представляют мясные (мясо заражённых свиней) и молочные продукты.
З А Н Я Т И Е 7
Дата ______________
Тема: Санитарно-микробиологическое исследование рыбы и
Рыбных продуктов.
План занятия:
1. Разбор основных правил отбора проб рыбы и рыбных продуктов.
2. Определение качества рыбной продукции путем исследования мазков-отпечатков
3. Санитарно-микробиологическое исследование рыбы и рыбных продуктов.
3.1 Определение бактериальной обсеменённости (количества МАМ и ФАнМ) в 1 г продукта.
3.2. Методы определения БГКП.
3.3. Методы выявления коагулазоположительных стафилококков в 1 г продукта.
3.4. Методы выявления и определения парагемолитических вибрионов.
Методические указания
1. Разбор основных правил отбора проб рыбы и рыбных продуктов
Отбор проб для исследования осуществляют по общим правилам (ГОСТ 26668-85).
Рыбу охлаждённую, мороженую, солёную, пряную, маринованную, вяленую, сушёную и копчёную; солёные балычные полуфабрикаты и балычные изделия берут в количестве нескольких экземпляров.
Для гигиенических исследований отбирают по 3 куска массой до 100 г каждый:
• рыбу жареную, отварную, печеную;
• рыбные рулеты, котлеты, сосиски, колбасы;
• фаршированную рыбу;
• студень, зельц;
• заливную рыбу;
• изделия из икры и др.
Для бактериологического исследования продукты берут с соблюдением правил асептики. Обеспечивают минимальные сроки доставки образцов в лабораторию, в жаркое время года продукты дополнительно охлаждают. В лаборатории навеску рыбы и рыбопродуктов плотной консистенции стерильно растирают в фарфоровой ступке, добавляя стерильную водопроводную или дистиллированную воду до конечной концентрации взвеси 10%.
Отбор средней пробы всех кулинарных изделий для микробиологических исследований проводят с соблюдением правил асептики стерильным ножом, ложкой, скальпелем в стерильные банки общей массой не менее 300 г от трёх единиц (упаковок). Отбор проб взаливках осуществляют пропорционально соотношению входящих компонентов.
Поверхность оболочечных изделий протирают спиртом. Из трёх батонов фаршевых изделий, соблюдая правила асептики, вырезают поперечные куски, затем разрезают их продольно и вырезают кусочки из центральной части и из-под оболочки.
Замороженную рыбу, рыбо- и морепродукты размораживают при температуре 18-20 °С в течение 1-2 ч и затем отбирают пробу, как при исследовании незамороженных кулинарных изделий. Мелкую рыбу и мелкие нерыбные объекты морского промысла в количестве 3-10 шт. отбирают из разных мест обследуемой партии. Печёную рыбу исследуют целиком. Крупную рыбу или куски порционной рыбы и крупные экземпляры нерыбных объектов морского промысла отбирают в количестве не менее 3 шт. Из разных мест каждого образца стерильным скальпелем вырезают по 2-3 кусочка площадью 4 см2, толщиной 4-5 см и переносят во взвешенную стерильную колбу. Посуду с образцами взвешивают и по разности масс устанавливают массу отобранной пробы.
Отобранную среднюю пробу измельчают в асептических условиях, затем 100-150 г исследуемого материала растирают в стерильной фарфоровой ступке или измельчают в гомогенизаторах (размельчителях тканей) РТ-1. Готовят десятикратные разведения.
2. Определение качества рыбной продукции путем
исследования мазков-отпечатков
Исследование мазков-отпечатков проводят в том случае, если доброкачественность рыбного сырья вызывает сомнение. Для этого кожу рыбы посередине спины или ближе к голове освобождают от чешуи и прижигают раскаленным скальпелем, затем стерильным скальпелем вырезают кусочки мяса рыбы площадью около 1,5 см2 и толщиной 1,5-2,0 мм. Кусочком мяса делают отпечаток на стерильном предметном стекле. Отпечаток мышечной ткани фиксируют, проводя 3 раза над пламенем горелки, окрашивают любым красителем и просматривают под микроскопом не менее 10 полей зрения (увеличение х900). В поле зрения микроскопа в мазке-отпечатке ткани рыбы, пригодной к употреблению, должно содержаться не более 10 клеток микроорганизмов (микро- и диплококков).
При стойкой повышенной обсемененности готовой продукции для выявления источника обсеменения проводят микробиологический анализ сырья.
3. Санитарно-микробиологическое исследование рыбы и
рыбных продуктов
3.1 Определение бактериальной обсеменённости (количества МАМ и ФАнМ) в 1 г продукта
Для определения бактериальной обсеменённости рекомендую следующие разведения взвесей продуктов:
· рыба жареная и печёная, фаршевые изделия, студень, рыба заливках, рыба холодного и горячего копчения - 10-1 и 10-2;
· рыба заливная пастообразная - 10-2 и 10-3.
Для проведения анализа 1 и 0,1 см3 приготовленной взвеси вносят в стерильные чашки Петри и заливают расплавленным и охлаждённым до температуры 50 °С МПА. Взвесь осторожно смешивают с МПА и помещают в термостат при температуре 37 °С на 48 ч. Учёт результатов проводят по общей методике определения числа колоний мезофильных аэробных и факультативно-анаэробных микроорганизмов, выросших на поверхности и в глубине плотных питательных сред (Занятие №6, раздел 3.2.).
3.2. Методы определения БГКП
БГКП определяют бродильным методом на среде Кесслер. При этом в питательную среду вносят разное количество исследуемого материала в зависимости от вида продукта.
Для посева 1 г (рыбы жареной, фарша, студня, рыбы в заливках, рыбы холодного копчения) используют 10 см3 исходного гомогенатаи 50 см3 среды Кесслер; для посева 0,1 г продукта (рыбы заливной) - 1 см3 исходного гомогената; при анализе 0,01 г продукта (пастообразного) - 1 см3 из разведения 10-2. Посевной материал в соответствующих разведениях вносят в пробирки со средой Кесслер с поплавками для обнаружения газообразования. При отсутствии газообразования через 18-24 ч инкубации продукт считают не загрязненным бактериями группы кишечных палочек. Из пробирок с забродившей средой (помутнение, наличие газа в поплавках) делают посевы на чашки со средой Эндо. Посевы выдерживают в термостате при температуре 37 °С в течение 18-24 ч. Из колоний, типичных для БГКП (красных, с металлическим блеском, розовых, бледно-розовых), готовят мазки и окрашивают их по Граму.
3.3. Методы выявления коагулазоположительных стафилококков
в 1 г продукта
Методы определения количества коагулазоположительных стафилококков и S. aureus основаны на высеве навески или разведения продукта в среды обогащения - солевые бульоны с содержанием натрия хлорида 6,5-10%, а также сахарный бульон, с последующим инкубированием посевов, подсчете типичных и (или) атипичных колоний и подтверждения по биохимическим признакам принадлежности выделенных колоний к коагулазоположительным стафилококкам и S. aureus. Методика проведения описана в занятии №6, раздел 3.5.
3.4. Методы выявления и определения парагемолитических вибрионов
Метод основан на выявлении в посевах исследуемого материала на элективных агаровых средах колоний, подозрительных на парагемолитические вибрионы, последующего выделения из них чистой культуры и идентификации ее по набору признаков, определяющих принадлежность к виду V. parahaemolyticus.
Из поступивших в лабораторию проб продуктов берут навеску 25 г, измельчают и гомогенизируют в размельчителе тканей (например, блендере, гомогенизаторе типа Stomacher со стерильными пакетами) или тщательно растирают в стерильной ступке с 2-3 г стерильного кварцевого песка.
При количественном определении парагемолитических вибрионов измельченную навеску переносят в стерильную колбу с 225 мл 0,1%-го раствора пептонной воды с 3% натрия хлорида, получая исходное разведение 1:10. Взвесь тщательно взбалтывают, не допуская намокания пробки, дают отстояться и из надосадочной жидкости готовят десятикратные разведения (1:100, 1:1000) путем последовательного переноса по 1,0 мл из предыдущего разведения в 9,0 мл разводящей жидкости, каждый раз меняя пипетку для смешивания и переноса взвеси. В качестве разводящей жидкости могут быть использованы 0,1%-й раствор пептона с 3% натрия хлорида или фосфатный буферный раствор. Готовят десятикратные разведения до 10-3, а при расследовании вспышек пищевых токсикоинфекций (ПТИ) - до разведения 10-7.
Для определения присутствия (отсутствия) парагемолитических вибрионов в исследуемой пробе всю гомогенизированную навеску в 25 г переносят в 125 мл жидкой среды обогащения - 1%-й пептонной воды с 3% натрия хлорида и ингибиторами роста сопутствующей микрофлоры или без них.
При количественном анализе из разведений пробы 1:10, 1:100 и 1:1000 высевают по 0,1 мл на 2 чашки с элективной агаровой средой, например: питательной средой элективно-дифференциальной для выделения холерного вибриона сухой - СЭДХ - ВФС 42-411 ВС-93, селективной средой для выделения патогенных вибрионов - TCBS или дифференциально-диагностический агар с пенициллином – ДДА. Посевной материал распределяют по поверхности агара и дают подсохнуть. Посевы помещают в термостат при (37±0,5) °С на 18-24 ч.
При качественном анализе посевы в накопительные среды инкубируют при (37±0,5) °С в течение 18-20 ч, после чего делают высев петлей с поверхностного слоя обогатительной среды на 1-2 чашки элективной среды для получения роста в виде изолированных колоний.
После инкубации изучают рост на элективных средах, отбирают подозрительные на парагемолитические вибрионы колонии. При количественном анализе для подсчета отбирают чашки с посевом двух последовательных разведений, где выросло не более 300 колоний. Необходимо, чтобы хотя бы в одной чашке содержалось не менее 15 колоний. С каждой из 4-х отобранных для подсчета чашек отсевают по 5 колоний. Парагемолитические вибрионы на элективной среде формируют колонии правильной округлой формы, плосковыпуклые, полупрозрачные в проходящем свете с влажной блестящей поверхностью размером 2-3 мм в диаметре, не отличающиеся по цвету от голубовато-зеленого цвета элективных сред (СЭДХ, TCBS, ДДА), т.к. вибрионы этого вида не ферментируют сахарозу, входящую в них. Подозрительные колонии отсевают на щелочной агар - питательную среду для выделения и культивирования холерного вибриона, сухую (ФС 42-213 ВС-88) и на одну из полиуглеводных сред Ресселя или Клиглера.
На полиуглеводных средах отбирают культуры с типичным для парагемолитических вибрионов ростом. На среде Ресселя и Клиглера отмечают характерное для кислой реакции изменение цвета столбика при сохранении цвета скошенной части агара.
Культуры, выросшие на щелочном агаре, изучают на наличие цитохромоксидазы. Из оксидазопозитивных готовят мазки по Граму.
Для дальнейшей идентификации отбирают оксидазопозитивные грамотрицательные культуры с характерным ростом на полиуглеводных средах. Отобранные культуры изучают по набору признаков (подвижность, лизиндекарбоксилаза, аргининдигидролаза, индол, рост в средах с различными концентрациями натрия хлорида, ферментация/окисление глюкозы на среде Хью и Лейфсона, арабинозы, сахарозы, целлобиозы, салицина, реакция Фогес-Проскауэра).
Контрольные вопросы
Какие особенности отбора проб рыбы и рыбных продуктов?
Как отбирают пробы замороженной рыбы?
Как проводят исследование рыбных продуктов методом мазков-отпечатков?
Какие патогенные микроорганизмы наиболее часто загрязняют свежевыловленную рыбу?
Как определяют бактериальную обсемененность рыбных продуктов?
Какие особенности определения БГКП вы знаете?
Как выявляют коагулазоположительных стафилококков в рыбных продуктах?
Какие существуют методы выявления парагемолитических вибрионов?
Какие среды используют для культивирования вибрионов?
Какие особенности микробиоценоза рыбы и рыбных продуктов вы знаете?
Какие бактерии являются главными возбудителями порчи охлажденной рыбы?
Какие микроорганизмы могут выживать в соленой рыбе?
Какие эпидемиологические особенности парагемолитических вибрионов вы знаете?
ПРИЛОЖЕНИЕ К ЗАНЯТИЮ №7
1.Особенности микробиоценоза рыбы и рыбных продуктов
По сравнению с теплокровными животными, мясо рыб более рыхлое, так как в нём меньше соединительной ткани, а это способствует распространению микроорганизмов. Количество и состав поверхностной микрофлоры только что выловленной рыбы могут значительно колебаться в зависимости от породы и вида рыбы, характера водоёма, сезона, района и техники лова. На 1 см2 поверхности обычно обнаруживается 102-104 бактерий, а иногда и больше. В основном это водные микроорганизмы, среди которых преобладают аэробные, бесспоровые, грамотрицательные палочковидные бактерии родов Pseudomonas, Alcaligenes, Acinetobacter, Flavobacterium. Встречаются микрококки и коринеформные бактерии, реже - спорообразующие бактерии, дрожжи и актиномицеты.
На поверхности рыбы, выловленной из загрязнённых водоёмов, могут находиться кишечная палочка, протей, а в отдельных случаях - сальмонеллы и энтерококки. Наиболее обсеменены микроорганизмами жабры и кишечник. В 1 г содержимого кишечника свежеуснувшей рыбы насчитывается 105-106 клеток гнилостных бактерий, среди которых выявляют множество спорообразующих анаэробов (С. sporogenes, С. putrificum). Наряду с ними обнаруживают микроорганизмы - возбудители пищевых отравлений: С. perfringens, Bacillus cereus, Staphylococcus aureus и даже палочки ботулизма (особенно в кишечнике осетровых рыб). На морской рыбе, выловленной в некоторых районах промысла, встречается галофильный вибрион (Vibrio parahaemolyticus) - возбудитель пищевых отравлений по типу токсикоинфекций.
Главными возбудителями порчи охлаждённой рыбы служат бактерии рода Pseudomonas. Псевдомонады не только быстрее других бактерий размножаются, но и обладают более высокой биохимической активностью по отношению к белковым веществам и жиру.
В порче охлаждённой рыбы также принимают участие, хотя и в значительно меньшей степени, бактерии родов Alcaligenes, Flavobacterium, Micrococcus.
В солёной рыбе могут выживать и токсигенные бактерии: сальмонеллы, золотистый стафилококк, Clostridium botulinum. В первые дни засола, пока концентрация соли не станет достаточной для задержки процесса токсинообразования, С. botulinum продуцирует ботулинический токсин.
2. Парагемолитические вибрионы - условно патогенные галофильные микроорганизмы семейства Vibrionaceae, обитающие в соленых водоемах. Выделяют их из морской воды, рыб, креветок, мидий, устриц, омаров, крабов. Впервые V. parahaemolyticus стал известен как причина крупной вспышки токсикоинфекции в Японии в 1950 г., связанной с употреблением в пищу слабосоленой рыбы. Крупные вспышки отмечены в 1984-1986 гг. на побережье Черного и Азовского морей в городах Бердянске, Мариуполе, Николаеве, Керчи. Спорадические заболевания имели место на побережье Балтийского и Японского морей, соленых озер Узбекистана и Туркмении. Во Владивостоке в 1997, 2001 гг. зарегистрированы вспышки острой кишечной инфекции, обусловленные вибрионами этого вида. Фактором передачи инфекции явились варено-мороженые креветки и другие морепродукты. В 2001 г. в Запорожской области Украины отмечены групповые острые кишечные заболевания, связанные с употреблением кильки сухого посола, контаминированной парагемолитическими вибрионами.
Опасность заражения парагемолитическими вибрионами существует везде, где население использует в питании продукты моря. Заболевания возникают, в основном, в теплое время года, зачастую в момент массового отлова рыбы, моллюсков, ракообразных. В местах, удаленных от побережья, отмечены заболевания, связанные с завозом инфицированных продуктов моря. Риск возникновения заболеваний увеличивается с ростом импортируемой продукции из регионов, потенциально опасных по возможности возникновения вспышек пищевых токсикоинфекций, обусловленных парагемолитическими вибрионами. Зарегистрированы случаи выделения парагемолитических вибрионов от больных острыми кишечными инфекциями, из гидробионтов, водоемов и в пресноводном регионе (дельте Волги). Отмечены случаи вторичного инфицирования овощных продуктов при обработке их водой, содержащей парагемолитические вибрионы.
Острые кишечные заболевания, вызываемые V. parahaemolyticus, относят к пищевым токсикоинфекциям (ПТИ), возникающим при употреблении в пищу продуктов, в которых произошло массовое размножение микроорганизмов-возбудителей и накопление их токсинов. У парагемолитических вибрионов известны термостабильный прямой гемолизин (ТПГ), детерминируемый tdh-геном, термолабильный гемолизин и неидентифицированный энтеротоксин. Инфективная доза возбудителя составляет 105-106 вибрионов в 1 грамме продукта. Особую опасность представляют сырые гидробионты, в которых концентрация V. parahaemolyticus может достигать 109 в грамме, а также продукты, подвергнутые недостаточной кулинарной обработке. Хотя парагемолитические вибрионы чувствительны к высокой температуре, находясь внутри больших кусков рыбы или крупных крабов, они могут выдерживать термическую обработку. Время генерации этого микроорганизма составляет 12 мин при температуре 30-37 °С, поэтому при неправильном хранении вибрионы довольно быстро размножаются с накоплением экзотоксинов в продуктах. Употребление их в пищу приводит к развитию токсикоинфекции. В малосоленой и недовяленной рыбе при определенной температуре вибрионы не только сохраняются, но и размножаются.
Одним из микробиологических показателей оценки безопасности рыбы и рыбных продуктов является V. parahaemolyticus. Определение его осуществляется по массе продукта, в которой не допускается присутствие парагемолитических вибрионов, или по количеству колониеобразующих единиц (КОЕ) в 1 г продукта.
Исследование рыбы и морских беспозвоночных на присутствие парагемолитических вибрионов проводят в порядке текущего надзора (контроля) на этапах производства и реализации, по эпидемическим показаниям, а также в случае возникновения неблагоприятной экологической ситуации в регионе лова рыбы, моллюсков и ракообразных.
Дата добавления: 2018-04-05; просмотров: 2138; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
