O C равен 2,5. Какова энергия активации этой реакции? Определите относительное изменение скорости в крайних точках этого диапазона
153. Вычислите массовую долю (в %) вещества в растворе, полученном при сливании 100 мл 10%-ного (ρ = 1,05 г/мл) и 150 мл 20%-ного (ρ = 1,12 г/мл) растворов азотной кислоты?
m(HCl)= 20 * 0,15 = 3
m(NaOH) = 20 * 0,10 = 2
3 2 ?
HCI + NaOH = NaCl + H2O
36,5 40 58,5
HCl = 3/36,5 = 0,08 моль
NaOH = 2/40 = 0,05 моль ( берем ту, которая меньше)
m(NaCl) = (58,5 *2) / 40 = 2,925 г.
(2,925 \ 5)* 100% = 58,5 %
Ответ
173. При 20 oC давление пара над водой равно 17,53 мм рт. ст. Сколько граммов глицерина С3Н5(ОН)3 нужно растворить в 180 г воды для того, чтобы снизить давление пара до 16,53 мм рт. ст.?
Какие из веществ будут взаимодействовать с HCl: Ba(OH)2, CuS, HNO3, NH4Cl, Na2CO3? Запишите реакции в ионной и молекулярной форме.
Реакция нейтрализации, протекающая с образованием слабого электролита – воды:
HCl + ВаOH = ВаCl + H2O
Полное ионно-молекулярное уравнение:
H+ + Cl- + K+ + OH- = K+ + Cl- + H2O
Реакции, идущие с образованием газообразного продукта
CuS + 2HCl = CuCl2 + H2S ↑
Полное ионно-молекулярное уравнение:
CuS + 2H+ + 2Cl- = Cu2+ + 2Cl- + H2S↑
Реакция взаимодействия хлороводорода и азотной кислоты
6HCl + 2HNO3  2NO + 3Cl2 + 4H2O
2NO + 3Cl2 + 4H2O
Реакция образования углекислого газа и поваренной соли
Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑
полноеионное: 2Na(+) + CO3(2-) + 2H(+) + 2Cl(-) → 2Na(+) + 2Cl(-) + H2O + CO2↑
218. Как зависит степень гидролиза от температуры? Почему? В какую сторону сместится равновесие гидролиза NaCN, если к раствору прибавить: а) щелочь, б) кислоту, в) хлорид аммония?
Поскольку гидролиз усиливается при повышении температуры, равновесие сдвигается в сторону образования продуктов гидролиза, то степень гидролиза повышается с ростом температурыю
|
|
|
Гидролиз  .
.
 - соль, образованная слабой кислотой и сильным основанием, в растворе будет идти гидролиз по аниону:
- соль, образованная слабой кислотой и сильным основанием, в растворе будет идти гидролиз по аниону:

реакция среды щелочная, . 
А) при добавлении щелочи, повышается концентрация  в растворе, равновесие сдвигается в сторону обратной реакции, гидролиз уменьшается.
в растворе, равновесие сдвигается в сторону обратной реакции, гидролиз уменьшается.
Б) при добавлении кислоты, ионы 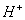 будут связывать ионы
будут связывать ионы  , образуя молекулы воды, равновесие сместится в сторону образования продуктов гидролиза, гидролиз усилится.
, образуя молекулы воды, равновесие сместится в сторону образования продуктов гидролиза, гидролиз усилится.
В) При добавлении хлорида аммония усиливается гидролиз каждой из солей:  и
и  , поскольку в результате реакции обмена образуется соль слабого основания и слабой кислоты, гидролизующаяся по катиону и аниону:
, поскольку в результате реакции обмена образуется соль слабого основания и слабой кислоты, гидролизующаяся по катиону и аниону:

238. См. условие задачи 231 для реакций:
H2S + Cl2 + H2O → H2SO4 + HCl;
K2Cr2O7 + H2S + H2SO4 → S + Cr2(SO4)3 + K2SO4 + H2O.
231. Реакции выражаются схемами: P + HIO3 + H2O → H3PO4 + HI.
H2S + Cl2 + H2O → H2SO4 + HCl.
Составьте баланс степеней окисления. Расставьте коэффициенты в уравнениях реакции. Для каждой реакции укажите, какое вещество является окислителем, какое восстановителем; какое вещество окисляется, какое восстанавливается.
Ответы: 6P + 5HIO3 + 9H2O → 6H3PO4 + 5HI
|
|
|
P0 - 5e → P5+ | 5 | 6 восстановитель (окисляется)
I5+ + 6e → I- | 6 | 5 окислитель (восстанавливается)
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
S2- - 8e → S6+ | 8 | 1 восстановитель (окисляется)
Cl20 + 2e → 2Cl- | 2 | 4 окислитель (восстанавливается)
3H2S + K2Cr2O7 + 4H2SO4 = 3S + Cr2(SO4)3 + 7H2O + K2SO4
S-2 - 6е=S+4 |6|1 восстановитель
2Cr+6 + 2*3е =2Cr+3 |6|1 окислитель
258. При какой концентрации ионов Cu2+ (моль/л) потенциал медного электрода равен стандартному потенциалу водородного электрода?
Значение равновесного электродного потенциала медного электрода определим по уравнению Нернста:
Eравн. = Е0 + (0,059/n)*lg[Cu2+] = 0,34В + (0,059/2)*lg[Cu2+] = 0,00 В
Стандартный электродный потенциал водорода равен:
Е0H2 = 0,00 В
(0,059/2)*lg[Cu2+] = 0,00 В - 0,34 = -0,34
lg[Cu2+] = -11,53
[Cu2+] = 2,95*10-12 моль/л
Дата добавления: 2018-02-28; просмотров: 315; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
