Свойства растворов ВМС
Для растворов ВМС характерны три группы свойств. Первые две присущи истинным и коллоидным растворам, а третья группа свойств характерна только для растворов ВМС; к ним относятся набухание и студнеобразование.
В отличие от истинных и коллоидных растворов, для которых осмотическое давление определяется формулой (9.11), осмотическое давление растворов ВМС вычисляется по формуле
 (19.3)
(19.3)
где с, М — концентрация и молекулярная масса ВМС; b —второй вириальный коэффициент.
В формуле (19.3), характеризующей изменение осмотического давления как случайной величины, b является вторым вириальным коэффициентом, который отражает флуктуацию конформационных структур макромолекул.
Если разделить правую и левую части уравнения (19.3) на концентрацию, то получим выражение
 (19.4)
(19.4)
Величину π/ с называют приведенным осмотическим давлением. Для идеальных растворов и большинства истинных и коллоидных растворов значение π/ с остается постоянным и не зависит от концентрации. Для растворов ВМС за счет различия конформационных форм макромолекул ВМС величина π/ с изменяется в зависимости от концентрации ВМС, что и отражено в уравнении (19.4).
В координатах «π/ с — с» уравнение (19.4) является уравнением прямой, тангенс угла наклона которой численно равен второму вириальному коэффициенту b, а отрезок, отсекаемый этой прямой на оси ординат при с = 0, соответствует величине RT / М, т.е. обратно пропорционален молекулярной массе макромолекул ВМС.
|
|
|
Таким образом, по значению осмотического давления можно определить молекулярную массу макромолекул растворенных ВМС. Наиболее точные результаты получены для ВМС, макромолекулы которых имеют молекулярную массу в пределах l.104–2.105.
Вязкость растворов ВМС, как и любых растворов, в том числе и коллоидных, зависит от концентрации вещества в растворе [см. уравнение (11.7)]. В отличие от других растворов незначительная концентрация ВМС порой приводит к значительному увеличению вязкости раствора. Так, вязкость 1%-го раствора каучука в бензине в 18 раз выше вязкости чистого бензина. Вязкость истинных растворов при данной температуре является постоянной. Например, при 293 К вязкость 50%-го раствора глицерина составляет 6.10–3Па-с. Растворы ВМС ведут себя иначе. Макромолекулы синтетических ВМС характеризуются неодинаковыми размерами и массой; их вязкость будет определяться не только концентрацией, но размерами макромолекул и их конформационным состоянием.
Вязкость растворов ВМС зависит от условий определения, в частности от давления. Дело в том, что одни и те же макромолекулы могут находиться в различных конформационных состояниях; от линейных до глобул. По этой причине вязкость концентрированных растворов ВМС может быть анизотропной, т.е. неодинаковой в различных направлениях. Вязкость макромолекул с выпрямленными и ориентированными хаотично по отношению к направлению движения звеньями выше, чем вязкость макромолекул, которые имеют форму клубка или глобул.
|
|
|
Если вязкий полимер или его раствор продавливать через капилляр, то макромолекулы будут ориентироваться и вытягиваться, а наблюдаемая вязкость системы снижается.
Вязкость растворов ВМС в значительной степени зависит от свойств и температуры растворителей. Растворители способны влиять на конформационную форму макромолекул и за счет этого изменять вязкость одного и того же раствора ВМС, т.е. вязкость раствора ВМС определяется природой самих ВМС и растворителя.
Таким образом, вязкость растворов ВМС при идентичных условиях (одинаковый состав, равная концентрация и температура) может быть переменной. Поэтому ее сопоставляют с вязкостью чистого растворителя. Для растворов ВМС различают относительную, удельную, приведенную и характеристическую вязкость.
Относительная вязкость — это отношение вязкости раствора τpк вязкости растворителя τ0(обычно к вязкости воды)
|
|
|
 (19.5)
(19.5)
Относительную вязкость можно определить по времени истечения раствора ВМС τpи растворителя τ0через калиброванное отверстие вискозиметра.
Удельная вязкость показывает, насколько увеличилась вязкость раствора ВМС по сравнению с вязкостью растворителя:
ηуд. = (ηр – η0)/η0 =(τр – τ0) = ηотн. - 1 (19.6)
Конформация и ориентация макромолекул относительно направления течения раствора зависят от концентрации растворителя. По этой причине удельную вязкость относят к концентрации и получают приведенную вязкость ηпр:
ηпр. = ηуд./с (19.7)
Обычно приведенная вязкость линейно зависит от концентрации ВМС (рис. 19.3). При экстраполяции прямой, приведенной на рис. 19.3, до пересечения с осью ординат получают величину [η], которую называют характеристической вязкостью:
[η] =  ηуд./с (19.8)
ηуд./с (19.8)
Характеристическую вязкость определяют на основании вискозиметрических измерений, используя значения относительной, удельной и приведенной вязкости в качестве вспомогательных величин.
Характеристическая вязкость для данной пары веществ (растворитель — ВМС) является условной, но постоянной величиной. Эта величина не зависит от концентрации растворителя и конформационных состояний макромолекул.
|
|
|
Характеристическая вязкость обладает еще одним замечательным свойством; она непосредственно связана с молекулярной массой макромолекул ВМС. Заметим, что у некоторых природных ВМС, в том числе и белков, молекулярная масса постоянна. Поэтому среднюю молекулярную массу определяют для всех синтетических и части природных ВМС.
Для одного и того же растворителя связь между характеристической вязкостью и молекулярной массой М выглядит следующим образом:
 (19.9)
(19.9)
где 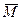 — средняя молекулярная масса для синтетических и части природных ВМС и истинная — для некоторых природных соединений; k — коэффициент, постоянный для раствора ВМС одного гомологического ряда в данном растворителе; α — коэффициент, характеризующий гибкость цепей макромолекул в растворе и их форму в зависимости от конформационного состояния.
— средняя молекулярная масса для синтетических и части природных ВМС и истинная — для некоторых природных соединений; k — коэффициент, постоянный для раствора ВМС одного гомологического ряда в данном растворителе; α — коэффициент, характеризующий гибкость цепей макромолекул в растворе и их форму в зависимости от конформационного состояния.
Уравнение (19.9) по имени авторов называют уравнением Марка-Куна-Хаувинка.
Чем лучше растворитель, тем больше значение коэффициента α, который изменяется в пределах 0 ≤ α ≤ 2.
Для растворов полимеров с короткими и жесткими звеньями и линейной формой макромолекул коэффициент α = 1, и уравнение (19.9) упрощается:
 (19.10)
(19.10)
 После денатурации в 6М растворе гуанидинийгидрохлорида белки ведут себя в основном как статистические клубки, и коэффициент α = 0,66, а макромолекулы ДНК преимущественно имеют линейную форму, для них α = 1,13.
После денатурации в 6М растворе гуанидинийгидрохлорида белки ведут себя в основном как статистические клубки, и коэффициент α = 0,66, а макромолекулы ДНК преимущественно имеют линейную форму, для них α = 1,13.
Значение коэффициентов k и α определяют экспериментально. Для этой цели измеряют вязкость раствора ВМС определенного гомологического ряда с фиксированной молекулярной массой макромолекул.
 По известным значениям коэффициентов k и α и определенной экспериментально характеристической вязкости по уравнению (19.9) можно рассчитать среднюю молекулярную массу макромолекул. Зная молекулярную массу, можно определить средний размер r макромолекулы, если воспользоваться следующей формулой:
По известным значениям коэффициентов k и α и определенной экспериментально характеристической вязкости по уравнению (19.9) можно рассчитать среднюю молекулярную массу макромолекул. Зная молекулярную массу, можно определить средний размер r макромолекулы, если воспользоваться следующей формулой:
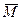 = 4π(r)3ρ N A/3, (19.11)
= 4π(r)3ρ N A/3, (19.11)
где NА — число Авогадро.
В связи с тем что удельный объем макромолекул ВМС является величиной, обратной их плотности, т.е. v = 1/р, радиус макромолекулы можно выразить как
 (19.12)
(19.12)
При помощи уравнений (19.11) и (19.12) можно определить эффективный радиус макромолекул ВМС (если принять, что их форма близка к сферической) в тех случаях, когда макромолекула имеет линейную структуру и образует глобулу.
Любая реальная макромолекула включает связанный с нею растворитель, масса которого равна m p. С учетом этого эффективный радиус макромолекулы ВМС вместо формулы (19.12) будет определяться следующим образом:
 (19.13)
(19.13)
где v p— удельный объем растворителя, м3/кг.
Молекулярную массу, а также размер и форму макромолекулы ВМС можно определить по интенсивности рассеянного света. Если обозначить через R отношение интенсивности рассеянного света к интенсивности падающего света (R = J p/ J 0), а остальные величины правой части уравнения (8.2) остаются постоянными и равными К p, то влияние молекулярной массы на относительное снижение рэлеевского рассеяния можно выразить следующим образом:
 (19.14)
(19.14)
По значению относительной интенсивности рассеянного света можно определить молекулярную массу макромолекул ВМС.
Амплитуда двух световых волн, рассеянных от двух возбужденных здектронов одной макромолекулы и расположенных на определенном расстоянии, не совпадает по фазе. Если результирующая относительного рэлеевского рассеяния, полученная путем интерференции всех волн, будет равна К’p, то уравнение (19.14) приобретает вид
 (19.15)
(19.15)
где R и= J ир/ J р; J ир, J р — интенсивность рассеянного света с учетом и без учета интерференции всех рассеянных волн.
Зная R ии определив интенсивность рэлеевского рассеяния, можно рассчитать размеры и форму макромолекул ВМС. При этом надо иметь в виду, что рассеяние света зависит от конформационного состояния макромолекул ВМС. Максимальное рассеяние света наблюдается для макромолекул глобулярной формы.
У полимеров, полученных искусственным путем, молекулярная масса макромолекул различается, и довольно существенно. Поэтому для них характерна лишь средняя молекулярная масса. Макромолекулы природных ВМС имеют определенную структуру и постоянную молекулярную массу. В то же время могут существовать смеси природных ВМС различного состава. Например, макромолекулы крахмала состоят из смеси ВМС, которые отличаются друг от друга числом мономерных звеньев — остатков глюкозы.
Различают среднечисленную и среднемассовую молекулярные массы ВМС.
Среднечисленная молекулярная масса определяется по формуле
 (19.16)
(19.16)
где М i, n i— молекулярная масса и число i -тых макромолекул.
Среднечисленную молекулярную массу используют в тех случаях, когда молекулярные массы макромолекул различаются незначительно. Если эти различия значительны (например, молекулярные массы отдельных макромолекул различаются на два и более порядка), то расчеты по формуле (19.16) дают искаженные результаты. В этом случае среднюю молекулярную массу выражают при помощи массовой доли хi, которая определяется отношением массы макромолекул данной фракции n i М iк общей массе всех макромолекул  т.е.
т.е. 
С учетом этого среднемассовая молекулярная масса выразится так:
 (19.17)
(19.17)
Следует еще раз подчеркнуть, что определение среднего значения массы макромолекул по формулам (19.16) и (19.17) справедливо лишь для синтетических и части природных ВМС. Для макромолекул некоторых природных ВМС, в частности белков, когда их состав фиксирован, определение среднего значения массы теряет смысл.
Набухание
Макромолекулы ВМС при взаимодействии с растворителями способны к набуханию. Набухание — это увеличение массы и объема ВМС за счет поглощения низкомолекулярной жидкости или ее пара. Оно характеризуется степенью набухания α, которая показывает относительное увеличение массы ВМС
 (19.18)
(19.18)
где m 0, m — масса ВМС до и после набухания; m ж— масса поглощенной жидкости.
Часто степень набухания выражают в процентах. Степень набухания может изменяться в широком диапазоне — от десятков до тысячи процентов; для природных ВМС степень набухания обычно не превышает 1600%.
Набухание имеет место в процессе получения и хранения продуктов питания. Прорастанию зерна всегда предшествует его набухание. Процесс приготовления теста заключается в смешивании муки с водой с добавкой веществ, стимулирующих брожение. Образование из муки теста происходит в результате набухания белков и крахмала. Степень набухания белков достигает 200%, для крахмала она значительно меньше. Мякиш хлеба — это набухшая система. Степень набухания свежего хлеба может быть равна 15%, а черствого — 4%: для сухарей она составляет уже 25—35%.
В мукомольной промышленности для облегчения разрушения зерен при помоле их предварительно подвергают гидротермической обработке. При повышении температуры до 323 К зерно набухает. Процесс происходит неравномерно, в результате создаются внутренние напряжения, которые способствуют диспергированию, т.е. разрушению зерен.
При замачивании зерна набухание идет более интенсивно. Замачивание кукурузного зерна перед помолом применяют при производстве крахмала. Замачивание является первой стадией процесса при производстве солода, основного сырья для получения кваса и пива. Замачивание и набухание агара и агароида используются в начале технологических операций при производстве желейных кондитерских изделий (мармелада).
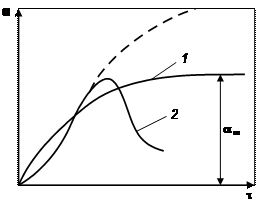 Степень набухания зависит от времени (рис. 19.4). Набухание может быть ограниченным (кривая 1) и неограниченным (кривая 2). При ограниченном набухании макромолекулы поглощают жидкость, но в ней не растворяются. В результате ограниченного набухания степень набухания достигает максимального значения α∞и в дальнейшем не увеличивается. Ограниченное набухание приводит к образованию студня. Неограниченное набухание заканчивается растворением. Подобный процесс наблюдается при набухании натурального и синтетического каучука в углеводородах, глобулярных белков в воде, желатина в горячей воде.
Степень набухания зависит от времени (рис. 19.4). Набухание может быть ограниченным (кривая 1) и неограниченным (кривая 2). При ограниченном набухании макромолекулы поглощают жидкость, но в ней не растворяются. В результате ограниченного набухания степень набухания достигает максимального значения α∞и в дальнейшем не увеличивается. Ограниченное набухание приводит к образованию студня. Неограниченное набухание заканчивается растворением. Подобный процесс наблюдается при набухании натурального и синтетического каучука в углеводородах, глобулярных белков в воде, желатина в горячей воде.
 В результате ограниченного набухания белков муки образуется эластичное и плотное по консистенции тесто. Когда часть белков переходит в растворенное состояние, свойства теста ухудшаются: оно становится жидким и липким. Набухание в этом случае переходит в неограниченное, что соответствует кривой 2 на рис. 19.4. Сплошная линия кривой 2 и максимум на ней характеризуют состояние ВМС в виде студня, а пунктирная — в виде раствора.
В результате ограниченного набухания белков муки образуется эластичное и плотное по консистенции тесто. Когда часть белков переходит в растворенное состояние, свойства теста ухудшаются: оно становится жидким и липким. Набухание в этом случае переходит в неограниченное, что соответствует кривой 2 на рис. 19.4. Сплошная линия кривой 2 и максимум на ней характеризуют состояние ВМС в виде студня, а пунктирная — в виде раствора.
Набухание сопровождает жизнедеятельность всех растительных и животных организмов. Почки человека помимо основной функции (выведение из организма продуктов обмена) осуществляют регулирование воды, а их соединительная ткань служит индикатором водного обмена между кровью и клетками. Вследствие набухания соединительная ткань способна воспринимать излишек воды и отдавать его клеткам или направлять в кровь.
Процесс набухания избирателен в зависимости от природы ВМС и растворителя. Ограниченное набухание имеет место при взаимодействии полярного ВМС с полярным холодным растворителем (например, белка с водой) или неполярного ВМС с неполярной холодной жидкостью (например, каучука с бензолом). Вид набухания, а также его скорость определяются температурой растворителя.
Для одного и того же ВМС и растворителя можно наблюдать одновременно ограниченное и неограниченное (растворение) набухание. Часть крахмала (10—20%) после обработки теплой водой растворяется (неограниченное набухание), а большая часть его нерастворима и способна к ограниченному набуханию. В свежем хлебе содержится до 5,5%, а в черством — до 4,5% водорастворимых ВМС, способных к неограниченному набуханию.
Изменение степени набухания с течением времени определяет скорость набухания v н, которая выражается следующим образом:
 (19.19)
(19.19)
Кинетика набухания, т.е. изменение скорости набухания во времени, идет по механизму реакции первого порядка. В связи с этим скорость набухания можно представить в следующем виде:
 (19.20)
(19.20)
где k н— константа скорости набухания: τ — время набухания; ατ— степень набухания за время τ; α¥ — предельная степень набухания.
Из формулы (19.20) путем ее интегрирования можно определить константу скорости набухания, которая по аналогии с константой скорости реакции первого порядка будет иметь вид
 (19.21)
(19.21)
Константа скорости набухания k ни степень набухания ατ характеризуют кинетику процесса, а степень предельного набухания α¥ — его конечный результат.
Набухание протекает в несколько стадий, которые в случае полярного растворителя представлены на рис. 19.5. Первая стадия (см. рис. 19.5, а) связана с диффузией молекул растворителя в макромолекулы ВМС, сольватацией этих молекул, а также с разрывом слабых связей между макромолекулами. В результате этой стадии полярные молекулы растворителя 1 образуют сольватный 2, а в случае воды — гидратный слой. Вследствие сольватации и отталкивания одноименных зарядов сольватных слоев рвется слабая связь 3 между звеньями макромолекул.

 На второй стадии происходит диффузия самих макромолекул или их звеньев в раствор. В результате разрыва слабых связей макромолекулы приобретают способность диффундировать в раствор. Направление диффузии на рис. 19.5, б показано стрелками.
На второй стадии происходит диффузия самих макромолекул или их звеньев в раствор. В результате разрыва слабых связей макромолекулы приобретают способность диффундировать в раствор. Направление диффузии на рис. 19.5, б показано стрелками.
Набухание — типичное коллоидно-химическое явление. Оно происходит с выделением теплоты. Это непосредственно следует из основных термодинамических представлений об открытых системах, для которых характерно соотношение (10.21). На первой стадии процесса энтропия системы практически не изменяется. По этой причине снижение энергии Гиббса в самопроизвольном процессе, к которому относится набухание, произойдет за счет уменьшения энтальпии. Уменьшение энтальпии для изобарно-изотермического процесса означает выделение теплоты, т.е. набухание является экзотермическим процессом. В результате ослабления связи между макромолекулами на второй стадии набухания беспорядок увеличивается, а это приводит к росту энтропии; в соответствии с условиями (10.21), когда d G < 0.
Тепловой эффект, который сопутствует набуханию, называют теплотой набухания. Выделение теплоты происходит на первой стадии процесса набухания при сольватации молекул растворителя. Диффузия звеньев макромолекул, т.е. вторая стадия набухания, обусловлена энтропийным фактором.
Различают интегральную и дифференциальную теплоту набухания. Интегральная теплота набухания — это количество теплоты, которое выделяется в течение всего процесса набухания при поглощении единицей массы сухого вещества определенной массы жидкости. Ее можно определить при помощи следующей эмпирической формулы
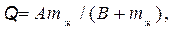 (19.22)
(19.22)
где А, В — опытные коэффициенты; m ж— масса жидкости в набухшем ВМС.
Интегральная теплота набухания может быть значительной. Так, при набухании 1 кг сухого желатина может выделяться 27,9 кДж, а при набухании 1 кг крахмала — 32,3 кДж.
В результате дифференцирования интегральной теплоты набухания Q по m жполучают дифференциальную теплоту набухания. Она показывает количество теплоты, которое выделяется на любой стадии процесса набухания при поглощении единицы (1 кг) жидкости:
 (19.23)
(19.23)
Обычно экспериментально определяют интегральную теплоту набухания. Затем по уравнению (19.23) рассчитывают дифференциальную теплоту набухания.
Набухание сопровождается увеличением объема BMС. Если исходная масса вещества заключена в определенную емкость, то в процессе набухания за счет увеличения объема вещества возникает давление набухания (до 107Па).
Давление набухания можно вычислить по следующей формуле:

где k — коэффициент, зависящий от природы ВМС, растворителя и температуры; m 0— содержание сухого вещества в набухшем студне; α — коэффициент, значение которого близко к 3.
Дата добавления: 2015-12-21; просмотров: 26; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
