Стабилизация электролитами
Рассмотрим на примере реакций образования нерастворимого в воде электролита, каким образом можно получить устойчивый к агрегации лиофобный золь. Два необходимых условия (низкое значение ПР электролита и пересыщение исходного реакционного раствора в отношении вещества твердой фазы, т.е. ПК > ПР) были обоснованы в параграфе 2.1. Однако этих условий не достаточно для получения коллоидной системы.
Если исходные реагенты были взяты в соотношениях, отвечающих коэффициентам в уравнении реакции (в стехиометрических соотношениях), то даже при выполнении условия ПК > ПР получить коллоидную систему невозможно.
Дело в том, что в этом случае по окончании реакции дисперсионная среда (раствор) практически не будет содержать ионы, образующие вещество дисперсной фазы (только в концентрациях, соответствующих ПР), т.е. одноименные ионы.
С другой стороны, именно такие ионы (близкие по строению к дисперсной фазе) должны наиболее заметно адсорбироваться из раствора на твердой поверхности частиц (см. часть 1). Адсорбция одноименных ионов (т.е. ионов, входящих в вещество дисперсной фазы) должна приводить к появлению избыточного поверхностного заряда на образующихся частицах и формированию двойного электрического слоя (ДЭС) у их поверхности.
Образование ДЭС – это важный фактор стабилизации лиофобного золя, снижающий удельную свободную поверхностную энергию (σт/ж, Дж/м2) на границе частицы электролита – водный раствор. Одноименный заряд частиц вызывает их отталкивание друг от друга по закону Кулона при сближении и препятствует слипанию (коагуляции) и укрупнению. Это явление можно назвать зарядовой стабилизацией лиофобных золей.
|
|
|
Поэтому третье условие (необходимое и достаточное) для получения лиофобного золя твердого электролита в водной среде – значительный избыток одного из исходных реагентов по сравнению со стехиометрией реакции.
Элементарная коллоидная частица в лиофобных системах тоже называется мицеллой (как и в лиофильных системах, см. параграф 2.1 ). Рассмотрим подробнее происхождение заряда на коллоидных частицах при получении лиофобного золя на примере обменной реакции в растворе двух солей, одна из которых взята в избытке:
AgNO3 (избыток) + KI 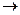 AgI
AgI  + KNO3.
+ KNO3.
Избыток AgNO3 (вещество А) в соответствии с законом эквивалентов [2] означает, что сэкв(А)∙VA > cэкв(Б)∙VБ (вещество Б – KI), где сэкв (моль экв/л) – молярные концентрации эквивалентов А и Б, V – объемы растворов А и Б, взятые для реакции.
Веществом дисперсной фазы в этом случае служит нерастворимая соль AgI(см. таблицы растворимости и ПР [2]). Агрегат из n молекул AgI образует ядро частицы твердой фазы. При избытке AgNO3 в дисперсионной среде (водном растворе) после окончания реакции имеются ионы Ag+, NO3-, K+.
|
|
|
На поверхности твердой частицы (ядра мицеллы) могут адсорбироваться ионы, входящие в состав вещества дисперсной фазы (одноименные ионы), т.е. либо Ag+, либо ионы I-. В рассматриваемом случае (избыток AgNO3) на поверхности ядра адсорбируются ионы Ag+ в количестве х. Эти ионы сообщают положительный заряд частице и называются потенциалопределяющими ионами в образующемся двойном электрическом слое – ДЭС (образование ДЭС у поверхности металлической фазы рассмотрено в части 1 “Физическая химия”). Схема строения мицеллы лиофобного золя, стабилизированного электролитом, приведена на рис. 2.5.
Оставшиеся в растворе ионы противоположного знака (в данном случае анионы NO3-) частично притягиваются к положительно заряженной твердой частице и являются противоионами адсорбционной части ДЭС. Большая часть противоионов остается свободной и входит в диффузную часть ДЭС. Частица твердой фазы вместе с ДЭС образует электронейтральную (незаряженную) мицеллу лиофобного золя.
Ионы адсорбционного слоя










 Частица (гранула)
Частица (гранула)




 Мицелла
Мицелла
Рис. 2.5. Схема строения мицеллы золя иодида серебра,
|
|
|
полученного по реакции AgNO3 + KI при избытке AgNO3
Заряд коллоидных частиц AgI можно изменить на противоположный. Например, если эту же реакцию проводить при избытке KI (т.е. при условии сэкв(Б)∙VБ > cэкв(А)∙VA), то частицы золя будут заряжены отрицательно, и мицелла золя будет иметь строение в соответствии со схемой на рис. 2.6.
Заряд коллоидной частицы в первом случае (рис. 2.5) положительный и равен +(х - y). В электрическом поле постоянного тока (при электрофорезе) положительно заряженные частицы золя будут двигаться к отрицательному электроду (катоду), а противоионы диффузного слоя (анионы NO3- ) - к положительному электроду, аноду.
Во втором случае (рис. 2.6) заряд частицы золя отрицательный и равен -(x – y). При электрофорезе наблюдается обратная картина – отрицательно заряженные частицы движутся к положительному электроду (аноду), а противоионы диффузного слоя (катионы K+ ) – к отрицательному (катоду).
Следовательно, зная условия получения лиофобного золя в водном растворе электролитов, легко понять строение его мицелл, определить знак заряда частиц и противоионов диффузного слоя, а также предсказать поведение золя в электрическом поле. И наоборот, из поведения золя при электрофорезе можно определить заряд частиц (и соответственно – противоионов) и понять, в каких условиях (при избытке какого из реагентов) был получен этот золь.
|
|
|
Ионы адсорбционного слоя

 |  | ||||
 | |||||






 Частица (гранула)
Частица (гранула)
Мицелла
Рис. 2.6. Схема строения мицеллы золя иодида серебра,
полученного по реакции AgNO3 + KI при избытке KI
Таким образом, роль стабилизатора лиофобного золя, полученного в результате реакций в растворах электролитов, выполняют ионы электролита, присутствующего в избытке, и одноименные с ионами в составе частиц.
Дата добавления: 2015-12-21; просмотров: 18; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
