Пантотеновая кислота

Пантотеновая кислота по хим. св-вам - типичный представитель гидрокси-кислот, может образовывать разл. производные как по карбоксильной группе (сложные эфиры, амиды, хлорангид-рид, азид, соли), так и по гидроксильной группе (сложные и простые эфиры).
Витамин синтезируется зелеными растениями, микроорганизмами, в т.ч. микрофлорой млекопитающих (авитаминозы, связанные с отсутствием пантотеновой кислоты, у человека поэтому обычно не наблюдаются). Особенно богаты пантотеновой кислотой печень (7-11 мг в 100 г) и почки (3,4-4,7 мг) высших животных, эмбриональные клетки (желток 2,7-7,0 мг), злаки (1,0-2,6 мг). В процессе хранения продуктов и их обработки потери витамина составляют 25-50%. Потребность в пантотеновой кислоте у высших животных составляет 0,1-2,5 мг/кг массы. Признаки дефицита пантотеновой кислоты у человека неспецифичны. У животных отмечается задержка роста, дерматит, выпадение шерсти, поражение желудочно-кишечного тракта, адреналовой системы (вырабатывает и выделяет в кровь катехолами-ны) и др.
Пантотеновая кислота в виде КоА участвует в углеводном и жировом обмене, в синтезе ацетилхолина, в коре надпочечников стимулирует образование кортикостероидов.
• Пируват входит в органический состав слюны. Полоскание полости рта чаем, содовым раствором или чистка зубов щеткой позволяют существенно снизить концентрацию глюкозы и ее метаболитов (пирувата, лактата и др.) в смешанной слюне человека после приема сладостей.
21. Особенности синтеза коллагена. Внутри- и внеклеточные этапы процесса образования «зрелого» коллагена, строение сшивок, центры минерализации. Участие витамина С в синтезе коллагена и другие биохимические функции аскорбата, суточная потребность и признаки недостаточности. Биохимические маркеры синтеза и распада коллагена.Синтез коллагена
На примере коллагена –I: характерен для кости, является основным белком дентина. (закрепляем материал по посттрансляционному процессингу белка и микросомальному окислению)
Коллаген синтезируется в фибробластах в виде высокомолекулярного предшественника – проколлагена.
На этапах синтеза коллагена после включения пролина и лизина в полипептидную цепь происходит их гидроксилирование (специфично для молекулы коллагена). Образование гидроксипролила и гидроксилизила катализируют железосодержащие ферменты — пролингидроксилаза и лизингидроксилаза, их кофактор — аскорбиновая кислота. Гидроксилирование аминокислот является диоксигеназной реакцией, т.е. молекула кислорода одновременно окисляет два субстрата (аминокислоту и a-кетоглутарат):
 |
В результате реакции образуются оксипролин и сукцинат (в молекулу которого включён второй атом кислорода из молекулы О2) и выделяется СО2. Реакция высокоспецифична – остатки пролина и лизина подвергаются гидроксилированию, если они расположены со стороны аминогруппы глицинового остатка. Аскорбиновая кислота работает как восстановительный агент, благодаря которому железо в активном центре фермента сохраняется в форме Fe2+. При недостатке витамина С синтез коллагена нарушается, возникает непрочность коллагеновых волокон, кровоточивость десен, расшатывание зубов (проявления цинги). Расшатывание зубов обусловлено, главным образом, недогидроксилированием вновь синтезированного коллагена периодонтальной связки. Такой коллаген плохо агрегирует.
К остаткам гидроксилизина под действием сначала галактозилтрансферазы, затем глюкозилтрансферазы присоединяются углеводные единицы (в основном остается одна галактоза или дисахарид, состоящий из галактозы и глюкозы).
Гидроксилирование и трансферазная реакция происходят во вновь синтезированном коллагене, ещё не претерпевшем спирализации в просвете эндоплазматического ретикулюма. Затем каждая про-a-цепь с помощью водородных связей объединяется с двумя другими в молекулу проколлагена, которая секретируется в межклеточный матрикс.
• Проколлаген имеет более длинные цепи, чем тропоколлаген. Дополнительные концевые фрагменты не образуют обычную трехцепочечную спираль, а объединяются друг с другом в глобулярные домены, структура которых совершенно не похожа на уникальную линейную структуру зрелого коллагена. Это препятствует агрегации и образованию фибрилл внутриклеточно, что было бы фатальным для клетки.
Вне клетки протеолитические ферменты последовательно удаляют оба домена – N-концевой и С-концевой (маркёры синтеза коллагена).
После того как во внеклеточном пространстве сформировались коллагеновые фибрилы, их прочность существенно увеличивается, так как образуются ковалентные сшивки между остатками лизина внутри и между молекулами тропоколлагена, укрепляя четвертичную структуру.
Сшивки создаются в несколько этапов.
I этап. Вначале некоторые остатки лизина и гидроксилизина дезаминируются лизилоксидазой с образованием альдегидных групп, обладающих высокой реакционной способностью. Затем эти группы самопроизвольно реагируют с образованием ковалентных связей друг с другом или с другими остатками лизина или гидроксилизина.

II этап. Альдегидные группы самопроизвольно взаимодействуют друг с другом, образуя альдольные поперечные связи коллагена, или реагируют с аминогруппой остатков лизина или 5-гидроксилизина (рис. А), обеспечивая образование бифункциональных ковалентных сшивок между соседними молекулами тропоколлагена.
 РИС А
РИС А
Если в реакции участвует аллизин, то она протекает по механизму альдиминной конденсации. При этом по иминной связи промежуточного соединения присоединяются 2 атома Н. В результате образуются сшивки с группировкой -NH- в середине – лизиннорлейцин или гидроксилизиннорлейцин (рис. А).
Присутствие гидроксильной группы в 5 положении гидроксиаллизина предопределяет течение реакции по механизму кетоиминной конденсации (рис Б). В этом случае в цепи получившейся поперечной сшивки лизино-5-кетонорлейцина или гидроксилизино-5-кетонорлейцина вместе с группировкой -NH- присутствует кето-группа.
Цепочки таких перемычек достаточно длинные, чтобы иметь некоторую гибкость, а ковалентное соединение атомов придаёт им высокую прочность и закрепляет регулярную структуру микрофибрилл коллагена.
Поперечные бифункциональные сшивки имеют свой вариант упорядоченности: каждый концевой телопептид тропоколлагена соединён перемычкой с расположенным на том же уровне участком смежной молекулы (рис. 9). Подобная локализация и прочность сшивок позволяет обнаружить их в составе N- и C-телопептидов, отщепляемых при распаде коллагена (для идентификации таких специфичных фрагментов разработаны методы, основанные на иммуноферментном анализе).
 РИС Б
РИС Б
Бифункциональные связки наиболее присущи фибриллообразующим коллагенам типа I, II и III, причём в зависимости от вида ткани преобладает какой-либо определённый вид сшивки.
III этап. По мере созревания ткани возникают перемычки и между микрофибриллами. В бифункциональных сшивках сохраняются реакционноспособные атомы, которые постепенно вступают в реакции дополнительной конденсации с образованием трифункциональных сшивок, имеющих в центре гетероцикл – пиридиниевое или пиррольное кольцо (рис. В, Г). Эти процессы протекают также неферментативно путём спонтанного взаимодействия кетоиминной двойной сшивки одной микрофибриллы с альдегидным радикалом, расположенным в телопептидной части другой микрофибриллы.
Если в реакции участвуют 5-гидроксиаллизин и уже сформированная сшивка гидроксилизино-5-кетонорлейцина, то продуктом становится гидроксилизил-пиридинолин (рис. В). Это главная трифункциональная сшивка коллагенов большинства тканей. В минерализуемых тканях (кость, дентин зуба) число пиридиниевых сшивок в 5-10 раз меньше, чем в хряще и сухожилиях, причём чаще всего здесь встречается лизил-пиридинолин – вариант с негидроксилированной цепочкой в перемычке, образованной с участием лизино-5-кетонорлейцина.
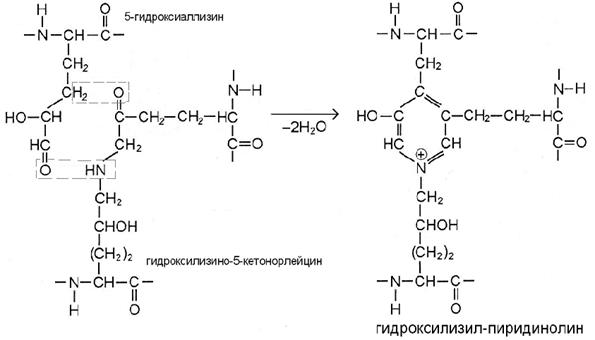 В
В
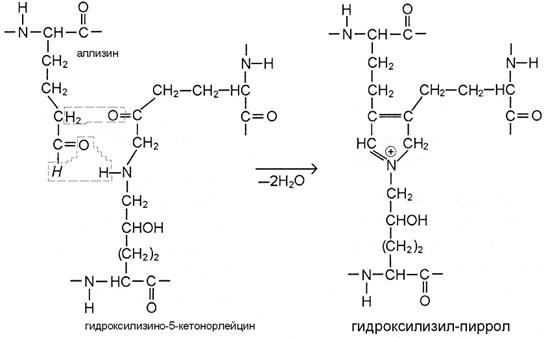 Г
Г
Более того, для минерализованных тканей (кость, ткани зуба) характерны сшивки пиррольного типа, которые образует негидроксилированный аллизин, соединяясь с бифункциональной сшивкой гидроксилизино-5-кетонорлейцином (рис. Г). Из всех трифункциональных перемычек именно гидроксилизилпиррол специфичен для минерализуемых тканей. Дополнительные перемычки циклического характера увеличивают прочность коллагена.
Образование разнообразных сшивок обеспечивает механическую прочность волокон коллагена. Остатки лизина и 5-гидроксилизина подвергаются окислению постепенно, поэтому количество поперечных связей между отдельными молекулами тропоколлагена, соседними микрофибриллами и пучками волокон с течением времени увеличивается, прочность коллагена возрастает: идёт процесс его «созревания».
Учитывая роль ЛИЗ в организации различных вариантов ковалентных сшивок в коллагеновой матрице костной ткани, зубного дентина и цемента становится понятной материальная основа применения лизина как средства, предотвращающего заболевания зубов.
БИОХИМИЧЕСКИЕ МАРКЁРЫ МЕТАБОЛИЗМА КОСТНОЙ ТКАНИ
Биохимические маркеры дают информацию о патогенезе заболеваний скелета и о скорости ремоделирования. Они могут использоваться для контроля эффективности лечения в короткие сроки и идентифицировать больных с быстрой потерей костной массы. Биохимические маркеры измеряют усредненную скорость ремоделирования всего скелета, а не отдельных его областей. Различают биохимические маркеры формирования и резорбции кости, характеризующие функции остеобластов и остеокластов.
| Образование | Резорбция |
| сыворотка: остеокальцин, общая и специфическая костная щелочная фосфатаза, проколлагеновые С- и N-пептиды | плазма: тартрат-резистентная кислая фосфатаза, пиридинолин и дезоксипиридинолин, продукты деградации коллагена I типа (N- и С-телопептиды); моча:пиридинолин и дезоксипиридинолин, продукты деградации коллагена I типа – N- и С-телопептиды, кальций и гидроксипролин натощак и гликозиды гидроксилизина |
Дата добавления: 2015-12-20; просмотров: 30; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
