Приложение 2. Физические константы
| Константа | Величина в единицах СИ | |
| Скорость света в вакууме, c 0 | 2.99792×108 | м/с |
| Диэлектрическая проницаемость вакуума*, e0 [e0 = (m0 с0 2)–1] | 8.85419×10–12 | Ф/м |
| Больцмана постоянная, k B | 1.38066×10–23 | Дж/К |
| Aвогадро постоянная, N A | 6.02214×1023 | моль–1 |
| Газовая постоянная, R (R = N A× k B) | 8.31447 | Дж/(моль×К) |
| Атомная единица массы (а.е.м. или дальтон**), u (u = 10–3 кг×моль–1/ NA) | 1.66054×10–27 | кг |
| Элементарный заряд, e | 1.60218×10–19 | Кл |
| Фарадея постоянная, F (F = N A×e) | 9.64853×104 | Кл/моль |
| Нормальное давление, p 0 | 1.01325×105 | Па |
| Молярный объём идеального газа при н.у., V M 0 (V M 0 = RT 0/ p 0) | 2.24140×10–2 | м3/моль |
| Стандартное гравитационное ускорение, g | 9.80665 | м/с2 |
* другое наименование этой константы – электрическая постоянная
** наименование "дальтон" не соответствует СИ, но оно часто применяется в химии полимеров и биохимии
| Периодическая таблица элементов (таблица Менделеева) | He 4.003 | Ne 20.18 | Ar 39.95 | Kr 83.80 | Xe 131.3 | Rn (222) | Lu 175.0 | Lr (262) | ||
| F 19.00 | Cl 35.45 | Br 79.90 | I 126.9 | At (210) | Yb 173.0 | No (259) | ||||
| O 16.00 | S 32.07 | Se 78.96 | Te 127.6 | Po (209) | Tm 168.9 | Md (258) | ||||
| N 14.01 | P 30.97 | As 74.92 | Sb 121.8 | Bi 209.0 | Er 167.3 | Fm (257) | ||||
| C 12.01 | Si 28.09 | Ge 72.59 | Sn 118.7 | Pb 207.2 | Ho 164.9 | Es (252) | ||||
| B 10.81 | Al 26.98 | Ga 69.72 | In 114.8 | Tl 204.4 | Dy 162.5 | Cf (251) | ||||
| Zn 65.39 | Cd 112.4 | Hg 200.6 | Tb 158.9 | Bk (247) | ||||||
| Cu 63.55 | Ag 107.9 | Au 197.0 | Gd 157.3 | Cm (247) | ||||||
| Ni 58.69 | Pd 106.4 | Pt 195.1 | Eu 152.0 | Am (243) | ||||||
| Co 58.93 | Rh 102.9 | Ir 192.2 | Sm 150.4 | Pu (244) | ||||||
| Fe 55.85 | Ru 101.1 | Os 190.2 | Pm (145) | Np (237) | ||||||
| Mn 54.94 | Tc (98) | Re 186.2 | Nd 144.2 | U 238.0 | ||||||
| атомный номер символ элемента относительная атомная масса | Cr 52.00 | Mo 95.94 | W 183.9 | (263) | Pr 140.9 | Pa (231) | ||||
| V 50.94 | Nb 92.91 | Ta 180.9 | (262) | Ce 140.1 | Th 232.0 | |||||
| Ti 47.88 | Zr 91.22 | Hf 178.5 | (261) | *Лантаниды | **Актиниды | |||||
| Sc 44.96 | Y 88.91 | La* 138.9 | Ac** (227) | |||||||
| Be 9.012 | Mg 24.31 | Ca 40.08 | Sr 87.62 | Ba 137.3 | Ra (226.0) | |||||
| H 1.008 | Li 6.941 | Na 22.99 | K 39.10 | Rb 85.47 | Cs 132.9 | Fr (223) |
|
|
|
Приложение 3. Уравнения коллоидной химии
В настоящем разделе приводятся основные уравнения коллоидной химии. Этот список охватывает не все уравнения, входящие в программу, но только те, знание которых требуется для решения контрольных задач.
Необходимость этого списка объясняется тем, что многие уравнения, особенно эмпирические, могут записываться в разных формах и с разными обозначениями. Это имеет прямое отношение к формулировке задач. Например, для эмпирического уравнения Шишковского можно найти несколько форм записи в разных источниках. В разных формах записи численные значения констант уравнения могут иметь разные значения и разные единицы измерения. Поэтому, прежде чем решать задачу с константами Шишковского А и В или а и b, данными в условии, следует обратиться к этому списку и уточнить, к какой форме записи они относятся.
|
|
|
Тема: капиллярные явления, смачивание и общие вопросы
Среднечисловой радиус:  ,
,
где ni – число молей или число частиц с радиусом ri.
Среднеповерхностный радиус (радиус эквивалентной сферы):
 или
или  ,
,
где `S – средняя площадь поверхности сферической частицы, S – площадь поверхности частицы, рассматриваемой как сферическая.
Среднеобъёмный радиус (радиус эквивалентной сферы):
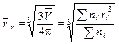 или
или  ,
,
где `V – средний объём сферической частицы, V – объём частицы, рассматриваемой как сферическая.
Среднечисловая молярная масса:
 ,
,
где Мi – молярная масса частицы i.
Средневесовая (среднемассовая) молярная масса:
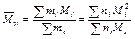 ,
,
где mi – масса частицы i.
z-Средняя молярная масса:
|
|
|
 .
.
Связь удельной поверхностной энергии G S с поверхностным натяжением s:
G S = G избыт/ S = s + Sm iGi
То же, в отсутствии адсорбции: G S = G избыт/ S = s.
Связь работы адгезии с углом смачивания q:
W S = W / S = sЖГ(1 + cosq).
где sЖГ – поверхностное натяжение на границе жидкость/газ.
Разность давлений с двух сторон искривленной поверхности (уравнение Лапласа):
D р = 2s / r K
где r K - радиус кривизны поверхности (положительная величина для выпуклых поверхностей и отрицательная для вогнутых).
Высота поднятия (или опускания) жидкости в капилляре (уравнение Жюрена):
 ,
,
где Dr - разность плотностей жидкости и газа (или второй жидкости)
Объёмная скорость течения жидкости через трубку с внутренним радиусом r и длиной l (r << l) (уравнение Пуазейля):
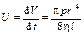 .
.
Зависимость давления насыщенного пара от кривизны поверхности жидкости (уравнение Кельвина):
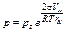
где рS – давление насыщенного пара над плоской поверхностью, r K – радиус кривизны, V M – молярный объем жидкости.
Зависимость растворимости от кривизны поверхности частиц твёрдой (или жидкой) фазы (уравнение Оствальда-Фрёйндлиха):

где СS – растворимость (концентрация насыщения) грубодисперсных частиц.
|
|
|
Дата добавления: 2015-12-18; просмотров: 19; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
