Концентрационная коагуляция
Концентрационная коагуляция происходит под действием индифферентных электролитов, при этом потеря устойчивости вызывается сжатием диффузионной части ДЭС и снижением  потенциала за счет подавления диффузии и перемещения ионов из диффузионного в адсорбционный слой, при неизменном потенциале ядра.
потенциала за счет подавления диффузии и перемещения ионов из диффузионного в адсорбционный слой, при неизменном потенциале ядра.
Например, концентрационную коагуляцию положительного золя хлорида серебра будет вызывать индифферентный электролит KNO3.

 При
При  система устойчива: силы электростатического отталкивания преобладают над силами притяжения (рис. 49). Зависимость скорости коагуляции
система устойчива: силы электростатического отталкивания преобладают над силами притяжения (рис. 49). Зависимость скорости коагуляции  от концентрации электролита представлена на рис. 50. Как видно, на участке I коагуляции не наблюдается и скорость ее равна нулю (зона устойчивости).
от концентрации электролита представлена на рис. 50. Как видно, на участке I коагуляции не наблюдается и скорость ее равна нулю (зона устойчивости).
 При снижении
При снижении  потенциала до критического значения
потенциала до критического значения  происходит ослабление сил электростатического отталкивания. В результате частицы подходят друг к другу на более близкое расстояние и за счет сил межмолекулярного притяжения слипаются. Начинается медленная коагуляция (участок II). Скорость медленной коагуляции зависит от концентрации электролита. Чем выше концентрация электролита, тем меньше
происходит ослабление сил электростатического отталкивания. В результате частицы подходят друг к другу на более близкое расстояние и за счет сил межмолекулярного притяжения слипаются. Начинается медленная коагуляция (участок II). Скорость медленной коагуляции зависит от концентрации электролита. Чем выше концентрация электролита, тем меньше  потенциал и больше скорость коагуляции.
потенциал и больше скорость коагуляции.
При достижении изоэлектрической точки ( ) скорость коагуляции перестает зависеть от концентрации электролита (участок III). Начинается быстрая коагуляция. Минимальную концентрацию электролита, при которой начинается быстрая (видимая) коагуляция (
) скорость коагуляции перестает зависеть от концентрации электролита (участок III). Начинается быстрая коагуляция. Минимальную концентрацию электролита, при которой начинается быстрая (видимая) коагуляция ( ), называют порогом коагуляции
), называют порогом коагуляции  .
.
|
|
|
Величину, обратную порогу коагуляции называют коагулирующей способностью. Коагулирующая способность  – это объем золя, который коагулирует под действием 1 моль электролита:
– это объем золя, который коагулирует под действием 1 моль электролита:
 . (55)
. (55)
Чем меньше порог коагуляции, тем выше коагулирующая способность электролита.
Коагулирующим действием обладает не весь электролит, а только тот ион, заряд которого совпадает по знаку с зарядом противоиона мицеллы гидрофобного золя. Этот ион называют ионом-коагулятором.
Концентрационная коагуляция электролитами подчиняется нескольким эмпирическим правилам.
1. Коагулирующая способность иона-коагулятора тем больше, чем больше его заряд  (первое правило Шульце-Гарди):
(первое правило Шульце-Гарди):
 , (56)
, (56)
где  – постоянная для данной системы величина: при
– постоянная для данной системы величина: при  ,
, 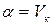 .
.
2. При одинаковом заряде коагулирующая способность иона тем выше, чем больше его кристаллический радиус (второе правило Шульце-Гарди). В соответствии с этим правилом коагулирующая способность иона определяется его положением в лиотропном ряду (см. п. «Ионная адсорбция»).
Дата добавления: 2015-12-18; просмотров: 26; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
