Определение критической концентрации мицеллообразования
Коллоидного ПАВ
Цель работы: Определение ККМ коллоидного ПАВ по изотерме поверхностного натяжения.
Краткое теоретическое введение
Вещества, способные при растворении уменьшать поверхностное натяжение раствора, называются поверхностно активными веществами (ПАВ). К их числу относятся химические соединения, молекулы которых содержат по крайней мере одну полярную группу (–SO3Na, ºCOOH, –COONa, –N(CH3)3Cl, –COOH др.) и неполярный углеводородный радикал. Такие молекулы называются дифильными и изображаются схематически "кружком", который символизирует гидрофильную группу атомов, и длинной волнистой или прямой линией, означающей углеводородный радикал. Если полярная часть молекулы диссоциирует в водном растворе, то ПАВ называется ионогенным, если нет – то неионогенным. ПАВ, молекулы которых имеют достаточно протяжённую углеводородную цепь (более 8 атомов углерода) и хорошо гидратирующуюся полярную группу, называются коллоидными. При малых концентрациях (менее приблизительно 10–4 моль/л) растворы таких веществ являются молекулярно-дисперсными и обладают значительной поверхностной активностью. Повышение концентрации сверх некоторой, называемой критической концентрацией мицеллообразования (ККМ), приводит к образованию мицелл – агрегатов, состоящих из нескольких десятков молекул ПАВ, находящихся в равновесии с молекулярным раствором. При данных условиях (температура, рН раствора, ионная сила и др.) коллоидному ПАВ присуще вполне определённое значение ККМ, являющееся важнейшей его характеристикой.
|
|
|
Коллоидные ПАВ имеют большое практическое значение. Они используются, например, для стабилизации дисперсных систем, для модифицирования свойств поверхностей, то есть для их гидрофобизации или гидрофилизации, для понижения прочности при дроблении материалов, в качестве компонентов моющих средств, в качестве одной из главных частей смазочных материалов, и т.д.
 Механизм мицеллообразования близок к механизму адсорбции ПАВ: силы взаимодействия между молекулами воды больше, чем между молекулами воды и углеводородными радикалами ПАВ. Вследствие этого молекулы ПАВ выталкиваются из объёма раствора в поверхностный слой границы вода/воздух, где они получают располагаются так, что их углеводородные цепи контактируют с неполярной средой (воздухом), а полярные группы остаются в водном растворе (см. рис. 5.1). В этом заключается механизм адсорбции на границе водный раствор/воздух.
Механизм мицеллообразования близок к механизму адсорбции ПАВ: силы взаимодействия между молекулами воды больше, чем между молекулами воды и углеводородными радикалами ПАВ. Вследствие этого молекулы ПАВ выталкиваются из объёма раствора в поверхностный слой границы вода/воздух, где они получают располагаются так, что их углеводородные цепи контактируют с неполярной средой (воздухом), а полярные группы остаются в водном растворе (см. рис. 5.1). В этом заключается механизм адсорбции на границе водный раствор/воздух.
При повышении концентрации, дифильные молекулы стремятся к наиболее выгодной, с энергетической точки зрения, ориентации и обращаются своими неполярными углеводородными цепями друг к другу – возникают сферические мицеллы (рис. 5.2).
|
|
|
 |
С ростом концентрации ПАВ мицеллярная система проходит ряд равновесных состояний, различающихся по числам ассоциации, размерам и форме мицелл. При достижении определённой концентрации взаимодействие сферических мицелл приводит к их деформации.
При очень высоких концентрациях, молекулы ПАВ способны образовывать жидкокристаллические фазы. Мицеллообразование сопровождается увеличением вязкости системы вплоть до потери изотропной текучести и появления анизотропных свойств.
Изменение структуры раствора при ККМ приводит к резкому изменению его физико-химических свойств, включая оптические свойства, электропроводность и др. Поверхностное натяжение раствора постоянно уменьшается с увеличением концентрации ПАВ вплоть до точки ККМ, после чего оно остаётся постоянным (см. рис. 5.4 в конце описания). Это обстоятельство положено в основу экспериментального метода определения ККМ по измерению поверхностного натяжения как функции концентрации ПАВ.
Приборы и методы измерений
Вследствие того, что коллоидные растворы ПАВ сильно пенятся при механическом движении, определение поверхностного натяжения методом наибольшего давления пузырька (как в работе № 3) для них не возможно. Поэтому в данной работе используется сталагмометрический метод. Он заключается в измерении объёма или массы m капли, отрывающейся от конца вертикальной трубки с радиусом r после медленного вытекания из неё. Отрыв капли происходит в тот момент, когда её вес Р = mg становится равным силе поверхностного натяжения, действующей по окружности конца трубки. То есть, в момент отрыва капли Р = 2p rs.
|
|
|
В этом случае поверхностное натяжение исследуемого раствора можно вычислить по формуле:
 , (5.1)
, (5.1)
где s 0, – поверхностное натяжение растворителя (дистиллированной воды), Р 0 и m 0 – вес и масса одной её капли.
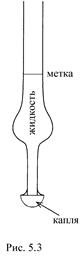 Сталагмометр представляет собой стеклянную трубку с резервуаром для жидкости. Трубка в нижней части сталагмометра имеет малый внутренний диаметр, но сравнительно большой внешний диаметр на нижнем конце, на который натекает капля и с которого она отрывается. Узкий внутренний диаметр определяет медленное (равновесное) натекание капли, а внешний диаметр – размер, который достигает капля перед отрывом от конца. Рис. 5.3 показывает схему сталагмометра с висящей каплей.
Сталагмометр представляет собой стеклянную трубку с резервуаром для жидкости. Трубка в нижней части сталагмометра имеет малый внутренний диаметр, но сравнительно большой внешний диаметр на нижнем конце, на который натекает капля и с которого она отрывается. Узкий внутренний диаметр определяет медленное (равновесное) натекание капли, а внешний диаметр – размер, который достигает капля перед отрывом от конца. Рис. 5.3 показывает схему сталагмометра с висящей каплей.
|
|
|
Для определения среднего веса капли, сталагмометр заполняют исследуемой жидкостью выше метки в верхней его части, и позволяют жидкости вытекать. Когда мениск жидкости опускается до верхней метки, начинают счёт капель, и заканчивают его, когда весь объём V сталагмометра опорожняется. Вес одной капли:
 , (5.2)
, (5.2)
где N – число капель, за которое опорожняется объём сталагмометра, r – плотность жидкости.
Сначала определяют среднюю массу m 0 капли жидкости с известным поверхностным натяжением и известной плотностью, например дистиллированной воды (при 20 °С s 0 = 72,75×10–3 Н/м, r = 1,00 г/см3). Далее определяют среднюю массу капли исследуемого раствора. Поверхностное натяжение раствора вычисляют по формуле 5.1.
Для получения правильных результатов, каждая капля в момент отрыва должна находиться в механическом равновесии со сталогмометром, а также в равновесии жидкость/пар с окружающим воздухом. Для обеспечения этого, скорость натекания и капания должна быть малой (не более одной капли в минуту). Если капание происходит быстрее, то скорость натекания снижают, регулируя давление в сталагмометре над уровнем жидкости. С этой целью, на верхний конец сталагмометра надевают резиновую трубку с винтовым зажимом или стеклянным краном.
Последовательность выполнения работы
1. Из исходного водного раствора олеата натрия (С17Н33СООNa) с концентрацией 1,00 г/л готовят серию разбавлений согласно табл. 5.1.
Таблица 5.1
| № раствора | |||||||
| Объём исходного раствора, мл | |||||||
| Объём добавляемой воды | |||||||
| концентрация c, г/л | 1,00 | 0,5 | 0,3 | 0,1 | 0,05 | 0,02 | 0,01 |
2. Последовательно определяют число капель дистиллированной воды, а затем растворов олеата натрия (начиная с малых концентраций), за которое вытекает объём V жидкости в сталагмометре. Каждый опыт по счёту числа капель повторяют 3 раза.
Обработка и оформление результатов
1. Полученные экспериментальные данные заносят в таблицу (см. табл. 5.2). Вычисляют поверхностное натяжение растворов по уравнениям 5.1 и 5.2, из которых следует:
 .
.
так как объём сталагмометра V во всех измерениях одинаков, а плотности r разбавленных водных растворов ПАВ практически равны плотности r 0 чистой воды (растворителя) при одной и той же температуре. (Поверхностное натяжение воды s 0 при комнатной температуре указано в табл. 5.2.)
 2. На миллиметровой бумаге строят график зависимости поверхностного натяжения s от логарифма концентрации lg c (рис. 5.4). Определяют логарифм ККМ олеата натрия по точке перегиба на кривой и вычисляют ККМ.
2. На миллиметровой бумаге строят график зависимости поверхностного натяжения s от логарифма концентрации lg c (рис. 5.4). Определяют логарифм ККМ олеата натрия по точке перегиба на кривой и вычисляют ККМ.
Таблица 5.2
| с, г/л | число капель, N | среднее число, N ср | s, мДж/м2 | ||
| 0(вода) | (N 0) | 72,8 | |||
Контрольные вопросы
1. Особенности коллоидных ПАВ, и их классификация.
2. Изобразите адсорбцию ПАВ на а) поверхности раствора ПАВ в органическом растворителе (масло) или неорганическом растворителе (сероуглерод) и б) поверхности водного раствора ПАВ.
3. Критическая концентрация мицеллообразования.
4. Изменение физико-химических и других свойств.
5. Моющее действие и моющие средства.
Литература
Зимон А.В., Балакирев А.А., Дехтяренко Н.Г., Бабак В.Г., Аксёнов В.Н. Коллоидная химия. Лабораторный практикум. Часть 1. М: ВЗИПП 1986, Лаб. работа 5.
Зимон А.Д. Коллоидная химия. М: Агар, 2007.
Воюцкий С.С. Курс коллоидной химии. М: Химия, 1975, Глава 13.
РАБОТА № 6
Дата добавления: 2015-12-18; просмотров: 27; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
