Математическая обработка результатов количественного анализа
Проводя анализ, нельзя рассчитывать получить истинное значение определяемой величины, и при попытке воспроизвести опыты всегда обнаруживаем разброс результатов. Поэтому необходимо как-то указать, насколько полученный результат может быть близким к истинному значению, т.е. указать, какова точность анализа. Ошибки количественного анализа, как и ошибки в определении любой измеряемой величины, можно разделить на два типа – систематические и случайные. Особо большие случайные ошибки, превосходящие некоторые определенные пределы, называют промахами. Грубые ошибки – промахи – связаны с неверными отсчетами, с неправильными записями или недостаточной точностью в работе. Результаты с грубыми ошибками при обработке экспериментальных данных обычно отбрасываются.
Ошибки, которые зависят от постоянных причин и повторяются при всех наблюдениях, называются систематическими. Эти ошибки могут зависеть, например, от точности калибрования мерной посуды (в титриметрических определениях) или разновесов (в гравиметрических измерениях), от неправильно составленной методики определения. Систематическая ошибка остается практически постоянной и одинаковой по знаку на протяжении всей данной серии определении. Для выявления систематических ошибок вещество надо проанализировать другим методом.
Случайные ошибки связаны с несовершенством органов чувств наблюдения, а также зависят от случайных помех. Эти ошибки всегда присутствуют в анализе, в каждом отдельном случае приводят к результатам и могут быть как положительные, так и отрицательные. Исключать их невозможно, но, применяя статистическую обработку результатов анализа, можно уменьшить их влияние на окончательный результат измерений. Систематические ошибки, которые можно обычно предусмотреть и устранить либо ввести соответствующие поправки, подразделяют на:
|
|
|
ошибки методические, зависящие от особенностей применяемого метода анализа, например, от не вполне количественного протекания реакции, на которой основано определение, от частичной растворимости примесей, от протекания наряду с основной реакцией каких-либо побочных, искажающих результаты титриметрических определений. Устранить такие ошибки трудно, и они составляют наиболее серьезную причину искажения результатов количественных определений;
ошибки оперативные, которые возникают от неправильного или недостаточно тщательного выполнения аналитических операций. Например, использование для промывания осадка недостаточного количества промывной жидкости ведет обычно к завышенным результатам, а излишнее промывание осадка – к систематическим потерям;
|
|
|
ошибки индивидуальные, зависящие от индивидуальных особенностей самого аналитика, например, его неспособности точно улавливать перемены окраски раствора при титровании.
Систематические ошибки не поддаются анализу методами математической статистики, поэтому на них лучше смотреть как на эффекты, которые необходимо выявить и устранить. Случайные же ошибки можно обнаружить путем повторных определений. При определении величины ошибки количественных определений пользуются понятиями абсолютной, относительной и квадратичной ошибок.
На правильность результатов анализа влияет точность измерений и вычислений. Измерения, проводимые в анализе, делятся на прямые, косвенные и совокупные. При прямых измерениях числовое значение измеряемой величины сразу получается из показаний прибора, например, по шкале бюретки. При косвенных измерениях находят сначала с помощью прямых измерений ряд вспомогательных величин, которые затем подставляют в известные аналитические формулы, определяющие искомую величину.
Совокупным называется измерение, при котором непосредственно наблюдаемая величина является функцией от определяемых неизвестных величин. Очевидно, что прямые измерения обладают большей точностью, чем косвенные и совокупные. Это обстоятельство следует также учитывать при оценке правильности результатов анализа. Задачей методов количественного определения является нахождение наиболее вероятного значения определяемой величины и оценка точности полученного результата.
|
|
|
Точность определения, выраженная в процентах от среднего значения  , называется относительной ошибкой прямого определения:
, называется относительной ошибкой прямого определения:
 (54)
(54)
При обработке результатов анализа величины, являющиеся грубыми ошибками, отбрасываются. При небольшом числе анализов их устанавливают при помощи критерия Q:
 , (55)
, (55)
где R – размах варьирования и равен xmax – xmin разница между двумя крайними значениями в ряду величин xi, расположенных в порядке возрастания; x1 – подозрительно выделяющееся значение; x2 – соседнее с ним значение.
Вычисленную величину Q сопоставляют с табличным значением Qα,n (табл.7). Наличие грубой ошибки доказывается, если Q> Qα,n.
Таблица 7
Критерий Q при P=0,95
| Число измерений n | ||||||||
| Qα,n | 0,94 | 0,77 | 0,64 | 0,56 | 0,51 | 0,48 | 0,44 | 0,42 |
Другим способом такой оценки является критерий  . Грубые ошибки отсутствуют, если отклонение от среднего
. Грубые ошибки отсутствуют, если отклонение от среднего 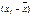 не выходит за пределы величины 3S.
не выходит за пределы величины 3S.
|
|
|
7.2. Влияние отдельных ошибок на конечный результат
Общая ошибка при анализе обычно складывается из нескольких частных ошибок. Для уменьшения ее следует найти оптимальные условия измерения, которые устанавливаются по законам распространения ошибок. При этом должны быть известны формулы, связывающие измеряемые величины и частные ошибки различных стадий измерения, предполагая, что все величины измерений не зависимы друг от друга. Суммарная ошибка измерения δу всегда больше, чем ошибка отдельного члена, следовательно, случайная ошибка результата увеличивается за счет суммарного действия нескольких содержащих ошибки некоррелированных частных значений. В аналитической химии при вычислении результатов анализа особенно часто приходится иметь дело с четырьмя основными видами уравнений.
| Расчетная формула | Общая ошибка |
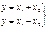
| 
|

| 
|
При возникновении ошибок всегда суммируются соответствующие дисперсии, причем при суммах или разностях складываются дисперсии абсолютных ошибок, а при произведениях или частных складываются дисперсии относительных ошибок. Поэтому при обсуждении ошибок суммы или разности предпочитают пользоваться абсолютной ошибкой, а при обсуждении ошибок произведения или частного – относительной ошибкой. Наиболее часто в количественном анализе имеют дело с разностью определяемых величин (например, при взвешивании). При этом нужно пользоваться абсолютной ошибкой, которая увеличивается незначительно и не зависит от величины разности. Однако полученную разность обычно подставляют в формулы, связанных с произведением или частным от деления величин. В таких случаях аналитика интересует относительная ошибка разности:
 (56)
(56)
Эта ошибка тем больше, чем меньше разность х1 – х2, а если х1 и х2 примерно равны, ошибка становится очень большой. Таких случаев нужно по возможности избегать.
7.3. Значащие цифры
Вычисление окончательных результатов анализа является столь же неотъемлемой составной частью, как и любая другая операция анализа. Было бы совершенно недопустимо достигнутую точность эксперимента свести к неточно проведенных вычислений. Однако не менее ошибочным было бы писать в полученном результате больше десятичных знаков, чем это соответствует действительной точности определения.
Результаты анализа следует выражать только значащими цифрами, которыми, по определению, являются все достоверно известные цифры данного числа плюс первая недостоверная цифра. Если конкретные данные отсутствуют, недостоверность цифры числа принимают равной ±1. Нули, стоящие слева, а также нули, стоящие справа, если они занимают собой неизвестные нам цифры или появляются в результате округления числа, являются незначащими цифрами. Незначащие нули в конце числа должны заменяться степенным членом (значащие цифры должны умножаться на 10п.
Допустим, имеется ряд чисел, каждое из которых содержат три значащие цифры: 0,004; 1,04; 104; 1,04∙104. Цифры 1 и 0, стоящие в середине, достоверны, а цифра 4 недостоверна, но не все они являются значащими. Необходимо обратить внимание, что степенной член не оказывает влияние на количество значащих цифр. Ноль, поставленный в начале числа 0,104, не является значащим, т.к. он показывает только место запятой в десятичной дроби. Так, массу образца можно выразить в граммах и миллиграммах (0,104 г или 104 мг), при этом недостоверность массы и количество значащих цифр остается неизменным. Недостоверность последней значащей цифры в выражении массы по-прежнему составляет ±0,001 г или ±1 мг. В числе 1,04∙104также три значащие цифры, но если это число записано в виде 10400, то значащими могут быть все пять цифр. От значащих цифр следует отличать десятичные знаки. Например, в числе 0,0035 имеется четыре десятичных знака и две значащие цифры, а в числе 10,0035 имеется также четыре десятичных знака при шести значащих цифрах. Числовые значения, с которыми имеют дело при анализе, могут иметь различную степень точности. Но точность результата вычислений, очевидно, не может быть большей, чем у наименее точного из чисел, входящих в вычисление. Поэтому для того, чтобы наиболее рационально провести вычисление, нужно, прежде всего, найти наименее точное из чисел и сообразно с этим установить, сколько десятичных знаков или значащих цифр должен содержать результат вычислений.
При сложении и вычитании количество десятичных знаков в результате вычислений обусловлено числом, имеющим наименьшее количество десятичных знаков и наибольшую недостоверность. Следовательно, при вычислении не имеет смысла учитывать все десятичные знаки отдельных слагаемых, а нужно их предварительно округлить или округлить полученный при расчетах результат. Так, например, необходимо сложить следующие значения масс: 4,3128;2,6; 0,081; 3,31. Наименее точным является число 2,6, у которого недостоверно уже число десятых долей грамма, следовательно, и у суммы всех указанных масс недостоверно будет число десятых долей грамма, поэтому до сложения нужно округлить остальные числа. При округлении чисел последнюю сохраняемую цифру увеличивают на единицу, если отбрасываемая цифра больше или равна 5; если отбрасываемая цифра меньше 5, то сохраняемая цифра остается без изменений. При округлении целесообразно оставлять одну запасную цифру (в нашем примере – второй десятичный знак, который затем в полученном результате отбрасывают). Проведем сложение: т=4,31+2,6+0,08+3,31=10,30 г. окончательно т = 10,3 г.
При умножении и делении наименее точным числом является то, которое содержит наименьшее количество значащих цифр. Такое же количество их следует оставлять и у результата вычислений, причем и в этих случаях целесообразно при округлении отдельных чисел сохранять одну запасную цифру, которую в конечном результате отбрасывают. Например, вычисляем процентное содержание металла в весовой форме при проведении анализа объекта металлургического производства гравиметрическим методом. При этом имеем следующие исходные данные для расчета: навеска образца т=0,0456 г, масса весовой формы а =0,1080 г, молекулярная масса М=191,412, атомная масса А=63,546. Наименее точным в данном случае является число 0,0456, содержащее три значащие цифры, в то время как у остальных чисел имеется (после округления до одной запасной цифры) не менее четырех значащих цифр. Значит, и у результата анализа должно быть три значащих цифры. Вычисление проводит по формуле:

Множитель 100, служащий для пересчета результата (%), является числом точным, и число значащих цифр его увеличивать не нужно. Округляя до трех значащих цифр, находим окончательный результат: ω = 78,6 %. В большинстве случаев получаемые при анализе экспериментальные данные (масса, объем) являются числами с четырьмя значащими цифрами, поэтому и результаты анализа содержат четыре значащие цифры.
Список литературы
1. Основы аналитической химии. В 2 кн. Кн.1. Общие вопросы. Методы разделения: Учеб. для вузов / Ю.А. Золотов, Е.Н. Дорохова, В.И. Фадеева и др. Под ред. Ю.А. Золотова. – М.: Высш. шк., 1996. – 383 с.
2. Основы аналитической химии. В 2 кн.Кнт.2. Методы химического анализа: Учеб. для вузов / Ю.А. Золотов, Е.Н. Дорохова, В.И. Фадеева и др. Под ред. Ю.А. Золотова. – М.: Высш. шк., 1996. – 461 с.
3. Аналитический контроль металлургического производства / Карпов Ю.А., Гимельфарб Ф.А., Савостин А.П., Сальников В.Д. – М.: Металлургия, 1995. – 400 c.
4. Карпов Ю.А., Савостин А.П., Глинская И.В. Методы пробоотбора и пробоподготовки: Курс лекций. – М.: МИСиС, 2001. – 230 с.
5. Отто М. Современные методы аналитической химии. В 2 т. Изд-во «Техносфера» Т. 1, 2004. – 416 с.
6. Отто М. Современные методы аналитической химии. В 2 т. Изд-во «Техносфера» Т. 2, 2004. – 281 с.
7. Новый справочник химика и технолога. Аналитическая химия. в 3 ч. Изд-во: «Профессионал», «Мир и семья», 2002.
Приложение 1
Общие правила техники безопасности
Запрещается находиться в лаборатории в верхней одежде, а также класть одежду и другие предметы на лабораторное оборудование, столы и другую мебель. Работу следует выполнять в специальном халате.
Во время работы в лаборатории запрещается:
· пить воду из лабораторной посуды;
· класть на лабораторные столы пищевые продукты и употреблять их в пищу;
· испытывать реактивы на вкус и запах;
Без разрешения лаборанта запрещается включать или выключать электроприборы. Химическая посуда для работы должна быть предварительно чисто вымыта. Для мытья посуды используют воду, а в ряде случаев технические кислоты, растворы щелочей или карбоната натрия, иногда сильно загрязненную посуду моют «хромовой смесью» (насыщенный раствор дихромата калия в концентрированной серной кислоте). При мытье пипеток и бюреток категорически запрещается засасывать ртом указанные растворы. Для этой цели пользуются резиновыми грушами или другими приспособлениями. При мытье посуды кислотами, щелочами и особенно «хромовой смесью» необходимо остерегаться попадания их на кожу лица, рук и одежду, во избежание ожогов.
Разлитые или рассыпанные на лабораторных столах реактивы, особенно концентрированные кислоты и щелочи, должны быть удалены, а соответствующее место тщательно вымыто водой. Залитое кислотой место должно быть предварительно нейтрализовано раствором карбоната или гидрокарбоната натрия. Кислота, попавшая на кожу рук, лица, а также на одежду должна быть тут же нейтрализована сухим гидрокарбонатом натрия, или его раствором, или разбавленным раствором аммиака, а затем смыта водой.
Все аналитические операции, связанные с растворением анализируемых материалов в кислотах, с выпариванием кислот и их растворов, с нейтрализацией соляно-кислых растворов водным раствором аммиака, и другие операции, вызывающие выделение вредных паров и газов (HCl, H2SO4, HF, HNO3, NO, NO2, N2O, SO2, AsH3), должны проводиться в вытяжном шкафу!
При разбавлении концентрированной серной кислоты водой необходимо кислоту приливать небольшими количествами в холодную воду (а не наоборот!) при перемешивании стеклянной палочкой. Нейтрализацию концентрированных кислот следует проводить (предварительно разбавив их дистиллированной водой) разбавленными растворами щелочей, аммиака и других оснований.
Перед нагреванием различных фильтратов их необходимо тщательно перемешать стеклянной палочкой и лишь после этого поставить на нагревательный прибор. Перед смешиванием двух или более кипящих растворов необходимо снять растворы с нагревательных приборов и хорошо перемешать. При нагревании воды или других жидкостей в промывалках необходимо предварительно извлечь из них пробку со стеклянной трубкой.
При наблюдении процесса растворения анализируемых веществ в тиглях, стаканах, содержание кислоты и щелочи, особенно горячие, категорически запрещается держать эти сосуды непосредственно перед глазами.
При переносе тигля с горячей жидкостью следует пользоваться тигельными щипцами (держать их вдали от себя и работающих студентов). Особую осторожность следует соблюдать при проведении операции сплавления исследуемого объекта с плавнями, запрещается склоняться над тиглем и подносить его близко к глазам в процессе сплавления, возможен выброс расплава.
В лаборатории химического и физико-химического анализа студенты приобретают основные навыки по технике химических экспериментов количественных определений с использованием современных приборов физико-химического анализа. Вместе с этим студенты должны научиться проводить необходимые вычисления и пользоваться простейшими вычислительными приборами.
Порядок проведения лабораторной работы
С целью глубокого усвоения материала лабораторной работы необходимо предварительно ознакомиться с теоретическими вопросами, связанными с данной лабораторной работой, инструкцией по работе на приборе и только после этого приступить к выполнению эксперимента. Четырехчасовые лабораторные работы выполняются за два занятия: на первом занятии студенты знакомятся с принципом работы прибора, проводят подготовительные операции; на втором занятии выполняется контрольная задача.
Ведение лабораторного журнала
В лаборатории химического и физико-химического анализа студенты выполняют контрольные задачи по определению элементов в растворах их соединений. Все результаты измерений, полученные при выполнении анализа, заносятся в лабораторный журнал. Лабораторный журнал следует вести четко, аккуратно, химически грамотно. Отчет составляется в произвольной форме, однако следует отразить следующее:
1) сущность изучаемого метода анализа;
2) сущность конкретного метода определения элемента;
3) описание аппаратуры и реактивов;
4) методику выполнения;
5) схему установки (прибора), на котором проводится определение;
6) градуировочный график, кривую титрования (если их построение входят в задачу исследования);
7) результаты измерений на приборе (данные вносятся в виде таблицы);
8) расчет содержания определяемого компонента в анализируемой пробе;
9) расчет ошибки (абсолютной или относительной) определения.
Отчет по выполнению лабораторной работы и контрольной задачи проверяет и подписывает преподаватель, ведущий занятие.
| Мешающие ионы | Cr3+ | Fe3+ | Al3+ | ||||||
| Условия выполнения реакций | рН>7 | рН<7 | рН>7 избыток NaOH | рН>7 t=75-80 oC | рН>7 | рН>7 избыток NaOH | рН>7 избыток NaOH t=75-80 oC | рН>7 | |
| Внешний эффект | Выпадение аморфного осадка | Растворение осадка | Образование осадка розового цвета | Выпадает осадок зеленого цвета | Растворение осадка | Переход окраски раствора с зеленого в желтый цвет | Образование черно-бурого осадка | ||
| Приложение 2 | Уравнения реакций | AlCl3+3NaOH→Al(OH)3↓+3NaCl Al3++3Cl-+3Na++3OH-→Al(OH)3↓+3Na++3Cl- Al3++3OH-→Al(OH)3↓ | Al(OH)3↓+3HCl→AlCl3+3H2O Al(OH)3↓+3H++3Cl-→Al3++3Cl-+3H2O Al(OH)3↓+3H+→Al3++3H2O | Al(OH)3↓+3NaOH→Na[Al(OH)4] Al(OH)3↓+Na++OH-→Na++ [Al(OH)4]- Al(OH)3↓+OH-→ [Al(OH)4]- | AlCl3 + 3NH4OH→Al(OH)3↓ + 3NH4OH | CrCl3+3NaOH→Cr(OH)3↓+3NaCl Cr3++3Cl-+3Na++3OH-→ Cr(OH)3↓+3Na++3Cl- Cr3++3OH-→ Cr(OH)3↓ | Cr(OH)3↓+3NaOH→Na3[Cr(OH)6] Cr(OH)3↓+3Na++3OH-→3Na++[Cr(OH)6]3- Cr(OH)3↓+3OH-→[Cr(OH)6]3- | 2Na3[Cr(OH)6]+3H2O2→2Na2CrO4+2NaOH+8H2O 2│Cr3+-3e→Cr6+ 3│(O2)2-+2e→2O2- | MnSO4 +2NaOH +H2O2→MnO(OH)2↓+ H2O +Na2SO4 1 │Mn2+ +4OH- - 2ē→MnO(OH)2 +H2O 1 │H2O2 +H2O+2ē→H2O+2OH- |
| Реагент | NaOH | HCl | NaOH | NH3 Ализарин | NaOH | NaOH | H2O2 | NaOH H2O2 | |
| Изучаемый ион | Al3+ | Al(OH)3 | Al3+ | Cr3+ | Cr(OH)3 | [Cr(OH)6]3- | Mn2+ |
| Ni2+ | |||||||
| рН<7 | рН>7 | рН>7 | рН>7 | рН<7 | |||
| Растворение осадка | Выпадает осадок грязно-зеленого цвета, буреющий на воздухе | Выпадение осадка темно-синего цвета (турнбулева синь) | Розово-красное окрашивание | Выпадает осадок бурого цвета | Растворение осадка | Выпадение осадка темно-синего цвета (берлинская лазурь) | Раствор кроваво-красного цвета |
| Fe(OH)2↓+2HCl→FeCl2+2H2O Fe(OH)2↓+2H++2Cl-→Fe2++2Cl-+2H2O Fe(OH)2↓+2H+→Fe2++2H2O | FeCl2+2NaOH→Fe(OH)2+2NaCl Fe2++2Cl-+2Na++2OH-→Fe(OH)2↓+2Na++2Cl- Fe2++2OH-→Fe(OH)2↓ 4Fe(OH)2↓+O2+2H2O→4Fe(OH)3↓ 4│Fe2+-e→Fe3+ 1│O20+4e→2O2- | FeCl2+K3[Fe(CN)6]→Fe3[Fe(CN)6]2↓+2KCl Fe2++2Cl-+3K++[Fe(CN)6]3-→KFe[Fe(CN)6]↓+2K++2Cl- Fe2++K++[Fe(CN)6]3-→Kfe[Fe(CN)6]↓ | FeCl3+3NaOH→Fe(OH)3+3NaCl Fe3++3Cl-+3Na++3OH-→Fe(OH)3↓+3Na++3Cl- Fe3++3OH-→Fe(OH)3↓ | Fe(OH)3↓+3HCl→FeCl3+3H2O Fe(OH)3↓+3H++3Cl-→Fe2++3Cl-+3H2O Fe(OH)3↓+3H+→Fe2++3H2O | 4FeCl3+3K4[Fe(CN)6]→ Fe4[Fe(CN)6]3↓+12KCl 4Fe3++12Cl-+12K++3[Fe(CN)6]4-→Fe4[Fe(CN)6]3↓+12K++12Cl- 4Fe3++[Fe(CN)6]4-→Fe4[Fe(CN)6]3↓ | FeCl3 +6KSCN→K3[Fe(SCN)6] +3KCl Fe3+ +3Cl- +6K++6SCN-→3K++[Fe(SCN)6]3-+3K++3Cl- Fe3+ +6SCN-→[Fe(SCN)6]3- | |
| HCl | NaOH O2 | K3[Fe(CN)6] | Диметилглиоксим, NH3 | NaOH | HCl | K4[Fe(CN)6] | KSCN |
| Fe(OH)2↓ | Fe2+ | Fe2+ | Fe2+ | Fe3+ | Fe(OH)3↓ | Fe3+ | Fe3+ |
| Fe2+ | |||||||
| рН>7 | рН>7 | рН>7 | Избыток HCl t=75-80 oC | рН<7 t=75-80 oC | рН<7 | рН<7 | рН>7 |
| Выпадение осадка зеленого цвета | Раствор зеленого цвета | Выпадает красный осадок | Переход окраски раствора в желто-оранжевый цвет | Переход желто-оранжевой окраски в вишнево-красную окраску | Выпадает белый осадок | Растворение осадка | |
| NiCl2+ 2NaOH→ Ni(OH)2↓+2NaCl Ni2++2Cl-+ 2Na++2OH-→ Ni(OH)2↓+2Na++2Cl- Ni2++2OH-→ Ni(OH)2↓ | Ni(OH)2↓+ 6NH3→[Ni(NH3)6](OH)2 Ni(OH)2↓+ 6NH3→[Ni(NH3)6]2++2OH- | 6HVO3→H4V6O17+H2O 6H++6VO3-→4H++V6O174-+H2O 2H++6VO3-→V6O174-+H2O | HVO3+H2O→H3VO4 H++ VO3-+H2O→H3++ VO43- H3VO4+H2O2→H3[VO2(O2)2]+2H2O H3++ VO43-+H2O2→3H++[VO2(O2)2]3-+2H2O | Na2MoO4+2HCl→H2MoO4↓+2NaCl 2Na++ MoO42-+2H++2Cl-→H2MoO4↓+2Na++2Cl MoO42-+2H+→H2MoO4↓ | H2MoO4↓+2HCl→MoO2Cl2+2H2O H2MoO4↓+2H++2Cl→MoO22++2Cl-+2H2O H2MoO4↓+2H+→MoO22++2H2O | H2MoO4↓+2NaOH→Na2MoO4+2H2O H2MoO4↓+2Na++2OH-→2Na++MoO42-+2H2O H2MoO4↓+2OH-→ MoO42-+2H2O | |
| NaOH | NH3 | Диметилглиоксим NH3 | HCl | HCl H2O2 | HCl | HCl | NaOH |
| Ni2+ | Ni(OH)2 | Ni2+ | VO3- | VO3- | MoO42- | H2MoO4 |
| рН<7 | рН<7 | рН<7 t=75-80 oC |
| Переход окраски раствора в красный цвет | Выпадает осадок белого цвета | Выпадает осадок серо-синего цвета |
| 2Na2MoO4↓+SnCl2+10NH4SCN+12HCl →2(NH4)2[MoO(SCN)5]+6H2O+6NH4Cl+4NaCl+SnCl4 2│ MoO42-+5SCN-+6H++e→[MoO(SCN)5]2-+3H2O 1│Sn2+-2e→Sn4+ | Na2WO4+2HCl→H2WO4↓+2NaCl 2Na++WO42-+2H++2Cl-→ H2WO4↓+2Na++2Cl- WO42-+2H+→ H2WO4↓ | 2H2WO4↓+SnCl2+4HCl→2(WO2)Cl↓+SnCl4+4H2O 2│ H2WO4↓+2H++e→WO2++2H2O 1│Sn2+-2e→Sn4+ |
| SnCl2 NH4SCN | HCl | SnCl2 |
| Na2MoO4 | WO42- | H2WO4 |
| Контрольная лабораторная работа «Анализ неизвестного вещества | Наличие иона в растворе | ||||||||
| Условия выполнения реакций | рН>7 t=75-80 oC | рН>7 | рН>7 избыток NaOH | рН>7 избыток NaOH t=75-80 oC | рН>7 | ||||
| Внешний эффект | Образование осадка розового цвета | Выпадает осадок зеленого цвета | Растворение осадка | Переход окраски раствора с зеленого в желтый цвет | Образование черно-бурого осадка | Выпадение осадка темно-синего цвета (турнбулева синь) | Выпадение осадка темно-синего цвета (берлинская лазурь) | Раствор кроваво-красного цвета | |
| Уравнения реакций | AlCl3 + 3NH4OH→Al(OH)3↓ + 3NH4OH | CrCl3+3NaOH→Cr(OH)3↓+3NaCl Cr3++3Cl-+3Na++3OH-→ Cr(OH)3↓+3Na++3Cl- Cr3++3OH-→ Cr(OH)3↓ | Cr(OH)3↓+3NaOH→Na3[Cr(OH)6] Cr(OH)3↓+3Na++3OH-→3Na++[Cr(OH)6]3- Cr(OH)3↓+3OH-→[Cr(OH)6]3- | 2Na3[Cr(OH)6]+3H2O2→2Na2CrO4+2NaOH+8H2O 2│Cr3+-3e→Cr6+ 3│(O2)2-+2e→2O2- | MnSO4 +2NaOH +H2O2→MnO(OH)2↓+ H2O +Na2SO4 1 │Mn2+ +4OH- - 2ē→MnO(OH)2 +H2O 1 │H2O2 +H2O+2ē→H2O+2OH- | FeCl2+K3[Fe(CN)6]→Fe3[Fe(CN)6]2↓+2KCl Fe2++2Cl-+3K++[Fe(CN)6]3-→KFe[Fe(CN)6]↓+2K++2Cl- Fe2++K++[Fe(CN)6]3-→Kfe[Fe(CN)6]↓ | 4FeCl3+3K4[Fe(CN)6]→ Fe4[Fe(CN)6]3↓+12KCl 4Fe3++12Cl-+12K++3[Fe(CN)6]4-→Fe4[Fe(CN)6]3↓+12K++12Cl- 4Fe3++[Fe(CN)6]4-→Fe4[Fe(CN)6]3↓ | FeCl3 +6KSCN→K3[Fe(SCN)6] +3KCl Fe3+ +3Cl- +6K++6SCN-→3K++[Fe(SCN)6]3-+3K++3Cl- Fe3+ +6SCN-→[Fe(SCN)6]3- | |
| Реагент | NH3 Ализарин | NaOH | NaOH | H2O2 | NaOH H2O2 | K3[Fe(CN)6] | K4[Fe(CN)6] | KSCN | |
| Изучаемый ион | Al3+ | Cr3+ | Cr(OH)3 | [Cr(OH)6]3- | Mn2+ | Fe2+ | Fe3+ | Fe3+ |
| рН>7 | рН>7 | рН>7 | рН<7 t=75-80 oC | рН<7 | рН<7 t=75-80 oC |
| Выпадение осадка зеленого цвета | Раствор зеленого цвета | Выпадает красный осадок | Переход желто-оранжевой окраски в вишнево-красную окраску | Переход окраски раствора в красный цвет | Выпадает осадок серо-синего цвета |
| NiCl2+ 2NaOH→ Ni(OH)2↓+2NaCl Ni2++2Cl-+ 2Na++2OH-→ Ni(OH)2↓+2Na++2Cl- Ni2++2OH-→ Ni(OH)2↓ | Ni(OH)2↓+ 6NH3→[Ni(NH3)6](OH)2 Ni(OH)2↓+ 6NH3→[Ni(NH3)6]2++2OH- | HVO3+H2O→H3VO4 H++ VO3-+H2O→H3++ VO43- H3VO4+H2O2→H3[VO2(O2)2]+2H2O H3++ VO43-+H2O2→3H++[VO2(O2)2]3-+2H2O | 2Na2MoO4↓+SnCl2+10NH4SCN+12HCl →2(NH4)2[MoO(SCN)5]+6H2O+6NH4Cl+4NaCl+SnCl4 2│ MoO42-+5SCN-+6H++e→[MoO(SCN)5]2-+3H2O 1│Sn2+-2e→Sn4+ | 2H2WO4↓+SnCl2+4HCl→2(WO2)Cl↓+SnCl4+4H2O 2│ H2WO4↓+2H++e→WO2++2H2O 1│Sn2+-2e→Sn4+ | |
| NaOH | NH3 | Диметилглиоксим NH3 | HCl H2O2 | SnCl2 NH4SCN | SnCl2 |
| Ni2+ | Ni(OH)2 | Ni2+ | VO3- | MoO42- | WO42- |
Учебное издание
Подолина Елена Алексеевна
Небольсин Александр Егорович
Дата добавления: 2016-01-04; просмотров: 64; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
