Потенциометрический метод анализа
Потенциометрия – метод определения различных физико-химических величин (Кдис, Кнест, КS и др.) и концентраций (активностей) веществ. Метод основан на измерении эдс обратимых электрохимических цепей между индикаторным электродом и электродом сравнения.
Для определения значений эдс гальванического элемента применяют потенциал – определяющий прибор, например рН-метр. Индикаторный электрод – электрод, потенциал которого зависит от концентрации определяемого соединения в растворе, в соответствии с уравнением Нернста. К индикаторным электродам относятся электроды первого и второго рода, окислительно-восстановительные, ионселективные, мембранные. Электрод сравнения – электрод, потенциал которого не зависит от концентрации определяемых ионов, по отношению к нему и измеряют потенциал индикаторного электрода. Чаще всего это электроды второго рода, обладающие определенными свойствами: обратимость, воспроизводимость, стабильностью. Например, каломельный и хлорсеребряный электроды.
Потенциал индикаторного электрода и электрода сравнения рассчитывается по уравнению Нернста:
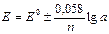 , (30)
, (30)
где Е – потенциал электрода, при данной активности вещества в растворе; Е0 – стандартный потенциал электрода; а – активность катиона или аниона в растворе; п – число электронов, участвующих в данной электрохимической реакции; знак «+» ставится в том случае, когда электроактивной частицей является катион, знак «-» – анион.
|
|
|
Если в качестве индикаторного электрода применяется стеклянный электрод, уравнение Нернста принимает следующий вид: Е = К + 0,058рН, где К – константа, учитывающая потенциал асимметрии стеклянной мембраны, которая возникает в связи с наличием напряжений и дефектов стекла.
Потенциометрический анализ широко применяют для непосредственного определения активностей ионов, находящихся в растворе – прямая потенциометрия, а также для индикации точки эквивалентности при титровании, по изменению потенциала индикаторного электрода в ходе титрования – потенциометрическое титрование.

|
| Рис. 5. Установка для потенциометрический измерений. |
В методе потенциометрического титрования используются все типы химических реакций: кислотно-основные, окислительно-восстановительные, осаждения и комплексонообразования. В ходе потенциометрического титрования измеряют значения эдс ячейки после добавления каждой порции титранта. Для определения точки эквивалентности строят график зависимости величины потенциала электрода (или рН) от объема титранта или изменение потенциала на единицу изменения объема титранта.
Дата добавления: 2016-01-04; просмотров: 22; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
