Энергия Гиббса – движущая сила процесса (химической реакции)
Гиббс ввел в термодинамику новую функцию состояния, которая впоследствии получила имя автора – энергия Гиббса. Эта функция вводится через уже известные нам энтальпию и энтропию.
Энергия Гиббса – это термодинамическая функция состояния системы, которая определяется уравнением:
G = H – TS.
Если реакция осуществляется при постоянных давлении и температуре (такой процесс называется изобарно-изотермическим):
ΔG = ΔH – TΔS.
В химической термодинамике энергия Гиббса играет исключительно важную роль, поскольку ее изменение учитывает одновременно действие обоих факторов: и энергетического, и энтропийного. При изотермических условиях именно изменение энергии Гиббса определяет возможность самопроизвольного протекания химического процесса.
В любой закрытой системе при постоянных давлении и температуре возможен только такой самопроизвольный процесс, который ведет к уменьшению энергии Гиббса (то есть, ΔG 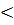 0).
0).
Если ΔG 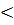 0, - самопроизвольно протекает прямая реакция в сторону уменьшения G.
0, - самопроизвольно протекает прямая реакция в сторону уменьшения G.
Если ΔG 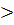 0, - прямая реакция самопроизвольно не протекает (самопроизвольно идет обратная реакция, так как для нее ΔG
0, - прямая реакция самопроизвольно не протекает (самопроизвольно идет обратная реакция, так как для нее ΔG 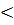 0);
0);
Если ΔG 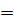 0, - идут и прямая, и обратная реакции одновременно и с одинаковыми скоростями. Наступает состояние химического равновесия. При этом ΔG = ΔH – TΔS = 0 ⇒
0, - идут и прямая, и обратная реакции одновременно и с одинаковыми скоростями. Наступает состояние химического равновесия. При этом ΔG = ΔH – TΔS = 0 ⇒ 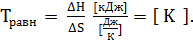
Стандартной энергией Гиббса образования вещества называется изменение энергии Гиббса химической реакции получения одного моля этого вещества из простых веществ в стандартных условиях.
|
|
|
Обозначают ΔG0обр, ΔG0f 298, ΔG0298.
Пример:. ΔG0обр (H2O) = - 237,2 кДж/моль
Энергии Гиббса образования наиболее устойчивых простых веществ принимаются равными нулю. Энергии Гиббса образования сложных веществ находят по таблицам (см., например, практикум для лабораторных работ по общей химии).
Пример. Рассчитайте изменение энергии Гиббса реакции 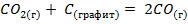 при стандартных условиях. Будет ли указанная реакция протекать самопроизвольно при стандартных условиях?
при стандартных условиях. Будет ли указанная реакция протекать самопроизвольно при стандартных условиях?
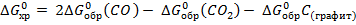 = 2
= 2  137,1 –(−397,4) – 0 = 123,2 кДж.
137,1 –(−397,4) – 0 = 123,2 кДж.
Вывод. 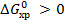 ⇒ при стандартных условиях прямая реакция самопроизвольно не протекает.
⇒ при стандартных условиях прямая реакция самопроизвольно не протекает.
Пример. Начиная с какой температуры реакция 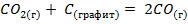 пойдет самопроизвольно?
пойдет самопроизвольно?
Данная реакция пойдет самопроизвольно, начиная с равновесной температуры 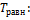
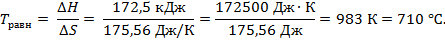
Вывод. Данная реакция пойдет самопроизвольно, начиная с температуры 710 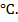
Таким образом, при низких температурах ΔG 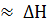 , и критерием самопроизвольного протекания реакции в первом приближении может служить знак теплового эффекта реакции, а при высоких температурах ΔG
, и критерием самопроизвольного протекания реакции в первом приближении может служить знак теплового эффекта реакции, а при высоких температурах ΔG 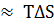 и определяется, главным образом, знаком изменения энтропии. Это означает, что при низких температурах могут самопроизвольно протекать экзотермические реакции, а при высоких температурах – реакции, сопровождающиеся увеличением энтропии.
и определяется, главным образом, знаком изменения энтропии. Это означает, что при низких температурах могут самопроизвольно протекать экзотермические реакции, а при высоких температурах – реакции, сопровождающиеся увеличением энтропии.
|
|
|
ЗАКЛЮЧЕНИЕ
Знание законов химической термодинамики позволяет рассчитывать энергетические эффекты химических реакций и фазовых превращений, предсказывать возможность или невозможность протекания химических процессов.
Дата добавления: 2022-01-22; просмотров: 145; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
