Внутренняя энергия. Первый закон термодинамики. Энтальпия.
ПЕНЗЕНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Кафедра «Химия»
«УТВЕРЖДАЮ»
Заведующий кафедрой «Химия»
Профессор, д.х.н. Ю.Перелыгин
«____»______________ 2012 г.
ТЕКСТ ЛЕКЦИИ №
по дисциплине «Химия»
по специальности 200100 «Приборостроение»
Тема № . Основные закономерности протекания химических процессов
Занятие № . Химическая термодинамика
Текст лекции обсужден на заседании ПМК №__ кафедры «Химия» «___»____________ 2012 г., протокол №_____
Г. Пенза
Содержание
Введение
1. Основные понятия химической термодинамики.
2. Внутренняя энергия. Первый закон термодинамики. Энтальпия.
3. Основы термохимии.
4. .Второй закон термодинамики. Энтропия.
5. Энергия Гиббса – движущая сила процесса (химической реакции).
Заключение.
Литература:
1. Коровин Н.В. Общая химия. Учебник. – М.: Высшая школа, 1998. – с. 116 -149.
Учебно – материальное обеспечение:
1. Мультимедийный проектор.
2. Плакат «Термодинамические характеристики некоторых веществ».
Цель занятия:
Знать: 1.Тепловой эффект химической реакции. Изменение энтальпии. Эндотермические и экзотермические реакции.
2.Энтропия и свободная энергия Гиббса. Определение направления протекания химических процессов.
Уметь: 1. Рассчитать: а)энтальпию, б)энтропию, в)энергию Гиббса химических реакций, а также температуру, при которой устанавливается химическое равновесие.
|
|
|
2. Определить по результатам проведенных расчетов: а)знак теплового эффекта химической реакции; б)рост или убывание беспорядка при протекании химической реакции; в) возможность или невозможность протекания химических процессов.
Организационно-методические указания:
1.Проверить наличие обучаемых и их готовность к занятиям, устранить недостатки.
2.Объявить тему и цель занятия, учебные вопросы, литературу.
3.Обосновать необходимость изучения данной темы на примерах применения первого и второго начала термодинамики в приборостроении.
4.Рассмотреть учебные вопросы с применением кадров презентации и таблицы «Термодинамические характеристики некоторых веществ».
5.По каждому учебному вопросу и в конце занятия подвести итоги.
6.В конце занятия выдать задание на самоподготовку.
ВВЕДЕНИЕ
Центральным в химии является учение о превращениях веществ, в том числе, об энергетике химических реакций. Усвоение этого учения позволит предсказывать возможность и направление химических и физико-химических процессов, рассчитывать энергетические эффекты и энергозатраты, а также предупреждать нежелательные реакции в тех или иных устройствах и приборах.
|
|
|
Термодинамика – это раздел химии, который изучает:
1) взаимные превращения энергии (химической, электрической, тепловой, световой и т. д) в ходе химических реакций;
2) тепловые эффекты химических реакций;
3) принципиальную возможность и направление самопроизвольного протекания химических реакций.
Основные понятия химической термодинамики
Для удобства изучения необходимо изолировать объекты исследования от окружающего пространства. Такая совокупность тел, выделенная из пространства, образует систему.
Система – это тело или группа тел, мысленно или реально изолированных от внешней среды.
Фазой называется часть системы, отделенная от других ее частей поверхностью раздела, при переходе через которую свойства изменяются скачком.
Если в системе возможен массо- и теплообмен между всеми ее составными частями, то такая система называется термодинамической.
Гомогенной называется система, состоящая из одной фазы. Реакции, протекающие в гомогенной системе, называются гомогенными. Гомогенные реакции идут во всем объеме системы и протекают в растворах и между газами.
Гетерогенной называется система, состоящая из нескольких фаз. Реакции, протекающие в гетерогенной системе, называются гетерогенными. Гетерогенные реакции протекают на поверхности раздела фаз, образующих систему.
|
|
|
Изолированная система не может обмениваться с окружающей средой ни веществом, ни энергией.
Открытая система может обмениваться с окружающей средой и веществом, и энергией.
Замкнутая система не может обмениваться с окружающей средой веществом, но может обмениваться энергией.
Состояние системы определяется ее свойствами или параметрами.
Термодинамические параметры – величины, которые характеризуют состояние фаз системы. Ими, в частности, являются температура Т, давление Р, объем V, количество вещества n. При помощи определенного числа термодинамических параметров однозначно устанавливается состояние фазы. Остальные параметры состояния в таком случае также определены и называются функциями состояния.
Функция состояния – это термодинамический параметр системы, значение которого определяется только конечным и начальным состоянием системы и не зависит от пути перехода системы из состояния (1) в состояние (2).
К функциям состояния относятся: внутренняя энергия U, энтальпия H, энтропия S, энергия Гиббса G (см. последующие разделы).
|
|
|
Всякое изменение, происходящее в системе и связанное с изменением термодинамических параметров, называется термодинамическим процессом.
Термодинамические процессы различают:
1) Изобарные (P = const, ΔP = 0);
2) Изохорные (изохорические) (V = const; ΔV = 0);
3) Изотермические (T = const, ΔT = 0);
4) Адиабатические (Q = 0, обмен теплотой между системой и внешней
средой отсутствует);
5) Экзотермические ( +Q);
6) Эндотермические ( -Q)
Внутренняя энергия. Первый закон термодинамики. Энтальпия.
Внутренняя энергия U – это термодинамическая функция состояния системы. Она является совокупностью энергий поступательного, вращательного и колебательного движений молекул, атомов, электронов и ядер, включая внутриядерную энергию.
Первый закон термодинамики, окончательно сформулированный Джоулем в середине XIX века, представляет собой закон сохранения энергии.
Первое начало термодинамики для процессов, которые сопровождаютсятепловыми явлениями (одна из формулировок):
если к системе (веществу или совокупности веществ) подводится теплота Q , то она расходуется на приращение внутренней энергии Δ U и на совершение работы против внешних сил A :
Q = ΔU + A
О том, что представляет собой ΔU, уже говорилось выше. Поговорим теперь о физическом смысле величины А. Реальные химические процессы: горение, металлургические реакции и т.д. – обычно протекают при постоянном давлении. Эти процессы, как вы помните, называются изобарными. Эти процессы мы и рассмотрим прежде всего.
а) Изобарный процесс (P = const, ΔP = 0):
Рассмотрим систему: газ в сосуде под поршнем. Сообщим нашей системе определенное количество теплоты, то есть нагреем его. Газ расширится и займет новый, больший объем, а давление внутри сосуда сохранится постоянным. При этом газ совершит работу против сил внешнего давления: А = pΔV (см. рис).
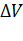
|

|
|
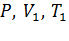
|
Согласно первому началу термодинамики, тепло, подведенное к системе, будет расходоваться на приращение внутренней энергии и на совершение работы против внешних сил:
Qp = ΔU + A; Q = ΔU + pΔV = U2 + pV2 – (U1 +pV1) = H2 – H1 = ΔH.
Величина U + pV обозначается буквой H и называется энтальпией.
Энтальпия H – это термодинамическая функция состояния системы, определяемая выражением:
H = U + pV.
Энтальпия характеризует теплосодержание системы.
Таким образом, мы видим, что при условии постоянства давления подводимая к системе теплота идет на увеличение энтальпии системы ΔH:
Qp = ΔH.
Это уравнение дает возможность определять изменение энтальпии при различных процессах. Так, при нагревании вещества при постоянном давлении
ΔH = Qp = n cp Δt, где
n – количество вещества, cp – молярная теплоемкость вещества при постоянном давлении.
Поговорим теперь более подробно о тепловом эффекте реакции. Вы знаете, что химическая реакция, как правило, сопровождается тепловым эффектом. Поскольку одно и то же количество теплоты может либо выделяться, либо поглощаться, тепловой эффект реакции необходимо характеризовать не только абсолютной величиной, но и знаком.
Исторически сложились две системы отсчета: термохимическая и термодинамическая. Термохимическую систему знаков вы изучали в школе. В ней знак теплового эффекта экзотермической реакции считается положительным (+Q). Эндотермические реакции сопровождаются отрицательным тепловым эффектом (- Q).
В термодинамике принята обратная система знаков, то есть теплота, поглощенная системой, считается положительной, а теплота, отданная системой в окружающую среду, - отрицательной.
Понятно, что когда в одной и той же науке возникают две системы знаков, возникает путаница. Чтобы ее избежать, в термодинамической системе знаков тепловой эффект реакции отождествляют с изменением энтальпии системы (если процесс идет при постоянном давлении). При записи уравнения в этой системе тепловой эффект не включают в уравнение, а записывают рядом. И мы с вами в дальнейшем будем придерживаться термодинамической системы знаков:
Если ΔH химической реакции 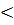 0, прямая реакция экзотермическая (идет с выделением тепла);
0, прямая реакция экзотермическая (идет с выделением тепла);
Если ΔH химической реакции 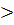 0, прямая реакция эндотермическая (идет с поглощением тепла);
0, прямая реакция эндотермическая (идет с поглощением тепла);
Обычно химические реакции протекают при постоянном давлении (в открытых сосудах). Однако, иногда необходимо проводить реакции в закрытых герметичных аппаратах, например, в автоклавах. В этом случае соблюдается условие постоянства объема, и процесс является изохорным.
б) Изохорный процесс (V = const; ΔV = 0);
Qv = ΔU + A = ΔU + pΔV. Но ΔV = 0, следовательно, последнее слагаемое обращается в нуль. Отсюда:
Qv = ΔU.
Это уравнение дает возможность определять изменение внутренней энергии при различных процессах. Например, в случае нагревания вещества при постоянном объеме изменение внутренней энергии определяется по теплоемкости этого вещества:
ΔU = Qv = n cv Δt.
Здесь n – количество вещества, cv - мольная теплоемкость вещества при постоянном объеме, Δt – разность между конечной и начальной температурами.
3.Основы термохимии
Термохимия – раздел термодинамики, изучающий тепловые эффекты.
Дата добавления: 2022-01-22; просмотров: 49; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
