Основные понятия и определения термохимии
Тепловые эффекты можно включать в уравнения реакций.
Термохимическое уравнение – это уравнение химической реакции с указанием ее теплового эффекта.
Особенности термохимических уравнений:
1) указывают агрегатное состояние вещества:
г – газообразное, к – кристаллическое, ж – жидкое, п – парообразное, р – растворенное;
2) коэффициенты в уравнениях могут быть дробными;
3) между исходными веществами и продуктами реакции ставится знак равенства.
Чтобы можно было сравнивать тепловые эффекты химических реакций, введены стандартные условия:
Т = 298 К (250С),
Р = 101,3кПа (1 атм или 760 мм рт. ст.)
Стандартной энтальпией образования вещества называется изменение энтальпии химической реакции получения одного моля этого вещества из простых веществ в стандартных условиях.
Обозначают ΔH0обр, ΔH0f 298, ΔH0298.
Пример:. ΔH0обр (H2O) = - 285,8 кДж
Энтальпии образования наиболее устойчивых простых веществ принимаются равными нулю. Энтальпии же образования менее устойчивых простых веществ равны энтальпиям их образования из устойчивых. Например, при обычных условиях наиболее устойчивой формой кислорода является молекулярный кислород О2, энтальпия образования которого считается равной нулю. Энтальпия же образования озона О3 равна +142 кДж/моль, поскольку при образовании из молекулярного кислорода одного моля озона поглощается 142 кДж. Энтальпии образования сложных веществ находят по таблицам (см., например, практикум для лабораторных работ по общей химии).
|
|
|
3.2. Термохимические расчеты базируются на двух законах: законе Лавуазье-Лапласа и законе Гесса.
Закон Лавуазье-Лапласа (одна из формулировок).
Теплота образования вещества равна по величине и противоположна по знаку теплоте его разложения.
Пример: С(графит) + 2Н2 = СН4; ΔH0обр = +74,9 кДж;
СН4 = С(графит) + 2Н2; ΔH0обр = - 74,9 кДж;
Основной закон термохимии сформулирован академиком Петербургского университета Гессом в 1984 году:
если из данных исходных веществ можно получит различными способами заданные конечные продукты, то независимо от путей получения (например, от вида промежуточных продуктов) суммарный тепловой эффект будет одним и тем же.
Пример: С(графит) ΔН СО2
ΔH1 ΔH2
СО
Закон Гесса является выражением закона сохранения энергии для химических систем и следствием из первого начала термодинамики, однако, он был сформулирован ранее первого начала.
|
|
|
Современная формулировка закона Гесса связывает его с первым началом термодинамики:
Тепловой эффект химической реакции зависит только от природы и состояния продуктов реакции и не зависит от пути, по которому протекает реакция.
Закон справедлив для химических реакций при постоянном давлении или постоянной температуре.
Выразим процессы, которые мы рассмотрели, уравнениями реакций:
I путь: С(гр) + О2(г) = СО2; ΔН;
II путь: С(гр) + 1/2О2(г) = СО(г) ΔН1;
СО(г) + 1/2О2(г) = СО2(г) ΔН2.
Суммарное уравнение:
С(гр) + 1/2О2(г) + СО(г) + 1/2О2(г) = СО(г) + СО2(г);
С(гр) + О2(г) = СО2; ΔН = ΔН1 + ΔН2.
Таким образом, подобно химическим уравнениям, химические уравнения можно складывать и вычитать. При сложении химических уравнений складываются и их тепловые эффекты (а при вычитании –вычитаются).
Рассмотрим еще один пример применения закона Гесса. Вычислим тепловой эффект реакции сгорания метана СН4, зная энтальпии образования метана и продуктов его сгорания:
СН4(г) + 2О2(г) = СО2(г) + 2Н2О(ж), ΔН = x кДж;
СН4(г) = С(к) + 2Н2(г), ΔН = 74,9 кДж;
С(к) + О2(г) = СО2(г), ΔН = - 393,5 кДж;
2Н2(г) + О2(г) = 2Н2О(ж), ΔН = - 2∙285,8 кДж.
|
|
|
Суммируя последние три термохимические уравнения, получим уравнение горения метана: СН4(г) + 2О2(г) = СО2(г) + 2Н2О(ж), ΔН = 74,9 – 393,5 – 571,6 кДж.
Согласно закону Гесса, 74,9 – 393,5 – 571,6 = х, откуда энтальпия сгорания метана х = - 890 кДж/моль.
Рассмотренный пример иллюстрирует практически важное следствие из закона Гесса:
тепловой эффект химической реакции равен сумме энтальпий образования получающихся веществ за вычетом суммы энтальпий образования исходных веществ.
Пример. Рассчитайте тепловой эффект реакции 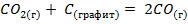 при стандартных условиях.
при стандартных условиях.
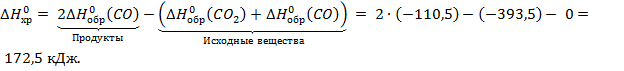 .
.
Вывод. 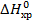
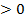 ⇒ прямая реакция – эндотермическая, идет с поглощением тепла.
⇒ прямая реакция – эндотермическая, идет с поглощением тепла.
Из школьного курса вы знаете, что при определенных условиях каждая химическая реакция протекает в определенном направлении. Так, при низких температурах экзотермическая реакция образования парообразной воды практически нацело протекает в прямом направлении. Но при высоких температурах эта же реакция начинает идти в обратном направлении: водяной пар разлагается на водород и кислород. Во всех случаях в результате реакции может быть достигнуто состояние устойчивого химического равновесия, но само положение равновесия при различных условиях оказывается различным.
|
|
|
Возникает вопрос: в чем причина определенной направленности химической реакции? Какие факторы обусловливают то или иное состояние химического равновесия? Почему один химический процесс при данных условиях протекает самопроизвольно, а другой – нет?
Известно, что в механических системах устойчивое равновесие соответствует минимуму потенциальной энергии системы (шарик, лежащий на возвышении, всегда стремится скатиться вниз). Можно предположить, что и химические процессы должны протекать самопроизвольно в направлении уменьшения внутренней энергии системы. Если внутренняя энергия системы уменьшается, выделятся при этом тепло или поглощается? Исходя из первого закона термодинамики: Q = ΔU + A -, а также из определения самопроизвольных процессов как процессов, протекающих без затраты работы над ними, можно предположить, что тепло в самопроизвольных процессах должно системой выделяться (Q = ΔU 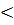 0, здесь используется термодинамическая шкала).
0, здесь используется термодинамическая шкала).
И, действительно, опыт показывает, что при обычных условиях самопроизвольно протекают преимущественно экзотермические реакции. В середине прошлого века сначала Гесс (1849 г.), а затем Томпсен (1852 г.) высказывали соображения о том, что выделение теплоты служит мерой химической силы. Более определенно это сделал Бертло в 1864 г., сформулировав положение, известное как принцип Бертло-Томпсена:
в реагирующей химической системе самопроизвольно протекает та реакция, при которой выделяется максимальное количество теплоты.
Действительно, большинство идущих самопроизвольно реакций являются экзотермическими. С выделением теплоты горят уголь и водород в кислороде, взрывается порох, реагируют металлы с хлором. Как уже отмечалось выше, с точки зрения первого закона термодинамики выделение теплоты системы (ΔН 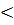 0) связано с уменьшением ее внутренней энергии. Однако, попытка объяснить направленность химических реакций только стремлением к минимуму внутренней энергии приводит к противоречиям с фактами.
0) связано с уменьшением ее внутренней энергии. Однако, попытка объяснить направленность химических реакций только стремлением к минимуму внутренней энергии приводит к противоречиям с фактами.
Облейте руку небольшим количеством эфира, ацетона или даже воды. Вы непременно почувствуете охлаждение, обусловленное самопроизвольным испарением жидкости. Таким образом, в природе, вообще говоря, могут самопроизвольно протекать не только экзотермические, но и эндотермические процессы. Объяснить это кажущееся «противоречие» с первым законом термодинамики помогло открытие в природе новой термодинамической величины – энтропии.
Дата добавления: 2022-01-22; просмотров: 29; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
