Второе начало термодинамики. Энтропия
Второй великий закон термодинамики связан только с одним именем. Его открыл молодой французский инженер Сади Карно.
Молодой инженер Карно рассчитывал и строил водяные двигатели. Но в то же время во Франции начали широко применять паровые машины, и важнейшей научно-технической задачей стало создать теорию тепловых машин. К решению этой задачи приступил и Карно. Честно говоря, он к этому совсем не был подготовлен. Он был еще очень неопытным инженером и в тепловых машинах не разбирался. Но он был гениальным исследователем и был очень хорошо знаком с расчетом водяных двигателей. Он знал: чтобы водяная мельница могла молоть зерно, то есть работать, необходимо одно условие: вода должна падать с высокого уровня на низкий. Карно предположил: чтобы теплота могла совершать работу, она тоже должна переходить с высокого уровня на низкий.
В 1824 году Карно разрабатывает цикл работы идеальной тепловой машины. В ней имеется нагреватель, газ, за счет расширения которого совершается полезная работа, и холодильник, который возвращает газ к исходному состоянию.
Машина Карно идеальна, и ее не может превзойти никакая другая реальная тепловая машина. Но даже машина Карно не может превратить всю теплоту, полученную от нагревателя, в эквивалентную ей работу так, чтобы газ при этом вернулся в исходное состояние. Это утверждение является одной из формулировок второго начала термодинамики.
|
|
|
Второе начало термодинамики (формулировка Кельвина):
невозможен процесс, единственным результатом которого является превращение всей теплоты, полученной от некоторого тела, в эквивалентную ей работу.
Раз тепло не может переходить в работу, у любой тепловой машины имеется так называемый термический коэффициент полезного действия.
Теорема Карно гласит: термический коэффициент полезного действия машины, работающей по принципу Карно, не зависит от вещества, работающего в цикле, а зависит только от разности температур между нагревателем и холодильником (см. рис.).
Газ
Q2
Нагреватель Холодильник
Т1 Т2
Газ
Q1
Здесь Q1 - теплота, полученная газом от нагревателя ( 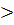 0);
0);
Q2 - теплота, отданная газом холодильнику ( 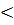 0).
0).
Ђ = 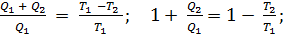
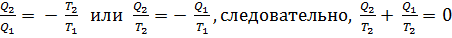 .
.
В термодинамике принято говорить: сумма приведенных теплот для обратимого цикла Карно равна нулю.
Оказывается, что это справедливо и для любого обратимого, то есть квазистатического цикла, каким бы сложным он ни был.
|
|
|
Из этого сейчас же следует очень важный вывод: для любой системы и для любого незамкнутого процесса, каким бы он ни был, из скольких бы стадий ни состоял, обязательно должно существовать такое особое свойство системы, изменение которого при переходе из одного состояния в другое равно сумме приведенных теплот.
Это свойство называется энтропия и обозначается буквой S. Открыл его немецкий ученый, знаменитый термодинамик Клаузиус.
Энтропия S – это термодинамическая функция состояния. Для обратимых изотермических процессов, протекающих в закрытых системах, изменение энтропии определяется выражением:
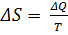 .
.
Если процесс неизотермический, его разбивают на элементарные изотермические процессы с температурой Т и на каждом таком участке 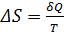 .
.
Обнаружив в природе новую, ранее неизвестную никому величину, Клаузиус назвал ее странным и непонятным словом «энтропия», которое сам же и придумал. Он так объяснил его значение: «тропе» по гречески означает «превращение». К этому корню Клаузиус добавил две буквы «эн» так, чтобы получившееся слово было, по возможности, подобно слову «энергия». Обе величины были настолько близки друг к другу своей физической значимостью, что известное сходство в их названиях было целесообразным.
|
|
|
Можно ли обнаружить энтропию? К сожалению, никак нельзя. Человек не обладает такими органами чувств, которые давали бы ему возможность «видеть» непосредственно - «много» или «мало» энтропии содержит система. Но ни сожалеть, ни удивляться по этому поводу не следует. Ведь мы, например, привыкли к простому понятию «энергия». Но до того, как раздастся выстрел, трудно судить по внешнему виду пороха в ружейном снаряде, велик ли запас его внутренней энергии.
И все-таки попытаемся выяснить физический смысл энтропии. Рассмотрим плавление индивидуального кристаллического вещества. Плавление происходит при постоянной температуре и сопровождается поглощением так называемой скрытой теплоты плавления ΔHпл (энтальпии плавления). Поглощение теплоты должно было бы способствовать увеличению внутренней энергии системы, что выразилось бы в увеличении ее температуры. Однако, этого не наблюдается. Следовательно, в процессе плавления действует другой фактор, который способствует сохранению постоянной температуры. Аналитически это положение можно представить в виде соотношения Qпл = TΔSпл.
|
|
|
При плавлении кристалла происходит разрушение упорядоченной кристаллической структуры и образование расплава, который характеризуется неупорядоченным расположением частиц, то есть наблюдается увеличение беспорядка в системе.
Второе определение энтропии:
энтропия – термодинамическая функция состояния системы, которая характеризует степень ее неупорядоченности.
Чем больше беспорядка в системе, чем больше энтропия.
Статистическое определение энтропии. Энтропия пропорциональна логарифму термодинамической вероятности системы:
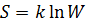 ,
,
где k – постоянная Больцмана, W – термодинамическая вероятность системы, определяемая числом микросостояний, которыми может осуществляться рассматриваемое состояние.
Статистическая формулировка второго начала термодинамики:
в изолированной системе самопроизвольно могут протекать только такие процессы, которые ведут к увеличению неупорядоченности системы, то есть к росту энтропии.
Стандартной энтропией образования вещества называется изменение энтропии химической реакции получения одного моля этого вещества из простых веществ в стандартных условиях.
Обозначают S0обр, S0f 298, S0298.
Пример:. S0обр (H2O) = - 69,9 Дж/(моль 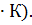
Энтропии образования простых веществ не равны нулю, и это отличает энтропию от других термодинамических параметров: энтальпии и энергии Гиббса. Энтропии образования простых и сложных веществ находят по таблицам (см., например, практикум для лабораторных работ по общей химии).
Пример. Не производя вычислений, предскажите знак изменения энтропии реакции  Подтвердите свои рассуждения расчетом.
Подтвердите свои рассуждения расчетом.
Реакция 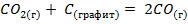 протекает с увеличением беспорядка, так как в результате реакции из одного моля газообразного и одного моля твердого веществ образуется два моля газообразного вещества. Следовательно, указанная реакция идет с увеличением энтропии.
протекает с увеличением беспорядка, так как в результате реакции из одного моля газообразного и одного моля твердого веществ образуется два моля газообразного вещества. Следовательно, указанная реакция идет с увеличением энтропии.
Рассчитаем изменение энтропии реакции 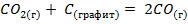 при стандартных условиях.
при стандартных условиях.
 = 2
= 2  137,5 – 213,7 – 5,74 = 175,56 кДж.
137,5 – 213,7 – 5,74 = 175,56 кДж.
Вывод. 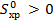 ⇒ прямая реакция идет с возрастанием беспорядка.
⇒ прямая реакция идет с возрастанием беспорядка.
Таким образом, мы познакомились еще с одной характеристикой химической реакции – энтропией, и еще с одним критерием – стремлением системы к максимуму энтропии.
Именно увеличением энтропии объясняется возможность самопроизвольного протекания таких процессов как испарение жидкостей, диффузия газов и жидкостей, а также любой процесс растворения.
Существенно подчеркнуть, что в подобных процессах на увеличение энтропии тратится теплота. Испарение эфира с руки протекает самопроизвольно с увеличением энтропии, но теплота для такого перехода с руки отнимается, то есть процесс идет эндотермически ( ΔH 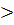 0, Δ S
0, Δ S 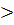 0).
0).
В неизолированных системах возможны и процессы, которые самопроизвольно протекают с уменьшением энтропии. Это и кристаллизация расплава, и конденсация пара. Но как мы знаем, перечисленные процессы идут при охлаждении тел, то есть говоря языком термодинамики, теплота при этом выделяется в окружающую среду (ΔH 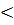 0, ΔS
0, ΔS 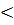 0).
0).
Таким образом, направление самопроизвольного протекания химических реакций определяется совокупным действием двух тенденций: стремлением внутренней энергии к минимуму (энтальпийный фактор) и стремлением энтропии к максимуму (энтропийный фактор).
Совершенно очевидно, что две эти тенденции могут не совпадать по направлению действия, конкурировать друг с другом так, что одна тенденция при этом побеждает другую. Очевидно, имело смысл как-то учесть роль обеих тенденций одновременно. Это сделал в своей работе американский ученый Гиббс.
Дата добавления: 2022-01-22; просмотров: 32; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
