Т ема 6. ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
Химическая кинетика – это учение о механизме и скорости химических реакций. Скорость химической реакции V определяется изменением концентрации реагирующих веществ в единицу времени  . Среднюю скорость
. Среднюю скорость  можно рассчитать следующим образом:
можно рассчитать следующим образом:
 ,
,
где DC – изменение концентрации вещества за время ∆t; С1 и С2 – концентрации вещества в начальный и конечный моменты реакции; (+) – определяет изменение концентрации продукта реакции (C2 > C1); (–) – определяет изменение концентрации исходного вещества, которое в ходе реакции расходуется (C2 < C1).
На скорость химической реакции влияют различные факторы; наиболее важные:
1) природа вещества;
2) концентрация реагентов, для газообразных веществ – давление;
3) температура;
4) катализатор;
5) площадь соприкосновения реагирующих веществ в гетерогенных системах.
Закон действующих масс. Устанавливает влияние концентрации реагирующих веществ на скорость химической реакции. В гомогенной системе при T = const скорость химической реакции пропорциональна произведению молярных концентраций реагирующих веществ.
В общем виде для реакции
А + В = Д.
Этот закон можно представить:
V = k × C(А) × С(В),
где C(А), С(В) – молярные концентрации веществ А и В; k – константа скорости реакции.
По своему смыслу константа скорости – это удельная скорость, т. е. она равна скорости реакции, когда C(А) = С(В) = 1 моль/л. Константа скорости зависит от природы веществ и температуры.
|
|
|
Если в реакции участвуют газообразные вещества, то в законе действия масс вместо концентрации можно брать парциальные давления
газообразных реагентов. Так, для реакции H2(г) + I2(г) = 2HI(г) можно так записать выражение закона действия масс:
V = k × p(H2) × p(I2),
где p(H2) и p(I2) – парциальные давления водорода и йода в газовой смеси.
Влияние температуры. Зависимость скорости реакции от температуры определяется эмпирическим правилом Вант-Гоффа:
При повышении температуры на 10 °С скорость реакции увеличивается в 2 – 4 раза.
Математически это правило можно представить в следующем виде:
 ,
,
где  ,
, 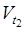 – скорости реакции при температурах t1, t2; g – температурный коэффициент скорости реакции (коэффициент Ван-Гоффа), показывает во сколько раз изменяется скорость реакции при изменении температуры на 10 °С.
– скорости реакции при температурах t1, t2; g – температурный коэффициент скорости реакции (коэффициент Ван-Гоффа), показывает во сколько раз изменяется скорость реакции при изменении температуры на 10 °С.
С повышением температуры увеличивается число соударений молекул, но не каждое соударение приводит к химическому взаимодействию. Для его осуществления молекулы должны обладать достаточным запасом энергии, т. е. должны быть активными. С повышением температуры растет число активных частиц. Энергия, минимально необходимая для осуществления акта взаимодействия, называется энергией активации Eа.
|
|
|
Число активных частиц, а следовательно, и скорость реакции возрастает с температурой по экспоненциальному закону (уравнение Аррениуса):
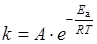 или
или  ,
,
где k – константа скорости реакции; A – коэффициент, формально определяющий константу скорости реакции при нулевой энергии активации; R – универсальная газовая постоянная.
Зная константы скорости реакции k1 и k2 при температурах Т1 и Т2, можно рассчитать энергию активации реакции:
 .
.
Чем больше энергия активации реакции, тем ниже ее скорость.
Химическое равновесие. Реакции, которые могут протекать в двух взаимно противоположных направлениях, называются обратимыми. Состояние системы, когда в ней протекают противоположно направленные процессы с одинаковой скоростью, называется химическим равновесием. Для реакции общего вида
a × A + b × B « mM + nN.
Скорости прямой V1 и обратной реакции V2 определяются следующим образом:
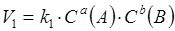 ;
;  .
.
При равновесии V1 = V2, следовательно:
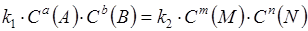
или 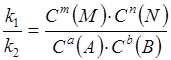 .
.
Отношение констант скоростей k1 / k 2 является также константой и обозначается k1 / k2 = Kc. Величина Kc называется константой равновесия, которая определяет отношение равновесных концентраций продуктов и исходных компонентов в состоянии равновесия. Величина константы равновесия позволяет судить о полноте химического взаимодействия. Если Kс велика, то концентрация продуктов намного превышает концентрацию исходных веществ. Если Kc ® 0, это говорит о практически полном отсутствии взаимодействия.
|
|
|
Для гомогенных газовых реакций при небольших давлениях константа равновесия может быть выражена через парциальные давления компонентов (Kp):
 .
.
Для реакций в гетерогенных системах с участием твердой и газообразной фаз константа равновесия выражается только лишь через парциальные давления газообразных компонентов (как и в законе действия масс), т. е. твердая фаза не учитывается, т. к. реакция идет на поверхности твердой фазы. Например, для реакции
C(г) + CO2(г) « 2CO(г)
 .
.
Смещение химического равновесия. Состояние химического равновесия зависит от ряда факторов, основные из них – температура, концентрация компонентов, давление. При изменении параметров равновесия происходит его смещение. Направление смещения равновесия определяется по принципу Ле-Шателье: При всяком внешнем воздействии на систему, находящуюся в состоянии химического равновесия, в ней протекают процессы, приводящие к уменьшению этого воздействия.
|
|
|
При повышении концентрации исходных веществ равновесие смещается в сторону прямой реакции, в процессе которой их концентрация уменьшается. Повышение концентрации продуктов реакции, наоборот, вызовет смещение равновесия в сторону обратной реакции.
При повышении температуры равновесие смещается в сторону эндотермической реакции. Реакции, сопровождающиеся выделением тепла (экзотермические) лучше протекают при понижении температуры.
Давление оказывает влияние на системы с участием газообразных веществ. Повышение давления вызывает смещение равновесия в сторону реакции, идущей с образованием меньшего числа газообразных молекул, т. е. с уменьшением объема системы. Применение принципа Ле-Шателье можно рассмотреть на примере синтеза аммиака:
3H2(г) + N2(г) « 2NH3(г); (DH < 0).
Процесс идет с выделением тепла, уменьшением числа газообразных молекул. Поэтому для смещения равновесия в сторону прямой реакции необходимо оптимальное понижение температуры, повышение давления, повышение концентрации азота и водорода, отвод из системы аммиака.
Дата добавления: 2021-12-10; просмотров: 17; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
