Типовые примеры решения задач
При решении задач этого раздела используются справочные таблицы физико-химических констант [5].
Пример 1.Газообразный этиловый спирт можно получить при взаимодействии этилена – С2Н4(г) и водяных паров. Напишите термохимическое уравнение этой реакции, вычислив ее DH 0. Сколько теплоты выделится, если в реакцию вступило 10 л С2Н4 в пересчете на нормальные
условия?
Решение.Составим термохимическое уравнение реакции:
С2Н4(г) + H2O(г) = C2H5OH(г); DHх.р = ?
Необходимое значение теплового эффекта реакции вычислим, применяя следствие из закона Гесса:
DH 0298х.р = DH 0298 (C2H5OH(г)) – DH 0298 (С2Н4(г)) – DH 0298 (H2O(г))
Подставляем значения DH 0298 для вышеуказанных веществ [5].
DH 0298х.р = – 235,31 – 52,28 – (– 241,83) = – 45,76 кДж/моль.
Один моль газообразных веществ при нормальных условиях занимает объем 22,4 л (дм3). Используя это следствие закона Авогадро, можно составить пропорцию:
22,4 л этилена выделяет 45,76 кДж теплоты, а 10 л этилена – Х кДж.
Отсюда, при вступлении в реакцию 10 л С2Н4 выделяется 20,43 кДж теплоты.
Пример 2. На основании стандартных теплот образования и абсолютных стандартных энтропий веществ вычислить ∆G 0298 реакции, протекающей по уравнению:
NH3(г) + HCl(г) = NH4Cl(к)
Чем можно объяснить то, что DS < 0?
Решение. DG определяем по формуле:
DG 0 = DH 0 – TDS 0
DH и DS функции состояния, поэтому
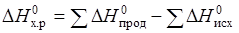
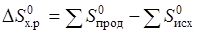
 = DH 0 (NH4Cl) – DH 0 (NH3) – DH 0 (HCl).
= DH 0 (NH4Cl) – DH 0 (NH3) – DH 0 (HCl).
 = S 0 (NH4Cl) – S 0 (NH3) – S 0 (HCl).
= S 0 (NH4Cl) – S 0 (NH3) – S 0 (HCl).
 = – 315,39 – (– 46,19) – (– 92,31) = – 176,89 кДж/моль.
= – 315,39 – (– 46,19) – (– 92,31) = – 176,89 кДж/моль.
 = + 94,5 – 192,50 – 186,68 = – 284,68 Дж/(моль×К).
= + 94,5 – 192,50 – 186,68 = – 284,68 Дж/(моль×К).
|
|
|
DG 0 = – 176,89 – 298 (– 0,2847) = – 92,08 кДж.
Энтропия есть мера неупорядоченности состояния вещества. Объем 1 моля газа гораздо больше, чем объем 1 моля кристаллического вещества, и возможность хаотического движения молекул газа больше, следовательно, при уменьшении объема системы движение молекул затрудняется и энтропия системы уменьшается. В данном примере из двух молей газов получается 1 моль кристаллического вещества – объем системы уменьшается, и DS системы уменьшается.
Пример 3. Восстановление Fe2O3 водородом протекает по уравнению
Fe2О3(к) + 3Н2(г) = 2Fe(к) + 3Н2О(г); ∆H = + 96,61 кДж.
Возможна ли эта реакция при стандартных условиях, если изменение
энтропии DS = 0,1387 кДж/(моль×К)? При какой температуре начнется восстановление Fe2О3?
Решение. Вычисляем DG 0 реакции:
DG = DH – TDS = 96,61 – 298 × 0,1387 = + 55,28 кДж.
Так как DG > 0, то реакция при стандартных условиях невозможна; наоборот, при этих условиях идет обратная реакция окисления (коррозии) железа. Найдем температуру термодинамического равновесия, при которой DG = 0:
DH = TDS ;  .
.
Следовательно, при температуре примерно 696,5 К начнется реакция восстановления Fe2O3. Иногда эту температуру называют температурой начала реакции.
|
|
|
Пример 4. Прямая или обратная реакция будет протекать при стандартных условиях в системе?
СН4(г) + СО2(г) « 2СО(г) + 2Н2(г)
Решение. Для ответа на вопрос следует вычислить DG 0298 прямой реакции. Значения DG 0298 соответствующих веществ даны в [5]. Зная, что DG есть функция состояния и что DG для простых веществ, находящихся в агрегатных состояниях, устойчивых при стандартных условиях, равны нулю, находим DG 0298 процесса:
DG 0298 = 2(– 137,27) + 2 (0) – (– 50,79 – 394,38) = + 170,63 кДж.
То, что DG 0298 > 0, указывает на невозможность самопроизвольного протекания прямой реакции при T = 298 К и равенстве давлений взятых газов 1 атм.
Вопросы для самопроверки
1. Какие свойства системы являются функцией ее состояния? Как формулируется закон Гесса и его следствие?
2. Что такое теплота образования химического соединения?
3. Какое значение имеет DH для экзо- и эндотермических реакций?
4. Что такое энтропия? Как она зависит от агрегатного состояния вещества и температуры?
5. Что имеет большую энтропию: 1 моль кристаллического вещества или 1 моль его паров при той же температуре?
6. Что такое свободная энергия Гиббса? При каких значениях DG 0 реакция идет самопроизвольно?
7. При какой температуре наступит равновесие в системе:
|
|
|
CO(г) + 2H2(г) « CH3OH(ж)
DH 0 = – 128,05 кДж/моль
Ответ: T » 385,5 К.
8. Определить DG и DS реакции 2H2O2(ж) = 2H2O(ж) + O2(г) при стандартных условиях.
Ответ: DG 0 = – 233,62 кДж/моль, DS 0 = 125,6 Дж/моль×К.
Дата добавления: 2021-12-10; просмотров: 24; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
