Предмет молекулярной физики и термодинамики. Термодинамические параметры системы. Идеальный газ. Уравнение состояния идеального газа.
Молекулярная физика – раздел курса общей физики, в котором изучаются макроскопические свойства вещества, обусловленные его молекулярным строением, характером движения молекул и силами, действующими между ними.
В основе молекулярной физики лежит установленное на опыте утверждение: в каком бы состоянии не находилось вещество (твердом, жидком, газообразном), составляющие его молекулы находятся в непрерывном хаотическом (непредсказуемом) движении, которое называют тепловым. Хотя движение любой молекулы вещества подчиняется законам механики, описать движение каждой молекулы из большой совокупности (к примеру, в 1м3 воздуха при нормальных условиях находится 2,7•1025молекул) практически невозможно. В связи с этим в молекулярной физике разработано два взаимно дополняющих друг друга теоретических метода – статистический и термодинамический.
В статистическом методе микроскопические величины, характеризующие движение молекулы (к примеру, ее импульс в данный момент времени), являются непредсказуемыми, случайными. Для построения теории создается гипотетическая модель механизма молекулярного движения и пространственного строения вещества. Затем в этой модели разрабатываются методы нахождения плотности вероятностей тех или иных величин, зная которые вычисляют средние значения этих величин.
В термодинамическом методе исследования вещества, в отличие от статистического, не вводятся в рассмотрение какие-либо модельные представления об атомно-молекулярном строении тела, а ставится своей задачей установление зависимости между непосредственно наблюдаемыми макроскопическими (измеряемыми в опыте) величинами, такими как давление, температура, объем, концентрация, напряженность электрического или магнитного поля и т. п. Термодинамика как теоретическая дисциплина строится на трех фундаментальных законах (началах), установленных на основании огромного опытного знания, относящегося к поведению макроскопических систем. Выводы термодинамики имеют весьма общий характер, независимый от выбора гипотетической модели структуры вещества, независимо от характера движения молекул, взаимодействия между ними. Результаты, получаемые в статистической теории, существенным образом зависят от выбора этой гипотетической модели. Недостатком термодинамического метода является невозможность с помощью его вскрыть молекулярную сущность изучаемых явлений.
|
|
|
Термодинамика ничего не говорит о механизме происходящих в веществе микропроцессов, а только устанавливает связь между макроскопическими характеристиками вещества. Поэтому в настоящее время в молекулярной физике при исследовании макроскопических свойств вещества разрабатываются оба подхода: статистический и термодинамический. Эти исследования взаимно дополняют друг друга, так как у них один и тот же объект исследования – система, состоящая из многих молекул, и одна и та же цель – нахождение зависимостей между макроскопическими величинами системы частиц.
|
|
|
Термодинамические параметры состояния тела
Втермодинамике имеют дело с термодинамическими системами. Под термодинамическойсистемой подразумевается любое конечных размеров макротело или совокупностьмакротел. Под макротелом имеется в виду тело, размеры которого велики посравнению с атомными размерами и которое состоит из огромного числамикрочастиц.
Вотличие от состояния механической системы, определяемого совокупностьюкоординат и скоростей тел, входящих в нее, состояние термодинамической системыопределяется набором значений термодинамических параметров, т.е. физическихвеличин, характеризующих свойства системы в целом. Некоторые из этих величин,как, например, давление и температура, не применимы к микрочастицам, из которыхсостоит термодинамическая система. Термодинамические параметры являютсямакровеличинами, т.е. такими величинами, которые могут быть либонепосредственно измерены с помощью приборов, либо выражены через другие,непосредственно измеряемые на опыте величины. Число параметров, определяющихсостояние системы, зависит от рода системы и внешних воздействий. Состояниепростейших термодинамических систем (однородных газов и жидкостей, неподверженных действию каких-либо полей) определяется давлением, объемом итемпературой.
|
|
|
Идеальный газ — математическая модель газа, в которой предполагается, что потенциальной энергией взаимодействия молекул можно пренебречь по сравнению с их кинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями. Различают классический идеальный газ (его свойства выводятся из законов классической механики и описываются статистикой Больцмана) и квантовый идеальный газ (свойства определяются законами квантовой механики, описываются статистиками Ферми — Дирака или Бозе — Эйнштейна).
|
|
|
Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Клапейрона — Менделеева) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
 , где
, где
§ 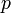 — давление,
— давление,
§ 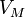 — молярный объём,
— молярный объём,
§  — универсальная газовая постоянная
— универсальная газовая постоянная
§ 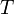 — абсолютная температура,К.
— абсолютная температура,К.
Основное уравнение молекулярно- кинетической теории идеального газа для давления. Следствия из основного уравнения молекулярно-кинетической теории. Молекулярно кинетическое толкование абсолютной температуры.
Основное уравнение МКТ
 , где k является постоянной Больцмана (отношение универсальной газовой постоянной R к числу Авогадро NA), i — число степеней свободы молекул (i = 3 в большинстве задач про идеальные газы, где молекулы предполагаются сферами малого радиуса, физическим аналогом которых могут служить инертные газы), а T - абсолютная температура.
, где k является постоянной Больцмана (отношение универсальной газовой постоянной R к числу Авогадро NA), i — число степеней свободы молекул (i = 3 в большинстве задач про идеальные газы, где молекулы предполагаются сферами малого радиуса, физическим аналогом которых могут служить инертные газы), а T - абсолютная температура.
Основное уравнение МКТ связывает макроскопические параметры (давление, объём, температура) газовой системы с микроскопическими (масса молекул, средняя скорость их движения).
Давле́ние (P) — физическая величина, равная силе F, действующей на единицу площади поверхности S перпендикулярно этой поверхности. В данной точке давление определяется как отношение нормальной составляющей силы Fn, действующей на малый элемент поверхности, к его площади:

Среднее давление по всей поверхности есть отношение силы к площади поверхности:

С точки зрения молекулярно-кинетической теории абсолютная температура есть величина, пропорциональная средней энергии поступательного движения молекулы. <e пост>=3/2kT.
Дата добавления: 2018-02-18; просмотров: 1069; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
