Задание 11. Методом электронного баланса закончите уравнение окислительно-восстановительной реакции. Рассчитайте эквиваленты окислителя и восстановителя в данной реакции.
S + 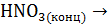
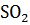 + NO + …
+ NO + …
 S 0 – 4ē → S +4 4 – восстановитель, окисление
S 0 – 4ē → S +4 4 – восстановитель, окисление
N +5 + 3ē → N +2 3 – окислитель, восстановление
3S + 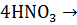
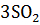 + 4NO +
+ 4NO + 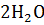
Э( S ) = 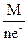 =
= 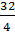 = 8 г/моль-экв
= 8 г/моль-экв
Э( 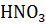 ) =
) = 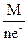 =
=  = 21 г/моль-экв
= 21 г/моль-экв
Задание 12. Напишите уравнения электродных процессов при электролизе водного раствора данной соли с инертными электродами. Рассчитайте массы веществ, выделившихся на катоде и аноде при данной силе тока I за время t .
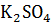 , I = 7A, t = 3 часа = 10800 сек
, I = 7A, t = 3 часа = 10800 сек
Если электролизу подвергается соль активного металла и кислородсодержащей кислоты, то на катоде и на аноде происходит электролитическое разложение воды:
Катодная реакция:  + 2ē →
+ 2ē →  + 2 OH -
+ 2 OH -
Анодная реакция:  – 4ē →
– 4ē → 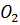 + 4 H +
+ 4 H +
Массы веществ, выделившихся на катоде и аноде, рассчитываются по уравнению Фарадея:
m =  , где М – молярная масса вещества, которое образуется на электроде; I – сила, тока, А; τ – время, сек; n е– – количество электронов, участвующих в электродном процессе; F – число Фарадея, 96500 Кл.
, где М – молярная масса вещества, которое образуется на электроде; I – сила, тока, А; τ – время, сек; n е– – количество электронов, участвующих в электродном процессе; F – число Фарадея, 96500 Кл.
m (  ) =
) =  =
=  = 0,783 г
= 0,783 г
m ( 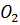 ) =
) =  =
=  = 6,267 г
= 6,267 г
Задание 13. Пользуясь таблицей стандартных электродных потенциалов, составьте схему гальванического элемента, состоящего из двух данных металлов, погруженных в растворы их солей с концентрацией 1М. Напишите уравнения катодного и анодного процессов, токообразующую реакцию и рассчитайте ЭДС этого элемента.
Ti и Fe
По таблице стандартных электродных потенциалов находим:
Е0( Ti 2+ / Ti 0 ) = –1,628В
|
|
|
Е0( Fe 2+ / Fe 0 ) = –0,44В
Е0( Ti 2+ / Ti 0 )< Е0( Fe 2+ / Fe 0 ), следовательно, в данной схеме титан будет являться анодом, а железо – катодом.
Стандартные электродные потенциалы (при 25 °C)
| Электрод | Электродная реакция | eº, В |
| Li+/Li | Li+ + e = Li | -3,045 |
| Rb+/Rb | Rb+ + e = Rb | -2,925 |
| K+/K | K+ + e = K | -2,925 |
| Cs+/Cs | Cs+ + e = Cs | -2,923 |
| Ra+2/Ra | Ra+2 + 2e = Ra | -2,916 |
| Ba+2/Ba | Ba+2 + 2e = Ba | -2,906 |
| Ca+2/Ca | Ca+2 + 2e = Ca | -2,866 |
| Na+/Na | Na+ + e = Na | -2,714 |
| La+3/La | La+3 + 3e = La | -2,522 |
| Mg+2/Mg | Mg+2 + 2e = Mg | -2,363 |
| Be+2/Be | Be+2 + 2e = Be | -1,847 |
| Al+3/Al | Al+3 + 3e = Al | -1,662 |
| Ti+2/Ti | Ti+2 + 2e = Ti | -1,628 |
| V+3/V | V+3 + 3e = V | -1,186 |
| Mn+2/Mn | Mn+2 + 2e = Mn | -1,180 |
| Zn+2/Zn | Zn+2 + 2e = Zn | -0,763 |
| Cr+3/Cr | Cr+3 + 3e = Cr | -0,744 |
| Fe+2/Fe | Fe+2 + 2e = Fe | -0,44 |
| Cd+2/Cd | Cd+2 + 2e = Cd | -0,403 |
| Co+2/Co | Co+2 + 2e = Co | -0,277 |
| Ni+2/Ni | Ni+2 + 2e = Ni | -0,25 |
| Sn+2/Sn | Sn+2 + 2e = Sn | -0,136 |
| Pb+2/Pb | Pb+2 + 2e = Pb | -0,126 |
| Fe+3/Fe | Fe+3 + 3e = Fe | -0,036 |
| H+/1/2H2 | H+ + e = 1/2H2 | 0 |
| Ge+2/Ge | Ge+2+2e = Ge | 0,01 |
| Cu+2/Cu | Cu+2 + 2e = Cu | 0,337 |
| Cu+/Cu | Cu+ + e = Cu | 0,521 |
| Ag+/Ag | Ag+ + e = Ag | 0,799 |
| Hg+2/Hg | Hg+2 + 2e = Hg | 0,854 |
| Pd+2/Pd | Pd+2 + 2e = Pd | 0,987 |
| Pt+2/Pt | Pt+2 + 2e = Pt | 1,2 |
| Au+3/Au | Au+3 + 3e = Au | 1,498 |
| Au+/Au | Au+ + e = Au | 1,691 |
Составляем схему гальванического элемента:
Ti 0│ Ti2+  Fe2+│ Fe 0
Fe2+│ Fe 0
Анодный процесс: Ti 0 – 2ē → Ti 2+
Катодный процесс: Fe 2+ + 2ē → Fe 0
Токообразующая реакция (ТОР): Ti 0 + Fe 2+ → Ti 2+ + Fe 0
|
|
|
Расчет потенциала данного металла, погруженного в раствор его соли с концентрацией СМ проводится с помощью уравнения Нернста:
ЕМе n + /Ме 0 = Е0Ме n + /Ме 0 + 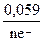 ∙ lgCM :
∙ lgCM :
Е0( Ti 2+ / Ti 0 ) = –1,628В, СМ (раствора соли)=1 моль/л
электродный процесс: Ti 0 – 2ē → Ti 2+
Е Ti 2+ / Ti 0 = Е0 Ti 2+ / Ti 0 + (0,059 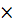 lg 1)/2 = –1,628В + 0 = –1,628В.
lg 1)/2 = –1,628В + 0 = –1,628В.
Е0( Fe 2+ / Fe 0 ) = –0,44В, СМ (раствора соли)= 1 моль/л
электродный процесс: Fe 2+ + 2ē → Fe 0
Е Fe 2+ / Fe 0 = Е0 Fe 2+ / Fe + 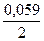 ∙ lg 1 = –0,44В + 0 = –0,44В
∙ lg 1 = –0,44В + 0 = –0,44В
Электродвижущая сила реакции (ЭДС):
ЭДС = Е0( Fe 2+ / Fe 0 ) – Е0( Ti 2+ / Ti 0 ) = –0,44В – (–1,628В) = 1,188 В
Задание 14. Пользуясь таблицей стандартных электродных потенциалов (из задания 13), подберите анодное и катодное покрытие для данного металла. Напишите уравнение коррозии, протекающей
а) на воздухе;
Б) во влажном воздухе
В) в кислой среде
Cd (кадмий)
Анодным покрытием для кадмия может быть любой металл, потенциал которого меньше, чем потенциал кадмия: E0Cd+2/Cd0 = -0,403 В. Например, можно выбрать для анодного покрытия цинк E0Zn+2/Zn0 = -0,763 В. И тогда, даже при наличие небольших повреждений покрытия, он будет подвергаться коррозии, защищая основной металл от разрушения.
При коррозии разрушается именно цинк. В случае оцинкованного кадмия происходят процессы:
|
|
|
Анодный процесс: Zno – 2ē → Zn2+
Катодный процесс: O2 + 2H2О + 4ē →4OH-
Суммарное уравнение: 2Zn + О2 + Н2О→ 2Zn(OH)2
В кислой среде окисление цинка протекает по реакции:
Zn 0 + 2 H + → Zn +2 + Н2
В нейтральной среде: Zn 0 +2 Н2О → Zn (ОН)2+ Н2
В щелочной среде цинк, являясь амфотерным элементом, будет образовывать комплексное соединение:
Zn 0 +2 Н2О + 2ОН- → [ Zn (ОН)4]2-+ Н2
Если потенциал покрытия, Епкр> Е Ме , покрытие является катодным. например, кадмий покрывают Cu , А g , Sn , Ni . В этом случае коррозии кадмия не происходит только, если покрытие целостно, на нём нет пор, трещин, механических повреждений. В случае нарушения покрытия под ним происходит разрушение защищаемого металла.
В качестве катодного покрытия кадмия можно выбрать олово:
E0Cd+2/Cd0 = -0,403 В E0Sn+2/Sn0 = -0,136 В
Процессы коррозии (во влажном воздухе):
Анодный процесс: Cdo – 2ē → Cd2+
Катодный процесс: O2 + 2H2О + 4ē →4OH-
Суммарное уравнение процесса коррозии:
2Cd + O2 + 2H2O → 2Cd(OH)2
Процесс восстановления О2 идет на катоде: на металле, обладающем более положительным значением электродного потенциала.
Уравнения процесса коррозии данного металла:
При взаимодействии с нейтральными растворами коррозия кадмия проходит с кислородной деполяризацией. При контакте с морской водой или атмосферой кадмий не разрушается. Коррозия кадмия в сухой атмосфере не протекает, а во влажной металл покрывается оксидом CdO. При повышении температуры больше 321 ºС (температуры плавления) металл, вступая в реакцию с воздухом, горит, образуя бурый оксид:
|
|
|
2Сd + O2 → 2CdO
Коррозия кадмия также протекает в кислотах. Взаимодействие металла и кислоты проходит очень медленно. Наибольшая скорость коррозии кадмия (кислая среда) наблюдается при взаимодействии с азотной кислотой по реакции:
3Cd + 8HNO3 → 3Cd(NO3)2 + 2NO↑ + 4H2O.
С соляной кислотой кадмий медленно реагирует:
Сd + 2HCl → CdCl2 + H2↑
Дата добавления: 2021-06-02; просмотров: 86; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
