В) Влияние изменения концентрации на смещение химического равновесия.
Согласно принципу Ле Шателье увеличение концентрации любого из участников реакции вызывает смещение равновесия в сторону той реакции, которая приводит к уменьшению концентрации этого вещества.
- при повышении концентрации одного из исходных веществ возрастает скорость прямой реакции и равновесие сдвигается в направлении образования продуктов реакции и наоборот;
- при повышении концентрации одного из продуктов реакции возрастает скорость обратной реакции, что приводит к смещению равновесия в направлении образования исходных веществ и наоборот.
Поэтому при уменьшении концентрации воды равновесие смещается в сторону прямой реакции:
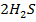 (г) +
(г) + 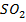 (г)
(г) 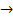 3S(ТВ) +
3S(ТВ) +  (г) + Q
(г) + Q
В гетерогенных реакциях учитываются только концентрации газов.
Начальная концентрация  равна 5 моль/л, начальная концентрация
равна 5 моль/л, начальная концентрация  равна 2 моль/л, а к моменту наступления равновесия прореагировало 50% сероводорода.
равна 2 моль/л, а к моменту наступления равновесия прореагировало 50% сероводорода.
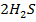 (г) +
(г) + 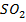 (г)
(г) 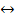 3S(ТВ) +
3S(ТВ) +  (г)
(г)
Равновесная концентрация 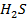 рассчитывается:
рассчитывается:
Сравн = Снач – 0,5 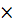 Снач = 2,5 моль/л,
Снач = 2,5 моль/л,
а равновесная концентрация SO 2 : для образования продуктов SO 2 затрачивается в два раза меньше, чем сероводорода (исходя из стехиометрических коэффициентов в уравнении реакции)
Сравн = Снач - Спрореаг = 2 - 0,5  Спрореаг
Спрореаг  )= 2 – 0,5
)= 2 – 0,5  = 0,75 моль/л.
= 0,75 моль/л.
Равновесная концентрация 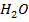 будет равна Спрореаг
будет равна Спрореаг  ) т.е. 2,5 моль/л
) т.е. 2,5 моль/л
Выражение для константы равновесия данной реакции имеет следующий вид:
|
|
|
Кр =  =
=  = 1,33
= 1,33
Задание 10. Для данной реакции рассчитайте изменение энтальпии  , энтропии
, энтропии  и энергии Гиббса
и энергии Гиббса  . Рассчитайте температурную область самопроизвольного протекания реакции.
. Рассчитайте температурную область самопроизвольного протекания реакции.
(Для расчета используйте данные таблицы стандартных термодинамических потенциалов)
Термодинамические потенциалы некоторых веществ
| Вещество | DHo298 кДж моль | So298 Дж моль∙К | Вещество | DHo298 кДж моль | So298 Дж моль∙К |
| CO (г) | -110,5 | 197,4 | H2 (г) | 0 | 130,6 |
| CO2 (г) | -393,51 | 213,6 | O2 (г) | 0 | 205,03 |
| Вещество | DHo298 кДж моль | So298 Дж моль∙К | Вещество | DHo298 кДж моль | So298 Дж моль∙К |
| H2O (к) | -291,85 | 44,1 | O3 (г, озон) | 142,3 | 238,8 |
| H2O (ж) | -285,84 | 69,96 | C (графит) | 0 | 5,74 |
| H 2O (г) | -241,84 | 188,74 | C (алмаз) | 1,897 | 2,38 |
| H2O2 (ж) | -187,02 | 105,86 | N2 (г) | 0 | 191,5 |
| H2S (г) | -20,15 | 205,64 | Cl2 (г) | 0 | 223,0 |
| H2SO4 (ж) | -805 | 156,9 | Al (к) | 0 | 28,31 |
| Al2O3 (к) | -1675 | 50,94 | Mg (к) | 0 | 32,55 |
| CaO (к) | -635,1 | 39,7 | Fe (т) | 0 | 27,15 |
| CaCO3 (т) | -1206 | 92,9 | S (ромбическая) | 0 | 31,88 |
| FeO (т) | -263,68 | 58,79 | СН4 (г) метан | -74,85 | 186,19 |
| Fe2O3 (к) | -821,32 | 89,96 | С2Н2 (г) ацетилен (этин) | 226,8 | 200,8 |
| HCl (г) | -92,30 | 186,70 | С2Н4 (г) этилен (этен) | 52,28 | 219,4 |
| MgO (к) | -601,24 | 26,94 | С2Н6 (г) этан | -84,67 | 229,5 |
| MgCO3 (т) | -1096,21 | 65,69 | ССl4 (г) тетрахлорметан | -106,7 | 309,7 |
| NH3 (г) | -46,9 | 192,50 | СН4О (ж) метиловый спирт | -238,7 | 126,7 |
| NO (г) | 90,37 | 210,62 | СН4О (г) метиловый спирт | -201,2 | 239,7 |
| NO2 (г) | 33,89 | 240,45 | С2Н6О (ж) этиловый спирт | -277,6 | 160,7 |
| N2O4 ( г) | 9,37 | 304,3 | С2Н6О (г) этиловый спирт | -235,3 | 282,0 |
| SO2 (г) | -296,9 | 248,1 | С2Н4О2 (ж) уксусная к-та | -484,9 | 159,8 |
| SO3 (г) | -395,2 | 256,23 | С2Н4О2 (г) уксусная к-та | -437,4 | 282,5 |
| COCl2(г) | -223,0 | 289,2 | CH3–CHO(ж) | -166,0 | 264,2 |
| Si(тв) | 0 | 18,72 | C6H6(ж) бензол | 49,04 | 173,2 |
| SiO2(т) | -859,3 | 42,09 | NH4Cl(т) | -315,39 | 94,56 |
| Al2O3(т) | -1675 | 50,94 | SiH4(г) | 34,7 | 204,56 |
MgO (тв) +  (г)
(г) 
 (тв)
(тв)
|
|
|
Расчет энтальпии (ΔН298°):
Δ Н°298=Σ ΔНпродуктов реакции – Σ ΔНреагентов
из приложения Таблицы стандартных термодинамических потенциалов выбираем значения ΔН°298 для веществ, участвующих в реакции и подставляем их в расчетную формулу:
Δ Н°298=Σ ΔНпродуктов реакции – Σ ΔНреагентов= ΔН298° (  ) - ΔН298°(СО2) –
) - ΔН298°(СО2) –
- ΔН298° (MgO) = -1096,21 –(-393,51)-(-601,24) = -101,46 кДж/моль
Расчет энтропии (Δ S ° 298 ):
Δ S ° 298 =Σ Δ S продуктов реакции – Σ Δ S реагентов
из таблицы стандартных термодинамических потенциалов выбираем значения Δ S ° 298 для веществ, участвующих в реакции и подставляем их в расчетную формулу:
Δ S ° 298 =Σ Δ S продуктов реакции – Σ Δ S реагентов = Δ S ° 298 (  ) - Δ S ° 298 (СО2) - Δ S ° 298 (MgO) =65,69 – 26,94 – 213,6 = -174,85
) - Δ S ° 298 (СО2) - Δ S ° 298 (MgO) =65,69 – 26,94 – 213,6 = -174,85  = -0,17485
= -0,17485 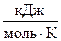 .
.
|
|
|
Расчет энергии Гиббса (Δ G ° 298 ):
Δ G ° 298 = ΔН°298 – T ∙Δ S ° 298
по полученным данным рассчитываем энергию Гиббса (при стандартных условиях Т = 298К):
Δ G ° 298 = ΔН°298 – T ∙Δ S ° 298 = -101,46 кДж/моль – 298К∙(-0,17485 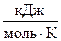 )=
)=
= -49,3547 кДж/моль.
Определение температурной области самопроизвольного протекания реакции:
реакция протекает самопроизвольно, если Δ G ° 298 ≤ 0, следовательно:
Δ Н°298– T ∙ Δ S ° 298 ≤ 0, отсюда
Т ≥ 
Т ≥ 
Т ≥  580,27 К, т.е. самопроизвольное протекание реакции возможно при температуре, больше 580,27 К.
580,27 К, т.е. самопроизвольное протекание реакции возможно при температуре, больше 580,27 К.
Дата добавления: 2021-06-02; просмотров: 82; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
