Количественные характеристики диссоциации
Количественными характеристиками диссоциации являются степень диссоциации α и константа диссоциации Кд.
Степень диссоциации αд – это число, показывающее, какая часть молекул электролита находится в растворе в виде ионов.
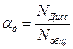 или
или 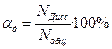 ,
,
где: Nдисс – число продиссоциировавших молекул; Nобщ – общее число молекул растворенного вещества.
По степени диссоциации электролиты делятся на:
слабые αд ‹ 3% (H2CO3, HNO2, H2S, Cu(OH)2, Fe(OH)3идр.);
средние αд от 3 до 30% (H3PO4 и др.);
сильные αд › 30% (HCl, HNO3, H2SO4, NaOH, КОН, Ва(ОН)2 и др).
Решение.
а)KOH - гидроксид калия, класс – основания, сильный электролит,
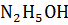 – гидрат гидразина, класс – основание, слабый электролит.
– гидрат гидразина, класс – основание, слабый электролит.
Уравнение диссоциации: К OH ↔ К+ + OH -
Расчет рН:
К OH – сильное основание, поэтому [ OH - ] = CM (К OH ) = 0,35 M
р O Н= - lg [ OH - ] = - lg (0,35) = 0,456
рН = 14 - р O Н = 14 – 0,456 = 13,544(среда раствора щелочная)
Уравнение диссоциации: 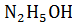 , ↔
, ↔ 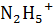
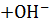
Расчет рН:
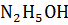 – слабое основание, поэтому [
– слабое основание, поэтому [  ] ≠ CM (
] ≠ CM ( 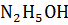 ), для расчета концентрации [
), для расчета концентрации [  ] используется формула
] используется формула 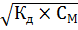
 = 0,35 M, Кд = 3,2
= 0,35 M, Кд = 3,2 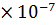 .
.
[  ] =
] = 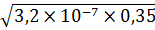 = 3,35
= 3,35 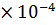
рОН = - lg [  ] = - lg (3,35
] = - lg (3,35 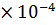 ) = 3,47
) = 3,47
рН = 14 - р O Н = 14 – 3,47 = 10,53 (среда раствора щелочная).
Задание 7. Для данной соли напишите уравнения гидролиза по первой ступени в молекулярной форме, полной и краткой ионной форме, определите тип гидролиза, рассчитайте константу гидролиза, степень гидролиза и pH раствора этой соли.
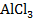 ,
, 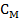 = 0,03 M, Кд = 1,38
= 0,03 M, Кд = 1,38 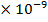
Гидролиз – это обменное взаимодействие соли с водой с образованием слабого электролита, сопровождающееся изменением рН среды. Гидролиз может происходить по катиону и по аниону. Тип гидролиза определяется слабым электролитом, а реакция среды – сильным электролитом.
|
|
|
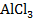 – соль образована слабым основанием и сильной кислотой, протекает гидролиз по катиону:
– соль образована слабым основанием и сильной кислотой, протекает гидролиз по катиону:
уравнение гидролиза по первой ступени в молекулярной форме:
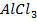 + Н2О ↔
+ Н2О ↔ 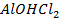 + Н Cl
+ Н Cl
уравнение гидролиза по первой ступени в краткой ионной форме:
Al3 + + Н2О ↔ Al ОН 2+ + Н+
уравнение гидролиза по первой ступени в полной ионной форме:
Al 3+ + 3 Cl - + Н2О ↔ Al ОН2+ + Н+ + 3 Cl -
Для расчета требуется Кд основания. Т.к. на первой ступени гидролиза образуется ион Al ОН+, то для расчета используется Кд основания
КГ =  =
=  = 7,25
= 7,25 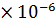
αГ= 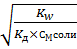 =
= 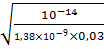 = 0,0155=1,55%
= 0,0155=1,55%
[ H + ] =  =
=  =0,000466 моль/л
=0,000466 моль/л
рН =- lg [Н+] = - lg (0,000466) = 3,33 (среда раствора кислая)
Задание 8. Для данной химической реакции напишите кинетическое уравнение и определите теоретический порядок реакции. Рассчитайте, как изменится скорость реакции при указанных изменениях условий протекания реакции.
2S(ТВ) + 2  (г)
(г) 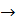
 (г) + + 2
(г) + + 2 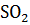 (г)
(г)
Во сколько раз изменится (увеличится или уменьшится) скорость реакции если:
а) уменьшить концентрации газовых реагентов в 4 раза;
б) понизить температуру со 120 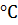 до
до 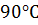 (γ = 3)
(γ = 3)
|
|
|
Кинетическое уравнение: υ1= k ∙с2(  ), k – константа скорости. В кинетическое уравнение гетерогенных реакций входят только концентрации газов или растворенных в растворителе веществ.
), k – константа скорости. В кинетическое уравнение гетерогенных реакций входят только концентрации газов или растворенных в растворителе веществ.
Теоретический порядок реакции: 2 ( Сумма показателей степеней концентраций в кинетическом уравнении называется теоретическим порядком реакции).
Расчет изменения скорости реакции:
а) при уменьшении концентрации газовых реагентов в 4 раза:
скорость реакции до увеличения давления описывается кинетическим уравнением:
υ1= k ∙с2(  ), где с2(
), где с2(  ) – начальная (исходная) концентрация оксида азота (4).
) – начальная (исходная) концентрация оксида азота (4).
При уменьшении концентрации в 4 раза уравнение реакции имеет следующий вид:
υ2= k ∙(1/4с)2(  ), где (1/4с)2(
), где (1/4с)2(  ) концентрация оксида азота (4) после уменьшения концентрации в системе в 4 раза.
) концентрация оксида азота (4) после уменьшения концентрации в системе в 4 раза.
Изменение скорости реакции ( 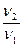 ) :
) :
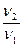 =
= 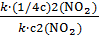 =
= 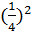 =
=  ; скорость реакции уменьшилась в 16 раз
; скорость реакции уменьшилась в 16 раз
б)понижение температуры на 30˚С (γ = 3):
При изменении температуры скорость реакции изменяется по правилу Вант-Гоффа:
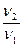 = γΔТ/10, где γ- температурный коэффициент реакции, ΔТ – изменение температуры (Т2 – Т1), υ1 – скорость реакции при температуре Т1,υ2 – скорость реакции при температуре Т2.
= γΔТ/10, где γ- температурный коэффициент реакции, ΔТ – изменение температуры (Т2 – Т1), υ1 – скорость реакции при температуре Т1,υ2 – скорость реакции при температуре Т2.
|
|
|
По данным условия задачи температура понизилась на 30˚С, следовательно
ΔТ =Т2 – Т1 =-30,
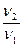 = 3-30/10 = 3-3 =
= 3-30/10 = 3-3 =  – скорость реакции уменьшитсяв 27 раз.
– скорость реакции уменьшитсяв 27 раз.
Задание 9. Решите задачу.
Для обратимой реакции 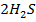 (г) +
(г) + 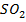 (г)
(г) 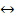 3S(ТВ) +
3S(ТВ) +  (г) + Q определите, в какую сторону сместится равновесие реакции, если:
(г) + Q определите, в какую сторону сместится равновесие реакции, если:
а) увеличить давление;
б) увеличить температуру;
в) уменьшить концентрацию 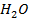
Рассчитайте константу равновесия данной реакции, если начальная концентрация 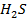 равна 5 моль/л, начальная концентрация
равна 5 моль/л, начальная концентрация 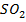 равна 2 моль/л, а к моменту наступления равновесия прореагировало 50% сероводорода.
равна 2 моль/л, а к моменту наступления равновесия прореагировало 50% сероводорода.
Направление, в котором смещается химическое равновесие, определяется по принципу Ле Шателье: если на равновесную систему оказывать внешнее воздействие, то равновесие смещается в сторону, противодействующую этому воздействию.
А) Согласно принципу Ле Шателье повышение давления приводит к смещению равновесия в сторону образования меньшего количества газообразных частиц, т.е. в сторону меньшего объема.
Б)Увеличение температуры смещает равновесие в сторону эндотермической реакции (– Q ), уменьшение температуры смещает равновесие в сторону экзотермической реакции (+ Q ).
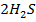 (г) +
(г) + 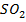 (г)
(г)  3S(ТВ) +
3S(ТВ) +  (г) + Q
(г) + Q
В данном случае
|
|
|
прямая реакция 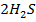 (г) +
(г) + 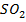 (г)
(г)  3S(ТВ) +
3S(ТВ) +  (г) + Q - экзотермическая,
(г) + Q - экзотермическая,
обратная реакция 3S(ТВ) +  (г) →
(г) → 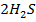 (г) +
(г) + 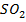 (г) – Q -эндотермическая,следовательно:
(г) – Q -эндотермическая,следовательно:
при увеличении температуры равновесие сместится в сторону обратной реакции (в сторону образования реагентов, влево(←))
Дата добавления: 2021-06-02; просмотров: 232; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
