Характеристика электродных систем различных методов титрования хлорида аммония
| метод титрования | индикаторный электрод | электрод сравнения |
| кислотно-основной | стеклянный, хингидронный, сурьмяный, водородный | каломельный, хлорсеребряный |
| осадительный | металлические (серебряный, платиновый), ионселективные | каломельный, хлорсеребряный |
При работе с обычной бюреткой титрант прибавляют по 1-2 капли до нахождения конечной точки титрования.
Отмечают общий объём титранта V2 и вычисляют объём 1 капли V3, исходя из общего числа капель m:
V3 = (V2 - V1)/m
Объём титранта, отвечающий конечной точке титрования, находят по формуле:
VTP = V1 + [(m + n/2)V3],
где: m - число капель, прибавленное до скачка потенциала; n - число капель, вызвавшее скачок потенциала. Результаты измерений заносят в таблицу. Для нахождения точки эквивалентности по полученным данным строят одну из возможных графических кривых титрования.
Типы кривых титрования
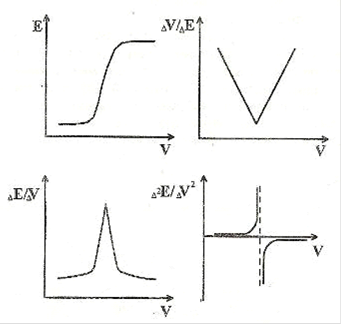
Потенциометрическое определение хлорида аммония. Определение основано на установлении точки эквивалентности при титровании хлорида аммония раствором нитрата серебра (метод Гей-Люссака) по резкому изменению потенциала системы.
NH4Cl + AgNO3 → AgCl↓ + NH4NO3э = 1 = cэAgNO3×MэNH4Cl×VAgNO3×КпAgNO3 / 1000
ω = Q × 100% / a
Хроматографический метод. Для количественного анализа хлорида аммония используется газовая хроматография, т.к. при нагревании до 338˚С он полностью распадается на NH3 и HCl.
|
|
|
Газовая хроматография - метод разделения и определения летучих соединений.
Исследуемая проба хлорида аммония (0,1-1 мкл) микрошприцом или дозатором вводится в поток газа-носителя, в специальном устройстве (нагревателе) выделяется NH3 и в токе газа проходит через колонку с сорбентом, где многократно протекают процессы сорбции, десорбции и распределения. Аммиак током газа-носителя элюируется из колонки, регистрируется детектором, в котором изменение состава проходящей через него смеси преобразуется в изменение выходного сигнала, и автоматически фиксируется самописцем на бумаге в виде пиков.
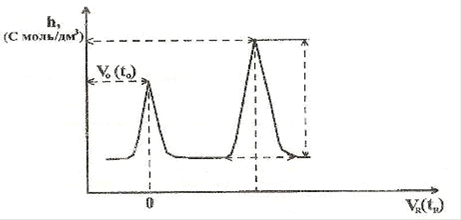
0(t0)
hNH3
aNH3
NH3
Результаты рассчитывают по формуле:
ωx% = Sx×100%/Sст; Sx = 1/2 a×h
где: Sx - площадь пика анализируемых образца;
Sст - площадь пика стандартного образца;
a - основание пика; h - высота пика.
Ионообменная хроматография основана на обратимом стехиометрическом обмене ионов в растворах электролитов на подвижные ионы ионообменного сорбента - ионита.
Для хроматографирования хлорида аммония используется колонка, заполненная катионитом. Определение хлорида аммония основано на обратимом обмене катионов аммония в растворе хлорида аммония на подвижные ионы водорода ионообменного сорбента.
|
|
|
Катионит-Н + NH4Cl ↔ Катионит-NH4 + HCl
HCl + NaOH ↔ NaCl + H2O
Индикатор: метиловый оранжевый
fэ = 1
Q = cэNaOH×MэHCl×VNaOH×КпNaOH / 1000
ω = Q × 100% / а
Метод анализа вещества по ослаблению падающего излучения называют турбидиметрическим. Турбидиметрическим методом можно определить хлорид ионы в составе хлорида аммония.
Перед началом анализа хлорид-ионы переводят в малорастворимое соединение (хлорид серебра), которое находится в виде взвеси.
При турбидиметрических измерениях величина S, называемая мутностью, соответствует оптической плотности и определяется из соотношения, аналогичного закону Бугера-Ламберта-Бера:
S = lg I0/I = kbN,
Где k - коэффициент мутности; b - длина пути; N - число рассеивающих частиц.
Метод, в котором содержание вещества находят по интенсивности рассеянного излучения, называют нефелометрическим. Нефелометрическим методом можно определить хлорид ионы в составе хлорида аммония.
Перед началом анализа хлорид-ионы переводят в малорастворимое соединение (хлорид серебра), которое находится в виде взвеси.
c = I/kαI0,
где с - концентрация; kα - эмпирическая константа системы;α - угол, под которым проводят измерения.
|
|
|
Дата добавления: 2021-04-24; просмотров: 141; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
