Инструментальные методы анализа
Фотоколориметрический метод.
Метод применяется для количественного анализа хлорида аммония, так как NH4Cl образует окрашенные продукты реакции при взаимодействии с реактивом Несслера (определение по фотометрической реакции).
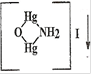
NH4Cl + 2K2[HgI4] + 4KOH ↔ + KCl + 7 KI + 3H2O
Для определения хлорида аммония готовят его стандартный раствор с титром 3 мг/см3. В пять мерных колб вместимостью 50 см3 вносят из быретки 1, 2, 3, 4 и 5 см3 приготовленного стандартного раствора хлорида аммония, прибавляют равное количество реактива Несслера. Доводят объём мерных колб дистиллированной водой до метки, перемешивают.
Измеряют оптическую плотность эталонного раствора №3 на фотоколориметре относительно раствора сравнения (дистиллированной воды) при разных длинах волн (светофильтрах). Проводят два параллельных измерения, результаты заносят в таблицу:
| № светофильтра | λ светофильтра, нм | А1 | А2 | Асреднее |
| 1 | 400 | |||
| 2 | 440 | |||
| 3 | 490 | |||
| 4 | 540 | |||
| 5 | 590 |
По полученным данным строят график зависимости оптической плотности раствора от длины волны. Для дальнейшей работы выбирают ту длину волны λmax, при которой наблюдается максимум оптической плотности на полученном спектре.
Измеряют оптическую плотность приготовленных эталонных растворов при выбранной, аналитической длине волны относительно дистиллированной воды, проводят два параллельных измерения и заносят результаты в таблицу:
|
|
|
| № эталонного раствора | Т, мг/см3 | См, моль/дм3 | А1 | А2 | Асреднее | εi |
| 1 | 0,0600 | |||||
| 2 | 0,1200 | |||||
| 3 | 0,1800 | |||||
| 4 | 0,2400 | |||||
| 5 | 0,3000 |
Рассчитывают молярный коэффициент поглощения для каждого эталонного раствора:
ε = A/CMi×l
Из пяти рассчитанных значений молярных коэффициентов поглощения находят среднее значение.
По полученным данным строят градуировочный график, откладывая на оси абсцисс титр (Т, мг/см3) растворов, а но оси ординат - оптическую плотность А.
Определение концентрации NH4Cl в растворе
Точный объём раствора помещают в мерную колбу вместимостью 50 см3, прибавляют реактив Несслера. Доводят объём дистиллированной водой до метки, перемешивают. Измеряют оптическую плотность полученного раствора в ранее найденных условиях.
. По градуировочному графику находят концентрацию (Т, мг/см3) анализируемого раствора и делают пересчет на молярную концентрацию:
|
|
|
См = Т(г/см3)×1000/M; Т(г/см3) = Т(мг/см3)/1000.
. Рассчитывают концентрацию анализируемого раствора по значению молярного коэффициента поглощения ε:
См = А/εср×l.
. Рассчитывают концентрацию анализируемого раствора по способу стандарта, используя экспериментальные данные выбранного эталонного раствора (Аст, Сст):
См = Сст×АХ/Аст.
Рефрактометрия - оптический метод анализа, основанный на измерении показателя преломления светового луча исследуемым веществом на границе раздела двух различных оптических сред.
Показателем преломления называют отношение скорости распространения света в испытуемом веществе.
Различная скорость распространения света в различных средах вызывает изменение его направления при переходе из одной среды в другую, т.е. рефракцию.
Характер преломления светового луча на границе раздела двух сред

По известному закону рефракции относительный показатель преломления - постоянная величина для данного вещества, равная отношению синусов угла падения (α) и угла преломления (β) и отношению скоростей распространения света в этих средах:
n = sinα / sinβ = V1/V2
Рефрактометрическое определение хлорида аммония в водном растворе.
|
|
|
В градуировочных пробирках готовят 10 разведений 10% стандартного раствора хлорида аммония согласно таблице.
На призму рефрактометра наносят несколько капель воды и по шкале находят показатель преломления (проверка работы рефрактометра: nD20H2O = 1,333).
Вытирают призму досуха, наносят на неё несколько капель испытуемого раствора и наводят границу света и тени на центр визирного креста. По шкале находят показатель преломления, проводя определение 2-3 раза с новой порцией раствора, и средний результат заносят в таблицу.
| объём стандартного раствора, см3 | объём воды, см3 | концентрация вещества в полученном разведении, % | nD20 | Fi |
| 1 | 9 | 1 | ||
| 2 | 8 | 2 | ||
| 3 | 7 | 3 | ||
| 4 | 6 | 4 | ||
| 5 | 5 | 5 | ||
| 6 | 4 | 6 | ||
| 7 | 3 | 7 | ||
| 8 | 2 | 8 | ||
| 9 | 1 | 9 | ||
| 10 | 0 | 10 |
По полученным данным: 1. Строят калибровочный график зависимости показателя преломления от концентрации стандартного раствора хлорида аммония; 2. Рассчитывают рефрактометрический фактор пересчета для каждой концентрации стандартного раствора
F = nст - n0 / Сст
|
|
|
. Рассчитывают среднее значение рефрактометрического фактора пересчета анализируемого вещества
Fср = 1/n ΣFi
. Затем измеряют показатель преломления раствора вещества неизвестной концентрации и определяют его концентрацию по:
градуировочному графику;
рефрактометрическому фактору пересчета
Cx = nx - n0 / Fср;
рефрактометрическим таблицам показателей преломления.
Потенциометрические методы анализа основаны на использовании зависимости ЭДС электрохимической ячейки от концентрации хлорида аммония в растворе.
В идеальном случае эта зависимость оценивается уравнением Нернста:
= E0 + 0,059×lg([Ox]a/[Red]b)/n
Измеряют ЭДС специально подобранной электродной пары, состоящей из индикаторного электрода и электрода сравнения, опущенных в раствор хлорида аммония, компенсационным или некомпенсационным способами.
В аналитической практике применяют прямую и косвенную потенциометрию (потенциометрическое титрование).
Прямая потенциометрия - метод определения концентрации ионов хлора Cl-, основанный на измерении электрохимического потенциала индикаторного электрода, погруженного в раствор хлорида аммония.
Концентрацию ионов хлора в растворе хлорида аммония находят по градуировочному графику, построенному в координатах E - pC (C - концентрация стандартных растворов) или расчетным путем, используя уравнение, описывающее зависимость потенциала электрода от активности (концентрации) ионов хлора в растворе:
E = E0 + 0,059×lg(CCl-)/n
Косвенная потенциометрия (потенциометрическое титрование) основана на установлении точки эквивалентности по резкому изменению (скачку) потенциала в процессе титрования. При этом выбор электродной системы определяется типом аналитической реакции, потенциал индикаторного электрода должен зависеть от концентрации ионов, принимающих участие в реакции или образующихся в процессе титрования.
Дата добавления: 2021-04-24; просмотров: 119; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
