Количественный химический анализ
Содержание
Описание вещества
Качественный химический анализ катиона NH4+
Качественный химический анализ аниона Cl-
Количественный химический анализ
Гравиметрический анализ
Тириметрический анализ
Инструментальные методы анализа
Применение хлорида аммония в фармации
Список литературы
Описание вещества
Аммония хлорид (NH4Cl) - белый кристаллический, слегка гигроскопичный порошок без запаха; "холодящего" солоноватого вкуса.
Молекулярная масса 53,49.
При нагревании до 338 °C полностью распадается на NH3 и HCl.
Легко растворим в холодной воде (1:3), ещё легче - в горячей (1:1,3). Растворы имеют слабокислую реакцию; хорошо растворим в жидком аммиаке.

Качественный химический анализ катиона NH 4 +
Катион аммония (NH4+) относится к первой аналитической группе катионов. Катион аммония благодаря своему строению обладает рядом отличительных свойств.
. Катион аммония неустойчив в основной среде:
NH4+ + OH- ↔ NH3↑ + H2O
Эта реакция используется в анализе для обнаружения и удаления иона NH4+.
. Катион аммония обладает восстановительными свойствами:
NH4+ + 4Cl2 ↔ N2↑ + 8HCl
В качестве окислителей могут быть использованы хлор, хлорамин, гипохлориты (например, NaClO), хлорная известь и другие реагенты.
. Соли аммония термически нестойки: при прокаливании они разлагаются с образованием газообразных азотсодержащих продуктов. Реакция протекает без изменения степени окисления элементов, если соль образована кислотой, не являющейся окислителем.
|
|
|
4Cl ↔ NH3↑ + HCl↑
(NH4)2CO3 ↔ 2NH3↑ + CO2↑ + H2O
Реакция протекает с изменением степени окисления элементов, если присутствует анион кислоты-окислителя.
4NO3 ↔ N2O↑ + 2H2O
В анализе эти реакции используют для удаления катиона аммония.
. Водный раствор аммиака является слабым основанием, соли аммония и сильных кислот гидролизованы по катиону (pH < 7).
4+ + HOH ↔ NH4OH + H+
Реакция с гидроксидом натрия (ГФ).
NH4Cl + NaOH ↔ NH3↑ + H2O + NaCl
Реакцию проводят в пробирке или "газовой камере" ("висячая капля"). Реакция специфична.
Методика проведения реакции в "газовой камере": в тигель помещают 3-5 капель раствора хлорида аммония и такое же количество щёлочи. На предметное стекло прикрепляют кусочек влажной лакмусовой бумаги или фильтровальной бумаги, смоченной фенолфталеином. Закрывают тигель стеклом и осторожно нагревают на водяной бане. Выделяющиеся пары аммиака окрасят лакмусовую бумагу в синий цвет, а фенолфталеиновую - в красный.
Реакция с реактивом Несслера
K2[HgI4] + KOH.
Образуется аморфный осадок бурого цвета - иодид амминоксодиртути (II) (иодид оксомеркураммония).
|
|
|
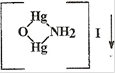
NH4Cl + 2K2[HgI4] + 4KOH ↔ + KCl + 7 KI + 3H2O
Методика проведения реакции в "газовой камере": в тигель помещают 3-5 капель раствора хлорида аммония и такое же количество щёлочи. На предметное стекло наносят каплю тетраиодомеркурата (II) калия. Накрывают тигель стеклом каплей вниз и осторожно нагревают. На стекле появится бурое пятно.
Качественный химический анализ аниона Cl -
Анион хлора (Cl-) относится к третьей аналитической группе анионов. Хлорид-ион является анионом весьма сильной кислоты (KHCl= 1·107).
Анион хлора является восстановителем, окисляясь чаще всего до молекулярного хлора.
В химическом анализе используют восстановительные свойства хлорид-иона по отношению к ряду реагентов:
. К перманганату калия в сернокислой среде:
10NH4Cl + 2KMnO4 + 8H2SO4 ↔ 5Cl2 + 2MnSO4 + K2SO4 + 5(NH4)2SO4 + 8H2O
химический хлорид аммоний рефрактометрический
Аналитический сигнал: обесцвечивание раствора KMnO4.
Для окисления хлорид-ионов необходимы жёсткие условия - нагревание в присутствии 3М H2SO4.
. К дихромату калия в сернокислой среде:
NH4Cl + K2Cr2O7 + 3 H2SO4 ↔ K2SO4 + 2CrO2Cl2↑ + 2(NH4)2SO4 + 3H2O
|
|
|
Аналитический сигнал: изменение цвета раствора от оранжево-жёлтого до зелёного (Cr3+) или красно-бурого (CrO2Cl2 - хлористый хромил).
Реакция с раствором AgNO3 (ГФ).
Методика: к 2 каплям раствора хлорида аммония прибавляют 1 каплю разбавленной HNO3 и 3 капли раствора AgNO3. Наблюдаемый белый творожистый осадок растворим в NH4OH и насыщенном растворе (NH4)2CO3.
NH4Cl + AgNO3 → AgCl↓ + NH4NO3
Раствор [Ag(NH3)2]Cl делят на 2 части: к одной добавляют концентрированную HNO3 до кислой реакции среды, к другой - концентрированный раствор KI. Наблюдают выпадение осадков или помутнение раствора.
[Ag(NH3)2]Cl + 2HNO3 ↔ AgCl↓ + 2NH4NO3
[Ag(NH3)2]Cl + KI + 2H2O ↔ AgI↓ + KCl + 2 NH4OH
Количественный химический анализ
Количественный анализ осуществляется различными методами анализа по определённым методикам.
В основе количественного химического анализа лежит измерение интенсивности аналитического сигнала (масса, объёма), по которой рассчитывают массовое содержание (Q) или массовую долю (ω, %) вещества или его составных частей в анализируемом объекте.
Аналитическую навеску для проведения анализа берут в виде точного объёма (V) жидкого или газообразного вещества, или в виде точной массы (а) твёрдого материала.
|
|
|
Дата добавления: 2021-04-24; просмотров: 164; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
