Определение количества фаз, независимых компонентов и числа степеней свободы
Рассматриваемая система состоит из одной фазы (газообразной), которая представляет смесь газов  ;
; 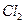 ;
;  Таким образом, ф = 1. Число независимых компонентов
Таким образом, ф = 1. Число независимых компонентов 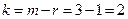 , так как
, так как 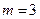 ,
,  .
.
По правилу фаз Гиббса (12): 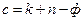 .
.
Число степеней свободы «с» (вариантность системы) для рассматриваемой системы:  .
.
Определение возможного направления протекания реакции и равновесного состава газовой смеси
Классический способ расчета
Для ответа на поставленный вопрос необходимо рассчитать константу равновесия при заданной температуре (Т = 650 К) и величину 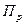 при содержании СО, равном 10% об., С l 2 – 20% об. и С OCl 2 – 70% об., а также общем давлении, равном 2026 гПа=202600 Па.
при содержании СО, равном 10% об., С l 2 – 20% об. и С OCl 2 – 70% об., а также общем давлении, равном 2026 гПа=202600 Па.
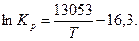
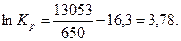
В соответствии с уравнением реакции произведение фактических парциальных давлений запишется в виде:
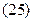
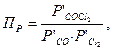
где 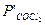 ,
, 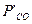 ,
,  - фактические парциальные давления
- фактические парциальные давления
 ,
, 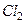 ,
, 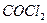 соответственно, выраженные в относительных единицах.
соответственно, выраженные в относительных единицах.
Для нахождения относительного давления следует давление, выраженное в паскалях, разделить на стандартное давление, равное 101325 Па.
Найдем общее давление, выраженное в относительных единицах по уравнению (16):
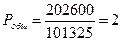
По закону Дальтона парциальное давление компонента газовой смеси равно общему давлению, умноженному на объемную долю данного компонента:
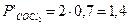

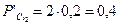
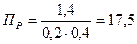
Так как 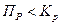 , то при заданных условиях
, то при заданных условиях 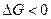 и возможное направление реакции - слева направо, то есть в сторону образования
и возможное направление реакции - слева направо, то есть в сторону образования 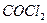 .
.
Равновесный состав газовой смеси рассчитывается при заданной температуре по известной константе равновесия.
|
|
|
Рассмотрим эту задачу на примере реакции

Дано: общее давление 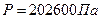 , исходные количества веществ равны (слева направо) 0,1; 0,2; 0,7 молей,
, исходные количества веществ равны (слева направо) 0,1; 0,2; 0,7 молей,  .
.
Запишем под уравнением реакции исходные и равновесные числа молей компонентов:
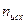
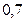
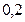
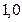
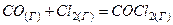
 | |||||||
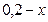 |  | ||||||
 | |||||||
Суммарное количество молей газообразных веществ равно
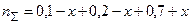
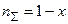

Мольные доли каждого вещества в момент равновесия равны:
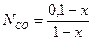 ;
; 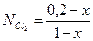 ;
; 
Умножим каждую мольную долю на общее давление, выраженное в относительных единицах. При этом получим парциальные давления газообразных реагентов (конденсированные вещества при этом не учитываются).
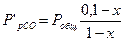 ;
; 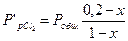 ;
;  ;
;
Равновесный состав газовой смеси рассчитывается из выражения константы равновесия рассчитываемой реакции:
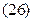
где 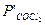 ,
, 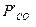 ,
,  - равновесные парциальные давления
- равновесные парциальные давления
 ,
, 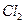 ,
, 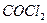 соответственно, выраженные в относительных единицах.
соответственно, выраженные в относительных единицах.
Подставим 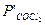 ,
, 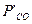 ,
,  в выражение (26).
в выражение (26).
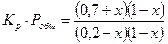
После простых преобразований получаем уравнение:


В результате решения получаем два корня:
 ;
; 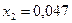
Физический смысл имеет только второй корень. Подставляя значения х2 в уравнение для расчета парциальных давлений находим равновесные мольные доли:
|
|
|
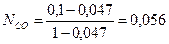

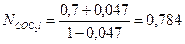
Переводим доли в объемные проценты:
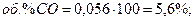
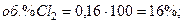
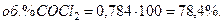
Другие случаи расчета равновесного состава газовой смеси
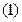 Среди реакций предложенных в настоящем задании лишь немногие имеют константы равновесия, близкие к единице (обратимыереакции). Чаще встречаются случаи необратимых реакций, когда величина константы равновесия либо очень велика (Кр>>103), либо очень мала (Кр<<103). Кроме того, газовая фаза может содержать более двух компонентов. Рассмотрим произвольную реакцию:
Среди реакций предложенных в настоящем задании лишь немногие имеют константы равновесия, близкие к единице (обратимыереакции). Чаще встречаются случаи необратимых реакций, когда величина константы равновесия либо очень велика (Кр>>103), либо очень мала (Кр<<103). Кроме того, газовая фаза может содержать более двух компонентов. Рассмотрим произвольную реакцию:
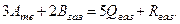
с исходной концентрацией реагентов 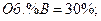
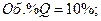
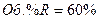 , что соответствует их мольным долям:
, что соответствует их мольным долям: 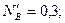
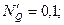
 при общем давлении:
при общем давлении: 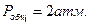 .
.
а. Константа равновесия очень велика
Для реакции (I) константа равновесия опишется уравнением
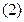
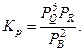
Т.к. константа равновесия очень велика, например Кp = 1034, то очевидно, что реакция, при данных фактическихконцентрациях реагентов, протекает необратимо вправо. При этом концентрация продуктов реакции будет увеличиваться, a исходных веществ - уменьшаться. Если число молей вещества R увеличится на "х", то число вещества Qувеличитсяна "5x", а число молей реагента B уменьшится на "2х".
Таким образом, при равновесии количество молей реагентов будут определяться величинами: 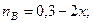
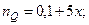
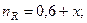
|
|
|
Мольные доли компонентов составят:
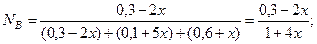
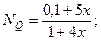
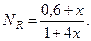
Равновесные парциальные давления:

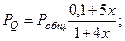
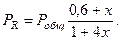
Подставив эти значения в уравнение (2) получим:
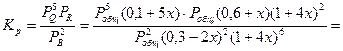
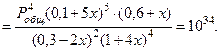
Левая часть уравнения представляет собой отношение двух конечных чисел, а правое очень большое число (1034). Такая ситуация возможна только в случае, если знаменатель стремится к нулю, т.е. либо  или
или  Приравнивая последние уравнение к нулю и решая их. Получим два корня:
Приравнивая последние уравнение к нулю и решая их. Получим два корня: 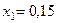 и
и 
Физический смысл имеет положительный корень, тогда равновесные мольные доли реагентов составят:
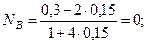
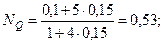
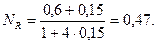
Таким образом, равновесная газовая фаза будет состоять только из двух реагентов: Q и R, причем их содержание в ней будет:
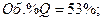
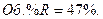
b. Константа равновесия очень мала
Поскольку константа равновесия очень мала, например Кp = 10 – 34, то очевидно, что реакции, при данных фактических концентрациях реагентов, протекает необратимо влево. При этом концентрация продуктов реакции будет уменьшаться, а исходных веществ - увеличиваться, Если число молей вещества R уменьшится на "х", то число вещества Q уменьшится на "5х", а число молей реагента B увеличится на "2х".
Таким образом, при равновесии количество молей реагентов будут определяться величинами: 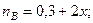
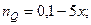
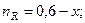
При этом их мольные доли составят:
|
|
|
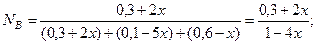
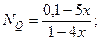

Равновесные парциальные давления определяются:
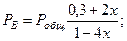
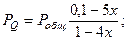
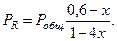
Подставив эти значения в уравнение (2) получим:
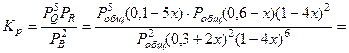
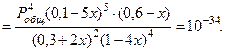
Левая часть уравнения представляет собой отношение двух конечных чисел, а правая очень малое число (10 – 34). Такая ситуация возможна только в случае, если числитель стремится к нулю, т.е. либо 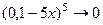 или
или 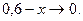 Приравнивая последние уравнения к нулю и решая их. Получим два корня:
Приравнивая последние уравнения к нулю и решая их. Получим два корня: 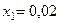 и
и 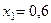 . Физический смысл имеет первый корень, т.к. в случае допущения правильности второго корня получится отрицательное количество компонента Q. Равновесные мольные доли реагентов составят:
. Физический смысл имеет первый корень, т.к. в случае допущения правильности второго корня получится отрицательное количество компонента Q. Равновесные мольные доли реагентов составят:
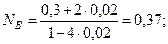

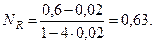
Таким образом, равновесная газовая фаза будет состоять только из двух реагентов: В и R, причем их содержание в ней будет:
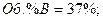
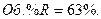
Дата добавления: 2021-03-18; просмотров: 164; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
