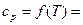РАСЧЕТНО-ГРАФИЧЕСКОЕ ЗАДАНИЕ №1
По дисциплине «Физическая химия»
Раздел «Термодинамика»
вариант 1-21
Выполнил
Студент гр. ТМ-03 (подпись) С.В. Некрасов
Проверила
Проф., канд. техн. наук (подпись) Э.В. Дюльдина
Магнитогорск
2013
ПРИЛОЖЕНИЕ 4
ПРИМЕР ВЫПОЛНЕНИЯ ЗАДАНИЯ
В начале расчета необходимо переписать формулировку задания, вписывая вместо многоточия исходные данные, взятые из табл.1. После подстановки стехиометрических коэффициентов (см. задание 21 в варианте 1) уравнение реакции примет вид:

Для удобства последующих расчетов составляем таблицу исходных данных, используя справочный материал.
Таблица 2
Исходные данные для термодинамического исследования реакции: 
| № п/п | Вещество |
кДж/моль | Дж/моль•К | Коэффициенты в уравнении =а + b Т + с'Т -2, Дж/моль∙К | ||
| а | 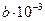
| 
| ||||
| 1 | CO (Г) | -110,53 | 197,55 | 28,41 | 4,10 | -0,46 |
| 2 | Сl2 (Г) | 0 | 222,98 | 37,03 | 0,67 | -2,85 |
| 3 | СОС12 (Г) | -219,50 | 283,64 | 67,15 | 12,03 | -9,04 |
Составление уравнения зависимости от температуры величины теплового эффекта и изменения энтропии
Зависимость теплового эффекта реакции от температуры определяется законом Кирхгофа (1):
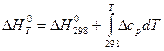
Рассчитаем 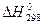 по уравнению (2):
по уравнению (2):


Рассчитаем 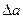 :
:
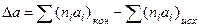
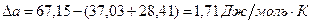
Рассчитаем 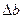 :
:
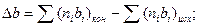
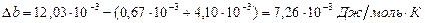
Рассчитаем 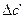 :
:
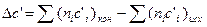

Рассчитаем 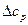 :
:


Найдем тепловой эффект по уравнению (1):
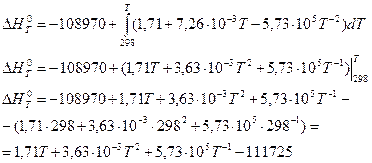
Уравнение зависимости от температуры величины теплового эффекта:
|
|
|
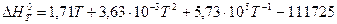
Составим теперь уравнение зависимости от температуры изменения энтропии.
Изменение энтропии системы в результате протекания процесса определяется по уравнению (7)
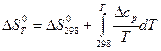
Рассчитаем 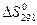 по уравнению (8):
по уравнению (8):

Значения  для соответствующих веществ приведены в таблице 2, после их подстановки получим:
для соответствующих веществ приведены в таблице 2, после их подстановки получим:
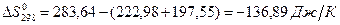
Найдем изменение энтропии системы по уравнению (7):

Уравнение зависимости от температуры изменения энтропии:

2. Вычисление величин  ,
,  ,
,  и
и  при различных температурах и построение графиков в координатах
при различных температурах и построение графиков в координатах  ;
; 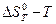 ;
;  и
и 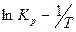
Определение теплового эффекта реакции при различных
температурах
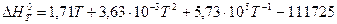

Рассчитаем по аналогии тепловой эффект реакции для других температур заданного интервала (300 – 750 К) и данные занесем в таблицу 3.
Таблица 3
Величина  при различных температурах для реакции:
при различных температурах для реакции: 
| T , K | 300 | 350 | 400 | 450 | 500 |

| -108975 | -109045 | -109028 | -108947 | -108817 |
| Т, К | 550 | 600 | 650 | 700 | 750 |

| -108645 | -108437 | -108198 | -107931 | -107637 |
По данным таблицы 3 построим график 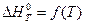 (рис.1)
(рис.1)
Рис.1 Зависимость теплового эффекта реакции
 от температуры
от температуры
Определение изменения энтропии при различных
температурах
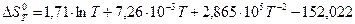
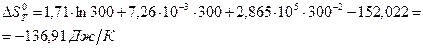
Рассчитаем по аналогии изменение энтропии для других температур заданного интервала (300 – 750 К) и данные занесем в таблицу 4.
|
|
|
Таблица 4
Значения изменения энтропии  при различных
при различных
температурах
| Т, К | 300 | 350 | 400 | 450 | 500 |
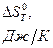
| -136,91 | -137,13 | -137,08 | -136,89 | -136,62 |
| Т, К | 550 | 600 | 650 | 700 | 750 |
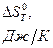
| -136,29 | -135,93 | -135,55 | -135,15 | -134,75 |
По данным таблицы 4 построим график 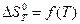 (рис.2)
(рис.2)
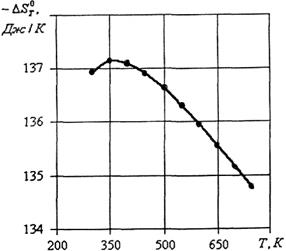
Рис.2 Зависимость изменения энтропии от температуры для реакции

Расчет изменения стандартной энергии Гиббса
При расчете изменения стандартной энергии Гиббса для реакции воспользуемся уравнением Гиббса- Гельмгольца(9):
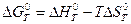
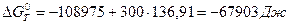
Рассчитаем по аналогии изменение стандартной энергии Гиббса для других температур заданного интервала (300 - 750К) и данные занесем в табл.5
Таблица 5
Значения изменения стандартной энергии Гиббса (  ) при различных температурах
) при различных температурах
| Т, К | 300 | 350 | 400 | 450 | 500 |

| - 67903 | -61051 | -54195 | - 47345 | - 40507 |
| Т, К | 550 | 600 | 650 | 700 | 750 |
| - 33684 | - 26878 | -20091 | -13324 | -6576 |
По данным таблицы 5 построим график  (рис.3)
(рис.3)
Расчет константы равновесия
Константа равновесия связана с изменением стандартной энергии Гиббса соотношением (10):
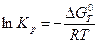
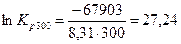
Рассчитаем по аналогии  для других температур заданного интервала (300 - 750К) и данные занесем в табл.6.
для других температур заданного интервала (300 - 750К) и данные занесем в табл.6.
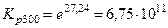
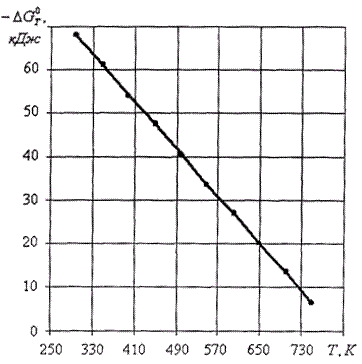
Рис.3 Зависимость изменения Стандартной энергии Гиббса от температуры для реакции 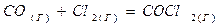
|
|
|
Таблица 6
Константы равновесия для реакции
 при различных температурах
при различных температурах
| Т, К | 300 | 350 | 400 | 450 | 500 |
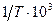
| 3,33 | 2,86 | 2,50 | 2,22 | 2,00 |
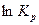
| 27,24 | 20,99 | 16,30 | 12,66 | 9,75 |

| 6,75∙1011 | 1,31∙109 | 1,20∙107 | 3,15∙105 | 1,71∙104 |
| Т, К | 550 | 600 | 650 | 700 | 750 |
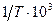
| 1,82 | 1,67 | 1,54 | 1,43 | 1,33 |
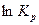
| 7,37 | 5,39 | 3,72 | 2,29 | 1,05 |

| 1,59∙103 | 2,19∙102 | 4,13∙10 | 9,88 | 2,87 |
Реакции, для которых значения константы равновесия находятся в пределах от10-3 до 103 (10-3 < Kp < 103) принято считать практически обратимыми. Уменьшение Кр с ростом температуры означает, что равновесие реакции при этом сдвигается справа налево.
При 650 Креакция 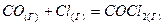 обратимая.
обратимая.
По данным табл.6 построим график 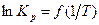 (рис.4).
(рис.4).
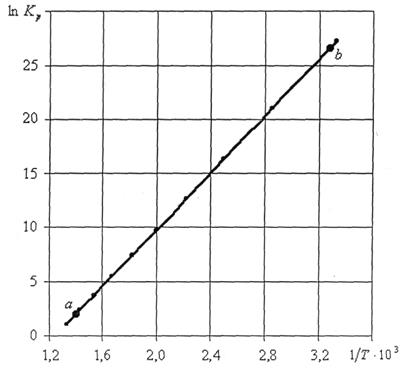
Рис.4 Зависимость 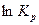 от обратной температуры для реакции
от обратной температуры для реакции 
3. Выведение приближенного уравнения вида  где А, В – постоянные
где А, В – постоянные
Пользуясь графиком 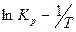 , найдем коэффициент А . После подстановки выражения (9) в уравнение (10) получим:
, найдем коэффициент А . После подстановки выражения (9) в уравнение (10) получим:
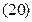

Можно полагать, что в сравнительно небольшом интервале температур тепловой эффект реакции и изменение энтропии практически постоянные величины (это подтверждают и результаты табл. 3 и 4). Отсюда уравнение можно записать в виде:
|
|
|

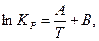
где А и В - постоянные, которые соответственно равны:
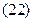
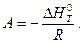
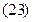

Уравнение (21) отвечает линейной зависимости Определим коэффициенты А и В графически.
Точки на графике практически ложатся на прямую, тангенс угла которой к оси абсцисс численно равен коэффициенту А в уравнении (21). Для нахождения величины тангенса возьмем на прямой произвольно две точки “а” и “b” (рис. 4)и определим численные значения их ординат и абсцисс. Можно записать:
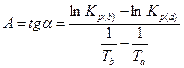
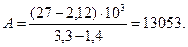
Для определения численного значения В из табл.6 возьмем значение 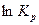 при 350К (53,99).
при 350К (53,99).
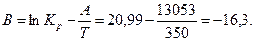
Итак, приближенное уравнение зависимости константы равновесия от температуры имеет вид:
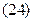
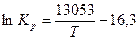
Последнее уравнение позволяет рассчитать значение  при любой температуре, если последняя находится в заданном интервале (то есть в пределах 300 – 750К) или незначительно вы ходит за этот интервал.
при любой температуре, если последняя находится в заданном интервале (то есть в пределах 300 – 750К) или незначительно вы ходит за этот интервал.
По значениям коэффициента А и В рассчитаем величину среднего теплового эффекта реакции и изменения энтропии.
Согласно уравнениям (22) и (23) имеем:
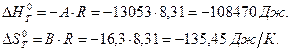
Полученные данные неплохо согласуются с данными, приведенными в табл. 3 и 4, а это значит, что расчет проведен правильно.
Дата добавления: 2021-03-18; просмотров: 78; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!


 ,
,