Вопросы и упражнения для подготовки к семинару и проверочной работе
по темам: «Строение атома. Периодический закон и периодическая система элементов Д.И.Менделеева», «Химическая связь и строение молекул».
Контрольные вопросы:
1. Модель Бора. Современные представления о строении атома: уравнение Шредингера.
2. Луи де Бройль - дуализм “волна-частица”.
3. Принцип неопределенности Гейзенберга.
4. Главное квантовое число. Какие свойства электрона и орбитали оно характеризует, какие значения принимает?
5. Главное квантовое число. Какие значения оно принимает? Понятие об энергетическом уровне.
6. Орбитальное квантовое число. Какие свойства электрона и орбитали оно характеризует, какие значения принимает?
7. Форма s и p орбиталей. Приведите значения орбитального квантового числа для s -, p -, d - и f - подуровней.
8. Магнитное квантовое число. Что оно характеризует, какие значения принимает?
9. Взаимная ориентация орбиталей. Приведите значения магнитного квантового числа для s -, p -, d - и f - подуровней.
10. Спиновое квантовое число, какие значения принимает?
11. Принцип и последовательность заполнения энергетических уровней и подуровней в многоэлектронных атомах.
12. Периодический закон Д.И.Менделеева. Современная формулировка периодического закона. Периодическая система элементов: периоды и группы элементов.
13. Причина периодического повторения свойств элементов.
14. s -, p -, d - и f - элементы. Особенности строения их электронной оболочки. Расположение в периодической системе.
|
|
|
15. Длинопериодная и короткопериодная формы таблицы Д.И. Менделеева.
16. Радиус атома. Изменение этого параметра по периодам и группам периодической системы.
17. Энергия ионизации, сродство к электрону. Изменение этих параметров по периодам и группам периодической системы.
18. Электроотрицательность. Изменение этого параметра по периодам и группам периодической системы. Назовите элементы, имеющие максимальное и минимальное значение электроотрицательности.
Упражнения
Задание 1: Распределите электроны по четырем квантовым числам в электронной оболочке данного элемента (таблица). Составьте электронную формулу. В какой уровень, и в какой подуровень поступает последний электрон при заполнении электронной оболочки? Укажите тип элемента (s -, p -, d -). Где расположены элементы этого типа в периодической системе? Сколько их всего?
Варианты задания 1: 1) Фосфор; 2) Хром; 3) Хлор; 4) Ванадий; 5) Железо;6) Кальций; 7) Натрий; 8) Алюминий; 9) Марганец; 10) Медь; 11) Мышьяк; 12) Скандий; 13) Сера; 14) Никель; 15)Титан; 16) Рубидий; 17) Цирконий; 18) Селен; 19) Молибден; 20)Бром.
Задание 2: Составьте электронные формулы следующих ионов:
|
|
|
Варианты задания 2: 1) S2-; 2) Cl-; 3) Mn2+; 4) Na+; 5) Al3+; 6) Fe2+; 7) F-; 8) Са2+; 9) Cu2+; 10) O2-; 11) Co2+; 12) Cr3+; 13) Se2-; 14) Mg2+; 15) Zn2+.
Задание 3: Укажите значения четырёх квантовых чисел для одного из электронов внешнего электронного уровня атомов:
Варианты задания 3. 1) P; 2) C; 3) S; 4) Al; 5) N; 6) O; 7) Ca; 8) Pb; 9)B; 10) Cl; 11) Fe; 12) As; 13) Cd; 14) Mn; 15) Ni.
Задание 4: Какие орбитали взаимодействующих атомов участвуют в образовании химических связей в данной молекуле? Составьте схему перекрывания валентных орбиталей в этой молекуле и укажите ее форму. Будет ли эта молекула полярной?
Варианты задания 4: 1) фторид бора, BF3; 2) вода, Н2О; 3) фосфин, РН3; 4) аммиак, NH3; 5) хлорид бериллия, BeCl2; 6) сероводород, H2S; 7) фторид кальция, CaF2; 8) хлорид бора,BCl3; 9) азот, N2; 10) тетрахлорид углерода,CCl4; 11) метан, CH4; 12) хлорид алюминия, AlCl3; 13) хлорид бериллия, BeCl2; 14)моносилан, SiH4; 15) трихлорид фосфора, РCl3 ; 16) хлорид магния, MgCl2; 17) фосфин, РН3; 18) аммиак, NH3; 19) фторид бериллия BeF2; 20)вода Н2О.
Варианты домашних заданий
По темам: «Строение атома. Периодическая система элементов», «Химическая связь и строение молекул».
| Вариант | Контр. вопросы | Упражнения | |||
| Задание 1 | Задание 2 | Задание 3 | Задание 4 | ||
| 1 | 16 | 7 | 1 | 8 | 1 |
| 2 | 3 | 4 | 2 | 7 | 2 |
| 3 | 5 | 14 | 3 | 6 | 3 |
| 4 | 4 | 11 | 4 | 5 | 4 |
| 5 | 14 | 5 | 5 | 4 | 5 |
| 6 | 10 | 18 | 6 | 3 | 6 |
| 7 | 13 | 8 | 7 | 2 | 7 |
| 8 | 17 | 15 | 8 | 1 | 8 |
| 9 | 8 | 1 | 11 | 15 | 9 |
| 10 | 6 | 10 | 13 | 7 | 10 |
| 11 | 7 | 2 | 15 | 11 | 11 |
| 12 | 12 | 19 | 14 | 13 | 12 |
| 13 | 3 | 6 | 12 | 10 | 13 |
| 14 | 1 | 12 | 10 | 1 | 14 |
| 15 | 15 | 9 | 9 | 12 | 15 |
| 16 | 18 | 3 | 7 | 4 | 16 |
| 17 | 9 | 13 | 4 | 5 | 17 |
| 18 | 2 | 16 | 3 | 8 | 18 |
| 19 | 11 | 17 | 5 | 10 | 19 |
| 20 | 4 | 20 | 1 | 6 | 20 |
| 21 | 12 | 1 | 2 | 4 | 9 |
| 22 | 8 | 3 | 6 | 3 | 10 |
| 23 | 10 | 5 | 10 | 2 | 1 |
| 24 | 5 | 11 | 9 | 11 | 3 |
| 25 | 7 | 10 | 15 | 15 | 8 |
| 26 | 1 | 8 | 13 | 9 | 12 |
| 27 | 3 | 18 | 14 | 7 | 15 |
| 28 | 9 | 19 | 12 | 8 | 7 |
| 29 | 17 | 2 | 11 | 14 | 4 |
| 30 | 18 | 4 | 8 | 13 | 6 |
|
|
|
Рекомендации по выполнению упражнений
Электронные формулы атомови их графическое изображение
Распределение электронов по уровням и подуровням принято представлять в виде условной электронной записи (электронной формулы).
|
|
|
Пример 1.Распределите электроны по четырем квантовым числам в электронной оболочке атома азота (таблица). Составьте электронную формулу. В какой уровень, и в какой подуровень поступает последний электрон при заполнении электронной оболочки? Укажите тип элемента (s -, p -, d -). Где расположены элементы этого типа в периодической системе? Сколько их всего?
Атом азота N расположен во 2 периоде и имеет порядковый номер = 7, соответственно в атоме углерода 7 электронов, которые располагаются на двух уровнях n =1 и n=2.
Электронная формула имеет вид: 1s22s2p3,
где 1, 2 – значения главного квантового числа n;
s , p – буквенное обозначение орбитального квантового числа ℓ;
индексы (2, 3) у буквенных обозначений ℓ - число электронов на соответствующих подуровнях.
Однако такая форма не всегда достаточна, так как не указывает значения магнитного (m) и спинового (s) квантовых чисел. Поэтому используют также графическое изображение распределения электронов по уровням в виде таблицы. ( Значение спинового квантового числа обозначают стрелками: ↑ - «  », ↓ - «
», ↓ - « 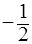 ».)
».)
Пример 2.Распределите электроны по четырем квантовым числам в электронной оболочке атома скандия (таблица). Составьте электронную формулу. В какой уровень, и в какой подуровень поступает последний электрон при заполнении электронной оболочки? Укажите тип элемента (s -, p -, d -). Где расположены элементы этого типа в периодической системе? Сколько их всего?
Электронные формулы ионов
Число электронов в атомах равно положительному заряду ядра, выраженному в единицах элементарного заряда. Атом электронейтрален. При удалении от атома одного или нескольких валентных электронов образуется положительный ион
(А0 –nе = Аn+) , при присоединении к атому электронов
(A0 + ne = An-) - отрицательный ион.
Пример 3.Составьте электронную формулу иона К+.
Атом калия в Периодической системе элементов Д.И. Менделеева расположен в 4-ом периоде, в IA группе. Порядковый номер элемента – 19. Электронная формула атома К – 1s22s22p63s23p64s1. Положительно заряженный ион калия К+ образуется в результате отрыва от атома калия одного электрона внешнего уровня, соответственно электронная формула иона К+ - 1s22s22p63s23p64s0.
Пример 4. Составьте электронную формулу иона Br -.
Атом брома в Периодической системе элементов Д.И. Менделеева расположен в 4-ом периоде, в VIIA группе. Порядковый номер элемента – 35. Электронная формула атома Br : 1s22s22p63s23p64s2 4p5. Отрицательно заряженный ион брома Br- образуется в результате присоединения к атому брома одного электрона на внешний уровень, соответственно электронная формула иона Br - : 1s22s22p63s23p64s24p6.
Квантовые числа
Состояние каждого электрона в атоме описывается четырьмя квантовыми числами:
1. главным квантовым числом – n , которое принимает целочисленные положительные действительные значения: 1, 2, 3, . . . . . до ∞;
2. орбитальным квантовым числом – ℓ, которое принимает целочисленные положительные значения от 0 до (n – 1). Его принято обозначать не только цифрами, но и латинскими буквами:
Значения ℓ: 0, 1, 2, 3, 4, …….
Обозначение ℓ: s , p , d , f , g , ……..;
3. магнитным квантовым числом – m , которое принимает значения от (- ℓ), 0, до (+ℓ).
При ℓ = 0 возможно единственное значение m = 0. Действительно для симметричной s – орбитали возможен единственный способ ее ориентации в пространстве.
Для р – орбитали ℓ = 1. Трем значениям магнитного квантового числа: m = -1, 0, +1
4. спиновым квантовым числом– s , которое может иметь только два значения  и
и 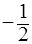 , т.е. отличаться как и остальные квантовые числа на единицу.
, т.е. отличаться как и остальные квантовые числа на единицу.
Пример 5. Укажите значения четырех квантовых чисел для одного из электронов внешнего уровня атома фосфора.
Фосфор (Р) – порядковый номер 15, следовательно, атом фосфора содержит 15 электронов. Электронная формула – 1s22s2p63s2p3, т.е. на внешнем уровне атома фосфора 5 электронов: два электрона на s – подуровне и три на р – подуровне.
Для одного из s – электронов значения квантовых чисел:
n = 3,
ℓ = 0,
m = 0,
s =  .
.
Для одного из р – электронов значения квантовых чисел:
n = 3,
ℓ =0,
m = +1,
s =  .
.
Дата добавления: 2021-01-21; просмотров: 99; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
