Спиновое квантовое число – s .
Квантовые числа n, ℓ, m не полностью характеризуют движение электронов в атомах. Исследования показали, что электрон имеет свойство, называемое спин. Упрощенно спин можно представить как способ движения (спин) электрона вокруг своей оси (собственный момент количества движения электрона в атоме). Поэтому в теорию строения атома введено еще спиновое квантовое число s, которое может иметь только два значения, численно обозначаемые  и
и 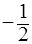 , т.е. отличаются как и остальные квантовые числа на единицу.
, т.е. отличаются как и остальные квантовые числа на единицу.
Четыре квантовых числа n, ℓ, m, и s полностью характеризуют движение электрона в атоме. Никаких других независимых от квантовых чисел характеристик у этого движения не может быть.
Поскольку энергия электрона в атоме водорода определяется величиной – n и не зависит от остальных квантовых чисел, то может быть несколько состояний электронов с одинаковой энергией. Эти состояния являются вырожденными (р – трижды вырожденные, d – пять раз вырожденные, , f – семьраз вырожденные). Вырождение исчезает при воздействии на электронв атоме внешнего электрического или магнитного поля. Электрон с одним и тем же значением n, но разными m и s по разному взаимодействуют с внешним полем, в результате энергии электрона в этих состояниях становятся неодинаковыми. Этим объясняется расщепление спектральных линий при помещении источника излучения в электрическое или магнитное поле
|
|
|
2.2.4. Многоэлектронные атомы.
Формирование электронной оболочки многоэлектронных атомов происходит в соответствии со следующими правилами (принципами):
4. принцип минимальной энергии
Электрон в атоме занимает такое положение, чтобы его энергия была минимальна.
В многоэлектронных атомах состояние каждого электрона определяется также значениями четырех квантовых чисел n, ℓ, m, и s, которые принимают те же значения, что и для атома водорода. Но, в многоэлектронных атомах электрон движется не только в поле ядра, но и в поле других электронов. Поэтому энергия электронов в таких атомах определяется значениями двух квантовых чисел n и ℓ. При этом энергия возрастает как с увеличением n, так и ℓ. Зависимость энергии от орбитального квантового числа становится тем большей, чем больше электронов в атоме.
2. принцип (запрет) Паули (открыт в 1925 г)
Согласно этому принципу в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковыми.
Хотя бы одно n, ℓ, m, s должно отличаться, т.е. 1) в каждом энергетическом состоянии может находиться только один электрон; 2) каждая новая комбинация квантовых чисел определяет новое состояние.
|
|
|
Исходя из значений, которые могут принимать квантовые числа и на основании принципа Паули нетрудно определить максимальное число электронов в атоме, обладающих данным значением главного квантового числа:
n-1 ℓ=0 ℓ =1 ℓ =2
N = ∑ 2(2 ℓ +1) = 2(1 + 3 + 5…..) = 2n2. N макс. = 2 n 2 .
ℓ=0
Правило Гунда
В соответствии с этим правилом заполнение атомных орбиталей электронами происходит таким образом, чтобы в пределах квантового подуровня суммарный спин был максимальным.
Спин, определяемый собственным моментом импульса электрона, является векторной величиной, поэтому он обозначается стрелкой ↑ (  ) или ↓ (
) или ↓ ( 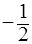 ). Суммарный спин двух электронов с противоположными спинами равен 0.
). Суммарный спин двух электронов с противоположными спинами равен 0.
Т.е. при одном и том же и значении орбитального квантового числа должно быть максимальное число электронов, имеющих одно и тоже направление (или  , или
, или 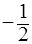 ).
).
Правило Клечковского
В 1961 г. русский ученый В.М. Клечковский сформулировал общее положение, согласно которому электрон занимает в основном состоянии уровень с наименьшим значением суммы ( n + ℓ), а если эти суммы равны, то вначале заполняется тот подуровень, где n имеет меньшее значение ( соответственно ℓ большее).
|
|
|
Последовательность энергетических уровней в порядке возрастания энергии примерно следующая:
1s < 2s < 2p < 3s < 3p < 4s ≈ 3d < 4p < 5s ≈ 4d < 5p < 6s ≈ 5d ≈ 4 f < 6p ...; т.е. уровни ns,
( n -1) d , ( n -2) f мало различаются по энергии и всегда имеют более низкую энергию, чем np .
Принцип минимальной энергии справедлив только для основного состояния атома. В возбужденном состоянии электроны могут находиться на любых орбиталях.
Электронные формулы
Распределение электронов по уровням и подуровням принято представлять в виде условной электронной записи (электронной формулы). Однако такая форма не всегда достаточна, так как не указывает значения магнитного (m) и спинового (s) квантовых чисел. Поэтому используют также графическое изображение распределения электронов по уровням в виде таблицы (значение спинового квантового числа обозначают стрелками: ↑ - «  », ↓ - «
», ↓ - « 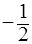 »). Например, атом кислорода имеет порядковый номер 8, т.е. ядро содержит восемь положительных зарядов (протонов), следовательно, в поле ядра движется восемь электронов.
»). Например, атом кислорода имеет порядковый номер 8, т.е. ядро содержит восемь положительных зарядов (протонов), следовательно, в поле ядра движется восемь электронов.
Атом кислорода 8О расположен во 2 периоде, его электроны располагаются на двух уровнях n =1 и n=2.
Электронная формула имеет вид: 1s22s2p4,
|
|
|
где 1,2 – значения главного квантового числа n;
s , p – буквенное обозначение орбитального квантового числа ℓ;
индексы (2, 3) у буквенных обозначений ℓ - число электронов на соответствующих подуровнях.
Графическое изображение распределения электронов по уровням в виде таблицы имеет следующий вид:
| ℓ=0 m=0 | ℓ=1 m= -1 0 +1 | ℓ=2 m=
-2 -1 0 +1 +2 | |||||||
| n=1 | ↑↓ | ||||||||
| n=2 | ↑↓ | ↑↓ | ↑ | ↑ | |||||
| n=3 | |||||||||
Из таблицы видно, что последний электрон поступает во второй уровень, p - подуровень. Это p- элемент.
Лекция 3
Дата добавления: 2021-01-21; просмотров: 241; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
